-
据全国土壤污染调查公报显示,我国铜污染点位超标率已达2.1%[1],污染区主要分布于中国南方,农业生产和矿区开采等活动均会加剧铜污染[2−3]. 近年越来越多的研究表明,禽畜粪便是土壤铜输入的重要来源,因为铜常作为生长促进剂被添加进饲料里[4−5]. 铜很容易通过食物链和日常的手口接触等暴露途径进入人体,对人体健康产生严重威胁[6−7]. 铜是人体必需营养元素,但过量积累也可能导致铜中毒[8],增大人体患心血管疾病、关节炎或癌症的风险. 铜的毒性主要取决于其生物有效性,铜的生物有效性主要取决于其赋存形态,有效态铜对其生物有效性和毒性影响最大[9]. 铜以自由离子、有机结合态、无机结合态、矿物晶格结合态等形式存在于土壤中[10],但仅水溶性游离态和有机及无机络合态是较容易被植物吸收的有效形态[11]. 如Tessier提取法中有效态铜主要指交换态和碳酸盐结合态,该法将土壤重金属分为5种形态:交换态(包括水溶自由离子态、无机络合态等)、碳酸盐结合态、铁锰氧化物结合态、有机结合态、残渣态(包裹在原生和次生矿物晶格中)[12]. 但就迁移能力和生物有效性来说,(1)交换态迁移能力最强,生物有效性最高;(2)碳酸盐结合态对环境条件敏感,酸性条件极易释放,生物有效性较高[12];(3)铁锰氧化物结合态和有机结合态生物有效性较低;(4)残渣态迁移能力最差,生物有效性最低[13]. 孙境蔚等[14]调查系列茶园土壤-茶树体系中重金属生物有效性发现,重金属总量对重金属生物有效性影响不大. 同时茶树根系中Cu含量与土壤有效态铜呈显著正相关,表明茶树根系中Cu主要来自于土壤中有效态铜. 因此深入了解土壤有效态铜的迁移转化将有利于预测并控制土壤铜的环境风险,但目前关于土壤有效态铜的现场快速表征技术还比较缺乏.
过去往往通过连续提取或一次提取等化学提取方法来表征重金属的形态,除上文提到的Tessier法[15],还有Sposito等[16]提出的方法以及BCR化学提取方法. 但用这些方法提取的不同形态Cu是人为操作定义,并不能反映重金属的真实形态. 梯度扩散薄膜技术(diffusive gradients in thin-films, DGT)是提取有效态重金属的新方法,DGT方法将在特定时间内穿过一定厚度具有特异性功能扩散膜并累积于吸附膜上的重金属称为有效态重金属[17]. DGT可原位提取有效态重金属,避免异位提取带来重金属形态转化等问题,如铁锰氧化物结合态含量下降[18]. DGT技术创新性引入动态过程概念,如DGT可更好地模拟植物根系吸收金属离子的过程,故其能更好地表征重金属的生物有效性. Philipps等[19]发现,相同复合污染环境下鱼类铜和铅的累积量与DGT累积提取量有较好相关性,并发现Pb累积量与Cu浓度显著正相关,这是因为Cu优先与有机配体结合并竞争Pb的吸附位点使Pb移动性和生物有效性增强. Wang等[20]也发现,DGT在模拟大米Cd生物有效性和野外河流Cu、Pb污染浓度等方面取得良好应用效果. Bai等[21]也发现,DGT同时预测Cu、Pb、Zn、Cr、Cd、As等植物有效性较之传统EDTA提取法具有更好的准确性. DGT在测定重金属生物有效性方面具有不可比拟的优势,但目前DGT原位富集重金属后必须带到实验室进行洗脱,然后用原子吸收分光光度法(AAS)、电感耦合等离子体发射光谱法(ICP-AES)和电感耦合等离子体质谱法(ICP-MS)测定. 该洗脱法不能在野外条件下直接应用,并且具有过程复杂、分析周期长、测试费用高等缺点[22]. 因此,寻找一种能够与DGT联用实现DGT提取的有效态重金属的现场直接测定的方法具有重要意义.
便携式X射线荧光光谱法(portable X-ray fluorescence spectrometry method,pXRF)是一种简便、快速的元素检测分析技术. 国际标准组织(ISO)、美国环境保护署(EPA)和职业安全与健康研究所(NIOSH)已将该方法作为元素标准分析方法之一. 目前,pXRF法已被广泛应用于地质勘探、采矿勘察、环境检测等领域[23]. de Lima等[24]基于pXRF测定了巴西热带农业区不同利用方式下的土壤组分含量,发现pXRF测定结果与实验室传统方法的测定结果一致并可准确测定植物有效态铜. Qu等[25−26]通过改进校正方法修正了土地利用类型、土壤水分、土壤有机质和土壤粒度等多种土壤因素空间异质性对测定的影响,实现了pXRF大范围土壤重金属快速准确测定. 但目前pXRF多直接应用于土壤样品测定重金属总量,未关注与土壤有效态重金属提取技术的联用实现有效态重金属的现场测定.
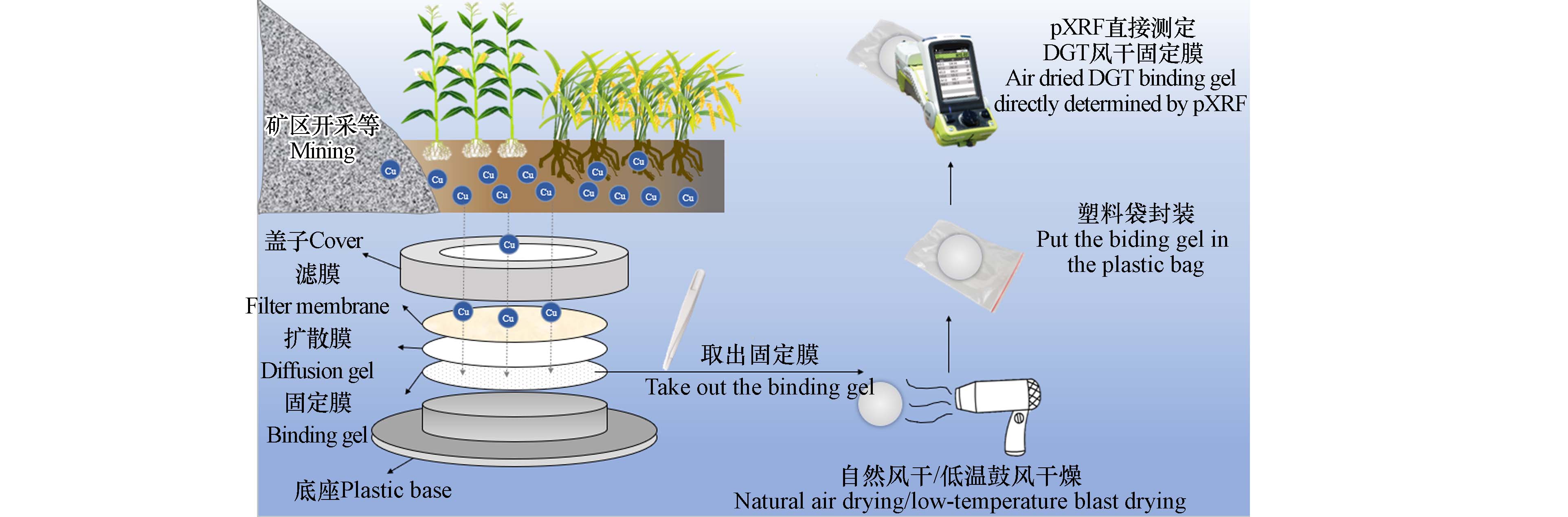
为实现有效态铜经DGT提取富集后无需经传统实验室洗脱进行直接分析测定,本研究将DGT与pXRF技术联用,采用pXRF直接测定DGT固定膜上的有效态铜含量.
-
本实验Chelex DGT装置购自中科智感环境科技有限公司(中国南京). 在室温条件下(25 ℃),将Chelex DGT装置浸泡在100 mL含有0、0.1、0.2、0.3、0.5、1、1.5 mmol·L−1 Cu(NO3)2溶液中,溶液中含有0.01 mol·L−1 NaNO3作为背景电解质. 用HNO3和NaOH调节溶液pH并稳定至4.0左右(以防止铜沉淀),每个浓度设置4次重复. 搅拌状态下吸附8 h后,用去离子水冲洗DGT外壳,取出结合相凝胶. 洗脱法测定DGT有效态铜时,将2份DGT固定膜置于1.8 mL 1 mol·L−1 硝酸溶液中,室温下洗脱24 h,然后取1 mL洗脱液稀释10倍后作为待测液,用AAS测定其铜浓度. DGT取出后,用移液枪移取10 mL剩余溶液,用AAS测定剩余溶液铜浓度即得平衡溶液Cu(Ⅱ)浓度(Csol),以确定DGT测定结果的准确性.
pXRF测定主要受水分、粒度、测试模式、测试时间等的影响[27]. 为消除水分、粒度对pXRF快速无损测定DGT固定膜活性铜含量的影响,需将未经研磨处理等DGT固定膜原状干燥. 将DGT固定膜置于室温下自然风干48 h或40 ℃鼓风干燥至固定膜恒重后,将风干的DGT固定膜分装至自封袋(普通塑料袋),然后用pXRF(Niton XL5,Thermo fisher scientific,USA)直接测定其DGT有效态铜含量. 前人研究已发现普通塑料袋对pXRF测定性能没有影响[28]. 便携式pXRF以50 kV银阳极-X射线管作为激发光源,检测器为具有石墨烯窗口的大型硅漂移检测器,以标准8 mm光斑尺寸进行大面积样品检测. 在pXRF仪器探头进行温度等自检完成后,均选定soil mode为分析模式. 由于pXRF的信号随着检测器和待测样品之间的距离呈指数衰减[29],测试时将pXRF贴紧装有DGT固定膜的自封袋,pXRF探头随机对准DGT中心区域(避免风干后DGT固定膜边缘轻微翘边的影响),扣动扳机90 s进行原位测定(该模式时间下能测出荧光区域高、中、低浓度梯度的铜). 本研究统一了pXRF测试模式(Soil mode)和测试时间(90 s),避免了pXRF测试模式和测试时间对读数准确性的影响.
将pXRF测定的DGT空白固定膜有效态铜信号值标准差(SD)的3倍作为pXRF直接测定DGT有效态铜方法的检出限[30].
-
以1:1:1:1:1比例配制浓度梯度为0、0.1、0.2、0.3、0.5、1、1.5 mmol·L−1的Cu(NO3)2、Pb(NO3)2、Ni(NO3)2、Cd(NO3)2、Zn(NO3)2混合溶液,以0.01 mol·L−1 NaNO3为背景电解质. 在放入DGT装置前,用HNO3和NaOH调节溶液pH并稳定至4.0左右(以防止金属离子沉淀). 采用1.1.1节所述方法进行DGT装置的放置、固定膜的回收、DGT有效态铜洗脱法-AAS测定和pXRF直接测定.
-
供试的两种土壤均为农田土壤,分别采自江苏南京和浙江台州. 除去土壤表面的覆盖物后,取0—20 cm 的表层土壤,自然风干,磨碎过60目筛备用. 按1:2.5的土水比制备土壤悬液,振荡30 min 后用pH计(Five Easy Plus, Mettler Toledo, Switzerland)测定土壤pH. 使用重铬酸钾氧化法测定土壤有机质含量. 采用醋酸铵法测定土壤阳离子交换量(cation exchange capacity,CEC). 使用HF-HClO4-HNO3消煮提取土壤总Cu(Ⅱ)、Pb(Ⅱ)、Ni(Ⅱ)、Cd(Ⅱ)、Zn(Ⅱ)[31]并用火焰原子吸收光谱法测定.
-
将磨细过60目(0.25 mm)筛的风干土按照最大田间持水量(MFMC)的30%添加含Cu溶液后搅拌混合均匀,最终土壤染毒浓度梯度为0、0.5、1、5、10、15、20、25、30、40 mmol·kg−1. 将染毒土壤置于恒温培养箱(LX500-D,冠森生物科技有限公司,上海),在(25±1) ℃条件下培养,并每隔3 天补充水分,老化 30 d后将染毒土壤取出、风干,研磨过60目筛备用.
-
用于DGT原位提取的染毒土壤按照MFMC的80%构建土-水平衡体系,置于(25±1) ℃ 恒温培养箱中培养. 将DGT装置用超纯水冲洗后,取平衡3 d、重量为4.5 g的土水混合物置于DGT装置的凹槽内,与DGT外膜充分接触. 24 h后,利用塑料镊子将固定膜从 DGT 装置中取出,利用超纯水冲洗膜表面以便进行后续测定.
-
将原位提取污染土壤有效态铜并风干后的DGT固定膜装入干净自封袋,用pXRF直接测定,每隔10 min测定1次,连续测量1 h,共测量7次. 具体测定步骤与1.1.1节相同,测定流程见图1.
-
将DGT提取土壤有效态Cu(Ⅱ)后凹槽中的土水混合物转移到10 mL离心管中,离心分离(9000 r·min-1)5 min,取少量上清液稀释,经0.45 μm的微孔滤膜过滤后,用AAS测定溶液中的Cu(Ⅱ).
-
传统实验室洗脱法CDGT计算公式:
式中,M为结合相中Cu(Ⅱ)累积量(nmol),Ce为洗脱液中目标金属离子浓度(μmol·L−1),Vg为凝胶体积(0.2 mL)[32],Ve为洗脱液体积(1.8 mL),fe为洗脱效率(Cu: 1.03),∆g为过滤膜和扩散膜的总厚度(0.09 cm),D为分析物扩散系数(Cu: 6.59×10−6),A为装置暴露窗口面积(3.14 cm2),t为DGT的放置时间 (标准溶液和多重金属离子共存体系:
28800 s;土壤体系:86400 s). -
由标准溶液体系获得DGT有效态铜累积量与pXRF信号值之间的线性关系,然后将多种重金属共存体系、土壤体系获得的pXRF信号值代入上述线性关系,计算得到DGT有效态铜累积量. 进而比较实验室洗脱法-AAS实测值和pXRF直接测定DGT风干固定膜中Cu(Ⅱ),计算得到的DGT有效态铜累积量差异. 为了检验pXRF测定DGT有效态铜结果的可靠性,对DGT-pXRF联用方法的精密度和准确度进行了分析. 分别采用相对误差(RPD)和相对标准偏差(RSD)2个指标来评价pXRF的准确度和精密度,该方法符合评价指标应尽可能简化的原则. RSD的计算公式如下:
式中,Xi为pXRF测定DGT有效态铜的信号值,`X为pXRF测定值的总体样本平均值,N为测定样本数量,SD为分析样本的标准偏差,RSD为分析样本的相对标准偏差.
RPD的计算公式如下:
式中,Ck为DGT传统方法测定值(即洗脱法测定值),Cs为pXRF方法测定值,RPD为两种结果的相对误差,该值越趋向于0,则结果越准确.
利用Excel 2019和SPSS 25.0进行数据处理和图表绘制.
-
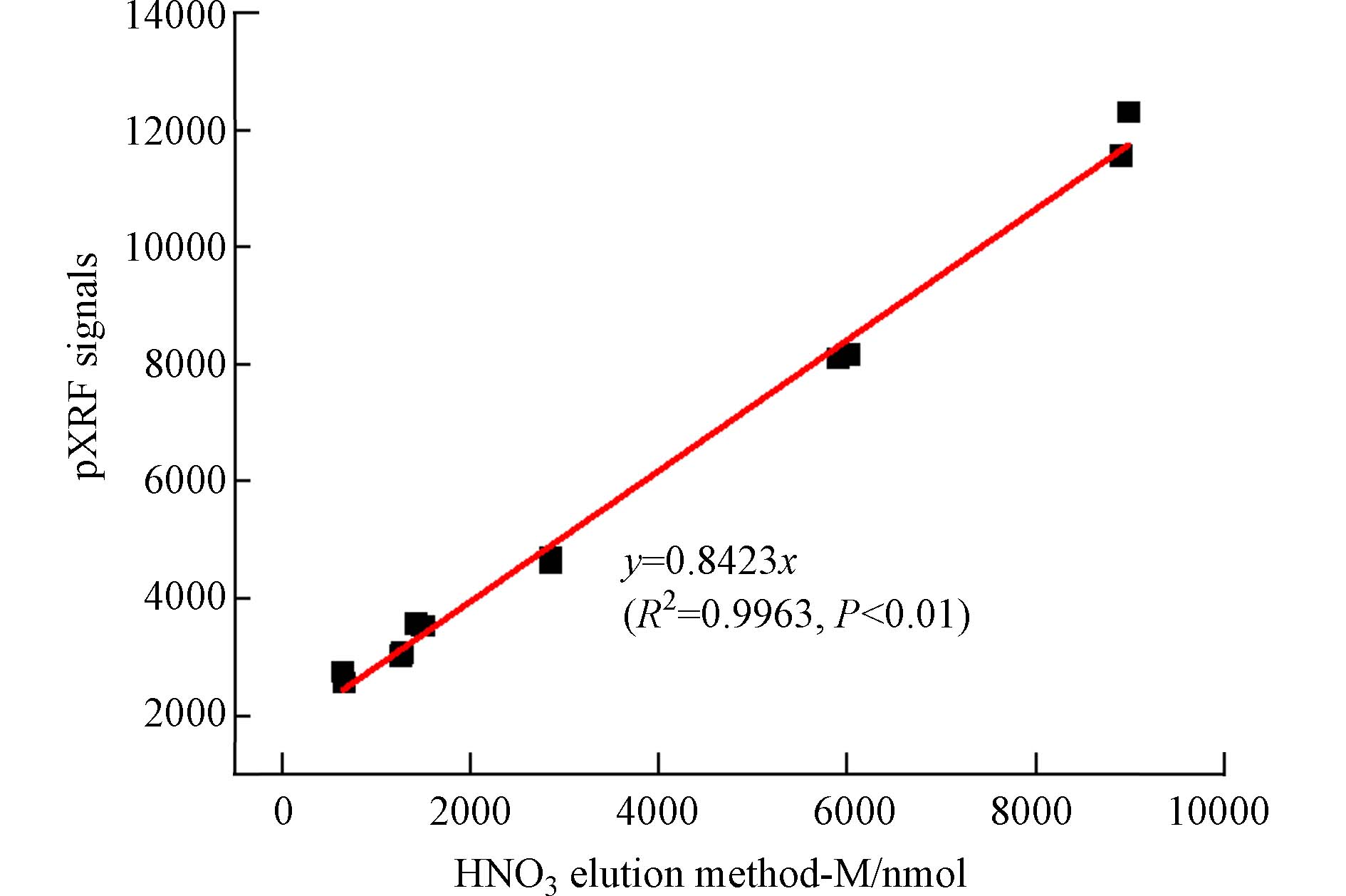
为了将DGT与pXRF联用测定土壤有效态铜,建立了Cu(Ⅱ)在固定膜上累积量的pXRF测定信号值与传统实验室洗脱法测定的Cu(Ⅱ)含量之间的线性关系. 结果表明,pXRF信号值与Cu(Ⅱ)含量之间呈很好的线性关系,相关系数R2达
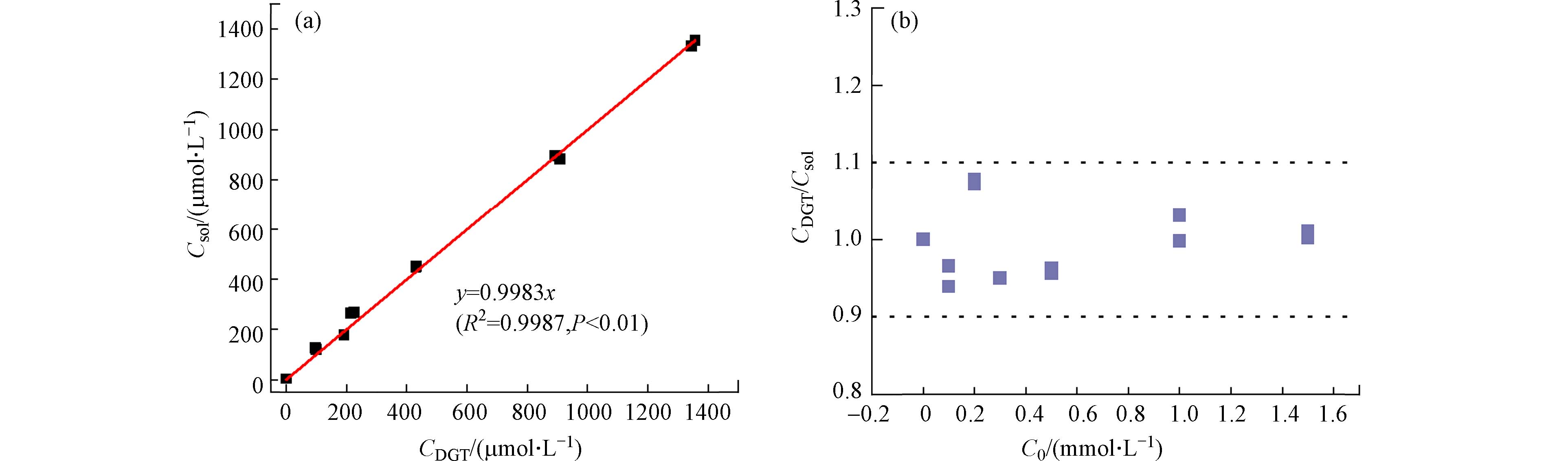
0.9963 (图2),说明用pXRF直接测定法取代实验室传统洗脱法来定量DGT有效态铜是可行的.为检验DGT原位提取有效态Cu(Ⅱ)的准确性和稳定性,比较了DGT有效态浓度(CDGT)与溶液实际浓度(Csol)之间的关系. DGT测定的有效性和适用条件常通过有效态浓度(CDGT)与溶液实际浓度(Csol)的比值关系来判断,CDGT/Csol比值在0.9到1.1之间说明DGT的测定结果是有效的[33]. 如图3所示,标准溶液体系的CDGT与Csol呈极显著线性相关,相关系数达
0.9987 ,CDGT/Csol比值在0.9—1.1之间,说明标准溶液体系的DGT有效态铜浓度是有效且准确的. 这确保了后续可利用该校准曲线计算得到土壤体系有效态铜的准确值.根据校准曲线计算,Chelex DGT固定膜对Cu(Ⅱ)的空白吸附量和方法检出限分别为7.55 nmol和1.14 μmol·L−1. 本实验传统洗脱法计算得到Chelex DGT固定膜对Cu(Ⅱ)的空白吸附量和方法检出限分别为5.95 nmol和0.95 μmol·L−1. 可见,pXRF与DGT联用技术可满足对环境中痕量有效态重金属的现场直接测定.
-
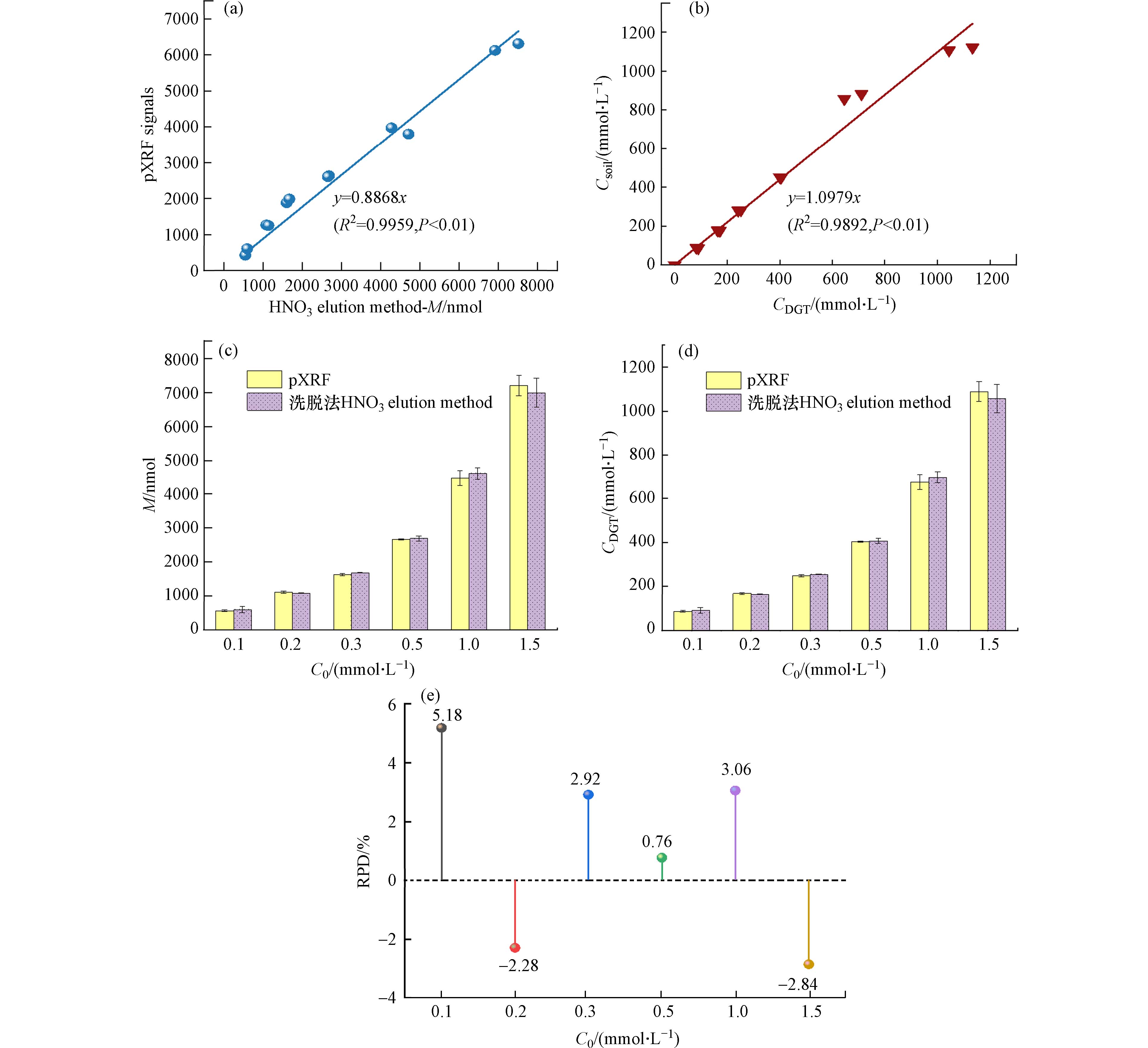
为了检验其它金属离子共存于DGT固定膜时是否会因金属离子之间的荧光信号重叠等问题影响pXRF测定的准确性,本实验比较了重金属阳离子Cu(Ⅱ)、Pb(Ⅱ)、Ni(Ⅱ)、Cd(Ⅱ)、Zn(Ⅱ)共存体系DGT提取有效态Cu(Ⅱ)累积量的传统实验室洗脱法测定结果和pXRF直接测定结果之间的相关关系. 如图4a所示,pXRF测定信号值和DGT有效态铜累积量呈极显著线性相关(P<0.01),相关系数达0.9959. 工作曲线斜率为
0.8868 ,与标准溶液体系校准曲线斜率(0.8423 )较为接近(图2),相对误差为5.28%. 说明pXRF联用测定DGT有效态Cu(Ⅱ)受其它共存阳离子的干扰较小,可直接应用于复合污染土壤等多重金属离子共存体系的测定. 同时,CDGT与实际铜浓度Csol极显著正相关(P<0.01),相关系数0.9892 ,斜率在0.9—1.1之间(图4b),说明pXRF与DGT联用对有效态铜的测定结果较准确. 该体系不同浓度梯度下,将pXRF信号值代入校准曲线计算得到的DGT有效态铜累积量和CDGT,其结果与传统洗脱法实测值较为接近(图4c, d),pXRF测定值与洗脱法-AAS实测值比值均在1.0 ± 0.05范围内. Pb(Ⅱ)、Ni(Ⅱ)、Cd(Ⅱ)、Zn(Ⅱ)在不同共存浓度(0—1.5 mmol·L−1)下,pXRF直接测定法与实验室传统洗脱法测定结果相对误差均在±10%以内(图4e). 这些结果说明,Pb(Ⅱ)、Ni(Ⅱ)、Cd(Ⅱ)、Zn(Ⅱ)等共存金属离子对pXRF直接快速测定DGT提取的有效态铜的干扰很小,可以忽略. -
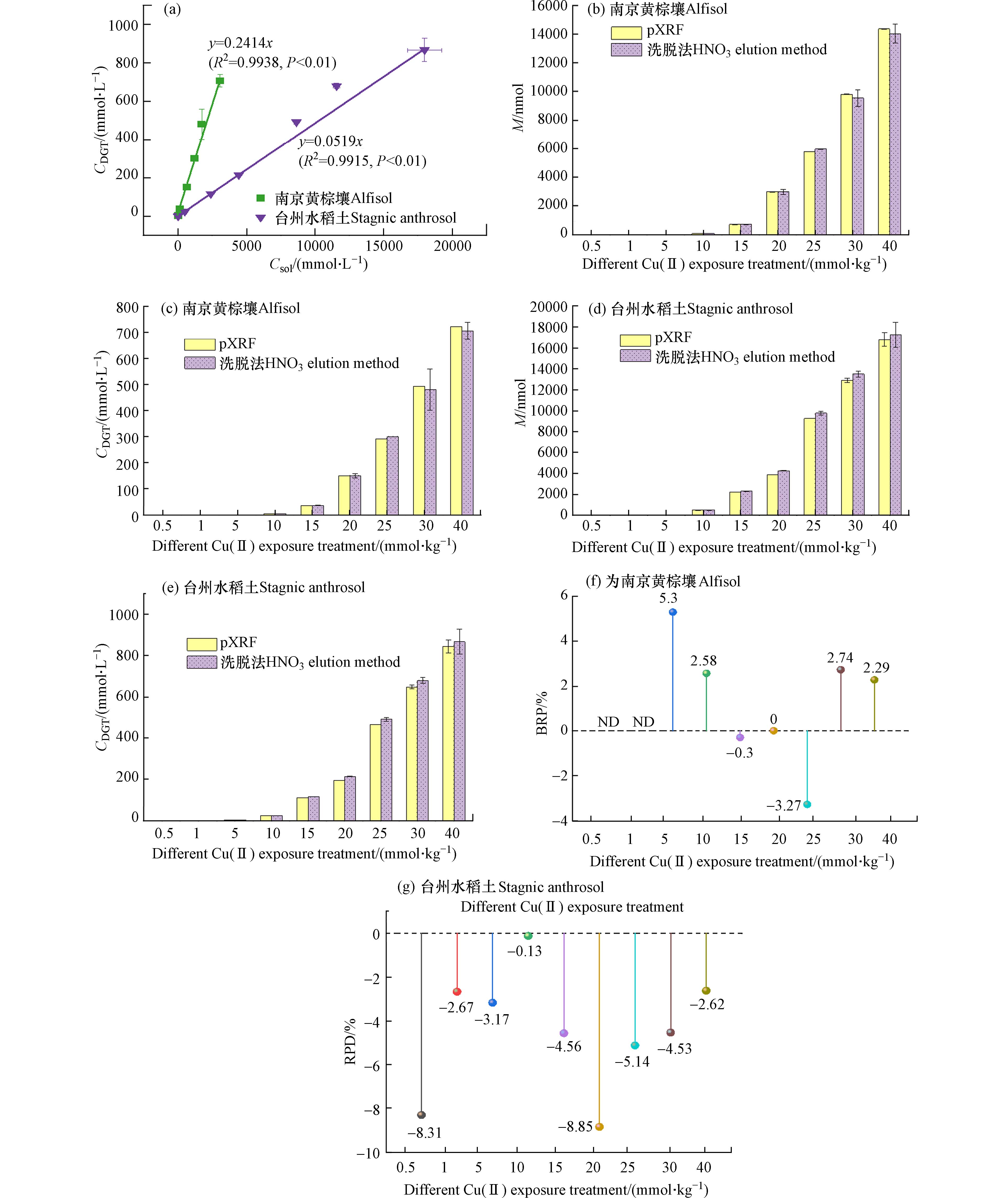
为验证DGT-pXRF联用直接测定土壤有效性铜浓度的可行性,选择江苏南京的黄棕壤和浙江台州的水稻土,先进行模拟Cu污染处理,然后用DGT提取土壤有效态Cu,再分别用pXRF和洗脱法分别测定有效态含量. 供试土壤的基本性质列于表1. 台州水稻土的CEC和有机质含量均高于南京黄棕壤. 南京黄棕壤呈中性,台州水稻土偏酸性. 水稻土的黏粒含量高于黄棕壤.
供试土壤的重金属总量及有效态含量列于表2. 由表2可知,水稻土的总Cu(Ⅱ)、总Cd(Ⅱ)、总Zn(Ⅱ)含量高于南京黄棕壤,但两种水稻土中铜的DGT有效态CDGT、水溶态铜Csol含量相差不大. 说明重金属总量并不能完全指示重金属有效态含量及其生物有效性. 重金属在土壤中的赋存形态与土壤pH、有机质含量等理化性质有关[34]. Zn(Ⅱ)在两种土壤中的总量、DGT有效态、水溶态含量较之其它重金属均较高,Pb(Ⅱ)、Ni(Ⅱ)、Cd(Ⅱ)、Zn(Ⅱ)在两种土壤中的有效态含量均较低.
-
由图5a可知,南京黄棕壤和台州水稻土DGT有效态铜浓度CDGT和水溶态铜浓度Csol均呈显著线性相关,相关系数分别为
0.9938 和0.9915. 说明DGT应用于该不同污染程度土壤体系测定有效态铜浓度是可行的. 同时,南京黄棕壤DGT有效态铜浓度和水溶态铜浓度相关性更高,这可能与南京黄棕壤的粒径分布(表1)、有机质含量有关,该土壤中自由态和弱结合态铜离子迁移过程受到有机质吸附等影响更小. pXRF直接测定法应用于土壤体系时,其DGT有效Cu(Ⅱ)累积量及有效态Cu(Ⅱ)浓度(CDGT)测定值和洗脱法测定值较接近,洗脱法测定值与pXRF测定值的比值接近1.0(图5b—e),两种方法相对误差在-8.85%—5.3%范围内(图5f, g),相对误差均在±10%以内. 结合表2,再次说明Zn(Ⅱ)等重金属离子的共存并不会干扰pXRF联用测定DGT有效态铜的准确性,与2.1.2节结果一致. 这些结果说明,pXRF-DGT联用测定旱地土壤和稻田土壤有效态铜均是可行的,且共存离子干扰较小,适用性较强.Chen等研究也表明将现场便携式X射线荧光光谱法pXRF与DGT技术联用能实现水/湿地中重金属/类金属的原位监测[29]. 近年来,随着XRF仪器的发展,XRF的检测限和微观分析能力不断提高. 如全反射X射线荧光光谱法(TXRF)改变了掠射角,较之传统能量色散X射线荧光光谱法具有更低的检测限和更好的微观分析能力[35]. Marguí等改进了Hg的预富集膜和提取方法,并将其与TXRF联用实现了水体低检测限、高灵敏度的汞检测,克服了以往Hg因高蒸汽压和低沸点带来的测定损失和测定误差[36]. DGT和XRF的联用在未来检测活性重金属方面具有较大应用潜力.
-
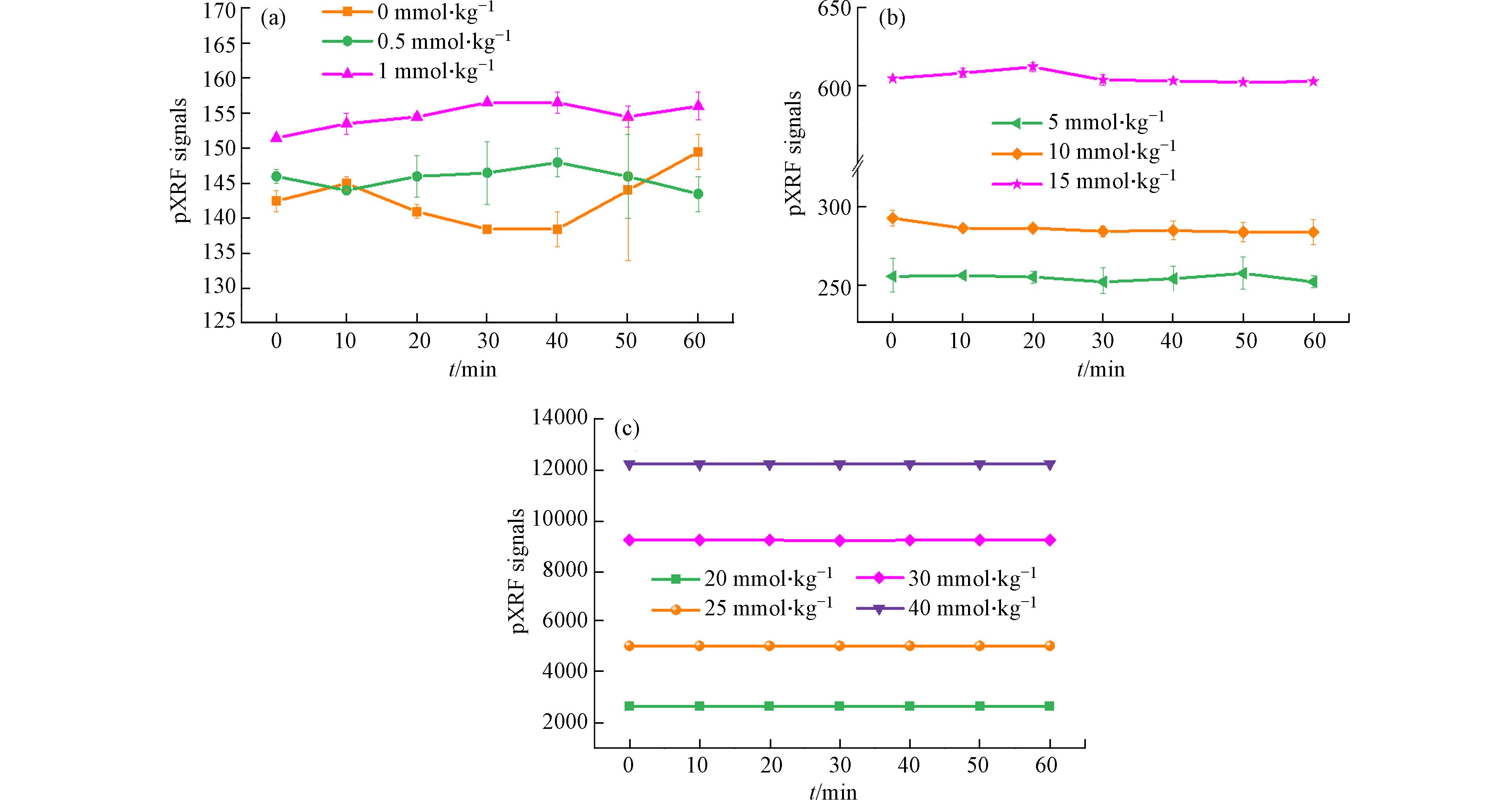
为了检验pXRF测定结果的重现性和pXRF-DGT联用技术测定有效态铜方法的精密度,用DGT提取低(图6a)、中(图6b)、高(图6c)浓度Cu(Ⅱ)污染的黄棕壤中有效态铜,将DGT固定膜风干后在其中心区域随机选择位置用pXRF进行连续多次测定,每间隔10 min读取1次数据,共测定7次. pXRF信号值随时间的变化曲线列于图6. 结果表明,对照和0.5 mmol·kg−1处理pXRF信号的重现性不好,1.0 mmol·kg−1和5.0 mmol·kg−1处理的重现性较好,10—40 mmol·kg−1处理测定结果的重现性很好. 这说明除很低Cu(II)浓度外,pXRF直接测定DGT有效态铜方法不受时空异质性、DGT固定膜累积Cu(Ⅱ)分布不均等的影响. 取低、中、高浓度DGT有效态铜7次pXRF信号值的平均值,计算测定结果的标准偏差RSD,以评估pXRF测定DGT有效态铜方法的精密度. 除0.5、1、5 mmol·kg−1Cu(Ⅱ)污染处理pXRF测定值的RSD超过5%外(分别为14.12%、19.78%、7.10%),其余中高浓度染毒处理体系pXRF测定值的RSD均在5%以下. 10、15、20、25、30、40 mmol·kg−1Cu(Ⅱ)污染黄棕壤的DGT有效态铜pXRF测定值的RSD分别为4.19%、0.85%、0.29%、0.05%、0.05%、0.04%. 这些结果表明pXRF测定DGT有效态铜方法的精确度良好,符合美国环境保护署和我国农田土壤环境质量检测技术规范中规定的仪器检测精密度要求[37−38].
-
便携式X射线荧光光谱法(pXRF)是一种快速、简便测定重金属含量的方法. pXRF直接测定DGT提取的土壤有效态铜含量时,只需将提取后的DGT固定膜进行简单风干后用普通塑料自封袋存放即可测定,无需进行复杂的洗脱等前处理. pXRF直接测定法和传统实验室洗脱法测定结果一致,说明pXRF直接测定DGT膜上Cu(Ⅱ)的方法可行. 与传统实验室洗脱-原子吸收光谱/电感耦合等离子体发射光谱法/电感耦合等离子体质谱法相比,X射线荧光光谱法的联用节约了测定的时间、劳动力和分析测试费,并为野外现场测定有效态重金属提供了可能,未来应进一步研究pXRF和DGT等多技术的联用对其他有效态重金属测定的可行性. 并进一步关注不同类型X射线荧光光谱法与DGT技术的联用,以提高多元素重(类)金属的检测极限和灵敏度,为重金属污染预防、控制、治理的现场决策提供技术支撑.
便携式X射线荧光光谱法原位测定梯度薄膜扩散技术提取的土壤有效态铜
A novel method for determination of available Cu(Ⅱ) in soil by integrating Diffusive Gradients in Thin-films and portable X-ray fluorescence spectrometry
-
摘要: 土壤铜(Cu)污染日益严重,铜的毒性主要取决于其生物有效性,迫切需要开展有效态铜的现场快速测定. 本研究将便携式X射线荧光光谱法(pXRF)与梯度薄膜扩散技术(DGT)联用,首先用DGT方法提取土壤有效态Cu(Ⅱ),然后直接利用pXRF测定风干DGT固定膜中的Cu(Ⅱ),并与实验室传统洗脱法-原子吸收分光光度法(AAS)测定结果进行比较,以评估测定结果的可靠性. 首先在标准溶液体系建立pXRF信号值与DGT提取的有效态Cu(Ⅱ)累积量之间的线性关系;进而在Cu(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、Ni(Ⅱ)、Zn(Ⅱ)多金属离子共存体系进行测定,以考察共存阳离子对测定的干扰情况. 最后将DGT-pXRF联用技术应用于两种不同浓度Cu(Ⅱ)染毒老化的模拟污染土壤中测定有效态Cu(Ⅱ). 结果表明,DGT提取的有效态Cu(Ⅱ)的pXRF直接测定结果与实验室传统洗脱法测定结果相关性好,相关系数达
0.9963 ; pXRF可准确测定低至1.14 μmol·L-1(0.0724 mg·L-1)的DGT提取有效态Cu(Ⅱ)含量;共存于体系中的Pb(Ⅱ)、Cd(Ⅱ)、Ni(Ⅱ)和Zn(Ⅱ)不干扰DGT提取的有效态Cu(Ⅱ)的pXRF测定; pXRF与DGT联用技术应用于污染土壤时,pXRF直接测定获取的DGT固定膜中有效态铜浓度与洗脱法测定获取的有效态Cu(Ⅱ)结果一致. 总之,应用pXRF直接测定DGT固定膜提取的土壤有效态铜的方法满足准确度和精确度的要求,pXRF与DGT联用可实现DGT提取的土壤有效态Cu(Ⅱ)的现场快速测定. 该方法的应用与推广可极大节省实验室分析的时间、人力、物力等成本,并为野外现场直接测定有效态重金属提供了新的技术方向.-
关键词:
- 便携式X射线荧光光谱法 /
- 污染土壤 /
- 有效态铜 /
- DGT /
- 现场测定.
Abstract: Soil copper (Cu) pollution has been an increasingly serious concern in all aspects of life. The available Cu(Ⅱ) with exceedingly high bioavailability might pose a threat to human health and surrounding environment. However, the existing methods for determination of available Cu(Ⅱ) speciation are cumbersome and inefficient. The prestnt study aimed to develop a novel method for determination of available Cu(Ⅱ) speciation by integrating both Diffusive Gradients in Thin-films (DGT) and portable X-ray fluorescence spectrometry (pXRF). Available Cu(Ⅱ) in soils was extracted by Chelex DGT, and determined by traditional Atomic absorption spectroscopy (AAS) after acid elution and portable X-ray fluorescence spectrometry (pXRF), respectively. The available Cu(Ⅱ) determined by AAS was set as the standard to measure the accuracy of the value directly determined by pXRF in air dried DGT binding gel. Initially, the calibration curves of pXRF signals and traditional HNO3 elution method for available Cu(Ⅱ) accumulated in DGT binding gels was established in standard solution system. Furthermore, the interferences of lead (Pb), nickel (Ni), cadmium (Cd), and zinc (Zn) with available Cu(Ⅱ) during determination by pXRF in multi metal ion coexisting system was examined. Finally, the pXRF was used to determine the available Cu(Ⅱ) in soils extracted with DGT. The results showed that: There was a strong linear relationship between available Cu(Ⅱ) accumulated in DGT Chelex binding gel determined by pXRF directly and that determined by the traditional elution method with AAS in the laboratory(R2 =0.9963 ); pXRF can accurately measure as low as 1.14 μmol·L-1 (0.0724 mg·L-1) of available Cu(Ⅱ) extracted by DGT; The coexisting Pb(Ⅱ), Cd(Ⅱ), Ni(Ⅱ), and Zn(Ⅱ) did not interfere with the pXRF determination of available Cu(Ⅱ) extracted by DGT; The available Cu(Ⅱ) accumulated in DGT binding gel extracted from soils measured by pXRF directly was consistent with that determined by traditional elution method. Therefore, this new method for determination of available Cu(Ⅱ) in soil by combining DGT and pXRF could meet the requirements of the accuracy and precision, which supported the direct determination of available heavy metals in the field. The application and promotion of this method can greatly save laboratory analysis time, manpower, material resources, and other costs. -

-
图 3 pH 4.0 的Cu(Ⅱ)标准溶液体系中,DGT提取的有效态Cu(Ⅱ)浓度(CDGT)与溶液Cu(Ⅱ)浓度(Csol)之间的线性关系(a)及CDGT/Csol值随Cu(Ⅱ)初始浓度的变化趋势(b)
Figure 3. The linear relationship between available Cu(Ⅱ) concentration extracted by DGT (CDGT) and Cu(Ⅱ) concentration in standard solutions (Csol) at pH 4.0(a) and the change trend of the ratios of CDGT/Csol with initial concentration of Cu(Ⅱ)(b)
图 6 低(a)、中(b)、高(c)浓度Cu(Ⅱ)染毒处理南京黄棕壤DGT风干固定膜pXRF信号值随时间的变化趋势
Figure 6. The change trends of the fluorescence signal values of pXRF used for the measurement of available Cu(Ⅱ) accumulated in Chelex DGT binding gels in polluted Alfisol with time(Low (a), middle(b), high(c) concentration Cu(Ⅱ) contaminated Alfisol)
表 1 土壤基本理化性质
Table 1. Basic physicochemical properties of the soils
土样
Soil采样地
Location母质
Parent materialpH 有机质/%
Organic matterCEC/(cmol·kg−1) 粒度分析/%
Particle size粘
Clay粉
Silt砂
Sand南京黄棕壤 江苏南京 下蜀黄土 7.40 0.68 14.70 9.7 78.7 11.6 台州水稻土 浙江台州 海相沉积物 5.23 4.99 26.57 23.3 52.0 24.7 表 2 土壤重金属总量、DGT有效态和水溶态含量
Table 2. The contents of total heavy metals, available heavy metals accumulated in Chelex DGT and water soluble heavy metals in the soils
重金属形态
heavy metal speciation南京黄棕壤
Alfisol台州水稻土
StagnicanthrosolCu Pb Ni Cd Zn Cu Pb Ni Cd Zn 总浓度/ (mmol·kg−1) 0.5838 0.0629 0.6546 0.0681 1.9975 0.9126 0.0571 0.3603 0.1308 2.6829 DGT有效态/ (mmol·L−1) 0 0 0 0 0.0039 0 0.0003 0 0 0.0068 水溶态/ (mmol·L−1) 0 0.0002 0 0 0.0037 0 0.0002 0 0 0.0066 -
[1] 全国土壤污染状况调查公报[J]. 中国环保产业, 2014(5): 10-11. National Soil Pollution Survey Bulletin[J]. China Environmental Protection Industry, 2014(5): 10-11 (in Chinese).
[2] ZHANG M H, JOUQUET P, DAI J, et al. Assessment of bioremediation potential of metal contaminated soils (Cu, Cd, Pb and Zn) by earthworms from their tolerance, accumulation and impact on metal activation and soil quality: A case study in South China[J]. Science of the Total Environment, 2022, 820: 152834. [3] HOU S N, ZHENG N, TANG L, et al. Pollution characteristics, sources, and health risk assessment of human exposure to Cu, Zn, Cd and Pb pollution in urban street dust across China between 2009 and 2018[J]. Environment International, 2019, 128: 430-437. [4] CHENG Y, LUO L, LV J T, et al. Copper speciation evolution in swine manure induced by pyrolysis[J]. Environmental Science & Technology, 2020, 54(14): 9008-9014. [5] ARAÚJO E, STRAWN D G, MORRA M, et al. Association between extracted copper and dissolved organic matter in dairy-manure amended soils[J]. Environmental Pollution, 2019, 246: 1020-1026. [6] URIU-ADAMS J Y, KEEN C L. Copper, oxidative stress, and human health[J]. Molecular Aspects of Medicine, 2005, 26(4/5): 268-298. [7] LEE J S, CHON H T, KIM K W. Human risk assessment of As, Cd, Cu and Zn in the abandoned metal mine site[J]. Environmental Geochemistry and Health, 2005, 27(2): 185-191. [8] STRAIN S. Copper in the food chain and human health (foodcue) [J]. Italian Journal of Food Science. 1999, 11: 81. [9] BOST M, HOUDART S, OBERLI M, et al. Dietary copper and human health: Current evidence and unresolved issues[J]. Journal of Trace Elements in Medicine and Biology, 2016, 35: 107-115. [10] SHUMAN L M, HARGROVE W L. Effect of tillage on the distribution of manganese, copper, iron, and zinc in soil fractions[J]. Soil Science Society of America Journal, 1985, 49(5): 1117-1121. [11] SHAHID M, PINELLI E, DUMAT C. Review of Pb availability and toxicity to plants in relation with metal speciation;role of synthetic and natural organic ligands[J]. Journal of Hazardous Materials, 2012, 219/220: 1-12. [12] 李佳璐, 姜霞, 王书航, 等. 丹江口水库沉积物重金属形态分布特征及其迁移能力[J]. 中国环境科学, 2016, 36(4): 1207-1217. doi: 10.3969/j.issn.1000-6923.2016.04.037 LI J L, JIANG X, WANG S H, et al. Heavy metal in sediment of Danjiangkou Reservoir: Chemical speciation and mobility[J]. China Environmental Science, 2016, 36(4): 1207-1217 (in Chinese). doi: 10.3969/j.issn.1000-6923.2016.04.037
[13] 刘洁, 孙可, 韩兰芳. 生物炭对土壤重金属形态及生物有效性影响的研究进展[J]. 环境化学, 2021, 40(6): 1643-1658. doi: 10.7524/j.issn.0254-6108.2021011402 LIU J, SUN K, HAN L F. Effect of biochar on soil heavy metal speciation and bioavailability: A review[J]. Environmental Chemistry, 2021, 40(6): 1643-1658 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021011402
[14] 孙境蔚, 胡恭任, 于瑞莲, 等. 铁观音茶园土壤-茶树体系中重金属的生物有效性[J]. 环境化学, 2020, 39(10): 2765-2776. doi: 10.7524/j.issn.0254-6108.2020022403 SUN J W, HU G R, YU R L, et al. Bioavailability of heavy metals in soil-tea plant system of Tieguanyin tea garden[J]. Environmental Chemistry, 2020, 39(10): 2765-2776 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020022403
[15] TESSIER A, CAMPBELL P G C, BISSON M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7): 844-851. [16] SPOSITO G, LUND L J, CHANG A C. Trace metal chemistry in arid-zone field soils amended with sewage sludge: I. fractionation of Ni, Cu, Zn, Cd, and Pb in solid phase[J]. Soil Science Society of America Journal, 1982, 46(2): 260-264. [17] 房煦, 罗军, 高悦, 等. 梯度扩散薄膜技术(DGT)的理论及其在环境中的应用Ⅱ: 土壤与沉积物原位高分辨分析中的方法与应用[J]. 农业环境科学学报, 2017, 36(9): 1693-1702. doi: 10.11654/jaes.2017-0454 FANG X, LUO J, GAO Y, et al. Theory and application of diffusive gradients in thin-films in the environment: High-resolution analysis and its applications in soils and sediments[J]. Journal of Agro-Environment Science, 2017, 36(9): 1693-1702 (in Chinese). doi: 10.11654/jaes.2017-0454
[18] GIMPEL J, ZHANG H, DAVISON W, et al. in situ trace metal speciation in lake surface waters using DGT, dialysis, and filtration[J]. Environmental Science & Technology, 2003, 37(1): 138-146. [19] PHILIPPS R R, XU X Y, BRINGOLF R B, et al. Evaluation of the DGT technique for predicting uptake of metal mixtures by fathead minnow (Pimephales promelas) and yellow lampmussel (Lampsilis cariosa)[J]. Environmental Toxicology and Chemistry, 2019, 38(1): 61-70. [20] WANG Z, ER Q, ZHANG C C, et al. A new DGT technique based on nano-sized Mg2Al layered double hydroxides with DTPA for sampling of eight anionic and cationic metals[J]. Environmental Science and Pollution Research, 2023, 30(13): 37679-37690. [21] BAI X L, YE W N, ZHOU Y K, et al. Comparison between diffusive gradients in thin film technology (DGT) and traditional methods for prediction of plant available heavy metals in agricultural soil[J]. Journal of Soils and Sediments, 2023, 23(3): 1501-1510. [22] BURT R, WILSON M A, MAYS M D, et al. Major and trace elements of selected pedons in the USA[J]. Journal of Environmental Quality, 2003, 32(6): 2109-2121. [23] CHAKRABORTY S, WEINDORF D C, LI B, et al. Development of a hybrid proximal sensing method for rapid identification of petroleum contaminated soils[J]. Science of the Total Environment, 2015, 514: 399-408. [24] de LIMA T M, WEINDORF D C, CURI N, et al. Elemental analysis of Cerrado agricultural soils via portable X-ray fluorescence spectrometry: Inferences for soil fertility assessment[J]. Geoderma, 2019, 353: 264-272. [25] QU M K, LIU H B, GUANG X, et al. Improving correction quality for in-situ portable X-ray fluorescence (PXRF) using robust geographically weighted regression with categorical land-use types at a regional scale[J]. Geoderma, 2022, 409: 115615. [26] QU M K, CHEN J, LI W D, et al. Correction of in situ portable X-ray fluorescence (PXRF) data of soil heavy metal for enhancing spatial prediction[J]. Environmental Pollution, 2019, 254(Pt A): 112993. [27] WEINDORF D C, BAKR N, ZHU Y D. Advances in portable X-ray fluorescence (PXRF) for environmental, pedological, and agronomic applications[M]//Advances in Agronomy. Amsterdam: Elsevier, 2014, 128: 1-45. [28] SANTANA M L T, RIBEIRO B T, SILVA S H G, et al. Conditions affecting oxide quantification in unknown tropical soils via handheld X-ray fluorescence spectrometer[J]. Soil Research, 2018, 56(6): 648-655. [29] CHEN Z, WILLIAMS P N, ZHANG H. Rapid and nondestructive measurement of labile Mn, Cu, Zn, Pb and As in DGT by using field portable-XRF[J]. Environmental Science:Processes & Impacts, 2013, 15(9): 1768-1774. [30] REN M Y, DING S M, SHI D, et al. A new DGT technique comprised in a hybrid sensor for the simultaneous measurement of ammonium, nitrate, phosphorus and dissolved oxygen[J]. Science of the Total Environment, 2020, 725: 138447. [31] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU R K. Analytical methods for soil and agro-chemistry[M]. Beijing: China Agricultural Science and Technology Press, 2000 (in Chinese).
[32] DING S M, XU D, SUN Q, et al. Measurement of dissolved reactive phosphorus using the diffusive gradients in thin films technique with a high-capacity binding phase[J]. Environmental Science & Technology, 2010, 44(21): 8169-8174. [33] ZHANG H, DAVISON W. Performance characteristics of diffusion gradients in thin films for the in situ measurement of trace metals in aqueous solution[J]. Analytical Chemistry, 1995, 67(19): 3391-3400. [34] 孙彤, 纪艺凝, 李可, 等. 弱碱性玉米地土壤重金属赋存形态及生态风险评价[J]. 环境化学, 2020, 39(9): 2469-2478. doi: 10.7524/j.issn.0254-6108.2019061701 SUN T, JI Y N, LI K, et al. The speciation distributions of heavy metals in weakly alkaline maize soils and its potential ecological risk[J]. Environmental Chemistry, 2020, 39(9): 2469-2478 (in Chinese). doi: 10.7524/j.issn.0254-6108.2019061701
[35] MARGUÍ E, QUERALT I, de ALMEIDA E. X-ray fluorescence spectrometry for environmental analysis: Basic principles, instrumentation, applications and recent trends[J]. Chemosphere, 2022, 303: 135006. [36] MARGUÍ E, QUERALT I, GUERRA M, et al. Mercury determination at trace levels using membrane preconcentration and benchtop total reflection X-ray fluorescence analysis[J]. Spectrochimica Acta Part B:Atomic Spectroscopy, 2018, 149: 84-90. [37] U. S. EPA. XRF technologies for measuring trace elements in soil and sediment. NitonXLt 700 Series pXRF Analyzer, Innovative technology verification report EPA/540/R-06/004 (2006). US EPA. 2006. [38] 中华人民共和国农业部. 农田土壤环境质量监测技术规范: NY/T 395—2000[S]. 北京: 中国标准出版社, 2000. Ministry of Agriculture of the People’s Republic of China. Procedural regulations regarding the environment quality monitoring of soil: NY/T 395—2000[S]. Beijing: Standards Press of China, 2000 (in Chinese).
-



 下载:
下载: