-
天然有机质(natural organic matter,NOM)是由动植物遗体和微生物分解产生的含有活性官能团的有机物,主要分为腐殖质和非腐殖质两大类[1]. 腐殖质是在酸性条件下不溶于水的有机物质,来源于微生物对植物组织、动物等排泄物的降解[2]. 非腐殖质包括碳水化合物、氨基酸和蛋白质等水溶性有机物[3]. 研究表明,大部分NOM具有电子穿梭能力,可以在微生物与胞外电子受体之间传递电子[4]. NOM含有的醌、酚等官能团在其介导电子传递过程中发挥重要作用[5 − 6]. 例如,在微生物厌氧呼吸过程下,NOM可以被一些铁还原的微生物还原,还原后的NOM作为电子供体进一步向铁氧化物或有机无机污染物传递电子[7]. NOM介导的电子传递对环境中碳氮等元素循环以及重金属等污染物的转化等具有重要的意义.
热解炭是由生物残体在缺氧条件下经高温热解产生的一种物质,它具有高比表面积、多孔结构和丰富的表面官能团[8 − 9]. 它在缓解气候变化[10]、农业生产[11]、环境修复[12 − 13]等领域都有巨大的应用潜力,引起了广泛的关注. 研究表明,热解炭的电子穿梭能力来源于其表面的氧化还原活性基团以及石墨化芳香结构[14];这些结构可以可逆地接受和供给电子,并通过碳基体传递电子,从而在环境中发挥“电子穿梭体”的作用[15]. 这种“电子穿梭体”的作用可以增加微生物电子供给,促进微生物驱动的氧化还原反应,如铁(Ⅲ)还原、铬(Ⅵ)还原和一氧化二氮还原等[16]. 热解炭的电子穿梭能力与其表面结构和性质有关,热解炭的类型和处理方式会影响其电子穿梭能力[17]. 此外,热解炭本身具有一定的导电性,尤其是对于700 ℃以上高温热解炭而言,导电性对其发挥电子传递作用发挥主要作用[17].
热解炭能有效吸附环境中的NOM,其作用机理主要包括静电作用、氢键作用、π-π相互作用和表面复杂化作用[18]. 不同类型、来源和制备条件的热解炭对NOM的吸附能力和选择性存在差异[19]. 一般来说,热解炭对NOM的吸附能力与其比表面积、孔隙度、碳含量和pH值呈正相关,与其灰分含量和极性官能团含量呈负相关[20 − 21]. 此外,热解炭和NOM都可以充当“电子穿梭体”,电子穿梭体可以在各种无机和有机化合物之间的氧化还原反应中传递电子. 氧化还原穿梭体可以将电子转移到有机和无机物中,如偶氮染料和氧化金属等,这些污染物可以被还原转化[17]. 微生物胞外电子传递(EET)在微生物胞外电子传递中起着重要的作用在土壤和沉积物中的铁循环中[16],它影响铁(氢)氧化物的溶解度、价态和形态,并导致次生矿物的形成[22]. 因此,在两者共存的条件下,热解炭与NOM如何共同影响电子传递过程值得深入探究.
本文以蒽醌-2,6-二磺酸二钠(anthraquinone-2,6-disulfonate,AQDS)作为实验室条件下NOM的模拟物,在热解炭制备过程中添加不同质量的石墨烯,获取具有明显电导率差异的热解炭,进行电化学分析,研究热解炭的电导率在与AQDS联合介导电子传递过程中的作用. 文中对热解炭和NOM共同介导电子传递过程的机制分析,对准确评估热解炭和NOM对生物炭地球化学过程的影响具有重要意义.
-
磁力搅拌器、管式炉、电化学工作站、电阻率测试仪、紫外分光光度计、压片机、傅里叶变换红外光谱仪、BET比表面积分析仪等.海藻酸钠、稀盐酸、石墨烯、KCl、CaCl2、AQDS、K2HPO4.
-
本实验以海藻酸钠粉末为原料,制备10 g·L−1海藻酸钠水溶液(250 mL),并分别添加不同浓度(0、40、80、160 mg·L−1)的石墨烯,然后,将混合溶液注入0.54 mol·L−1的CaCl2溶液,搅拌2 h,制得凝胶珠. 用无水乙醇洗涤凝胶珠20 min,再在60 ℃烘箱中干燥24 h,得到晶状固体. 最后,将晶状固体在管式炉中分别在400 ℃和800 ℃下进行热解(升温速度为10 ℃·min−1,热解2 h,N2保护). 热解炭经0.1 mol·L−1的稀盐酸进行酸洗3—4次至pH中性后,再在60 ℃烘箱中干燥24 h,并储存在干燥器中备用. 根据相应的添加石墨烯量(0、10、20、40 mg)和烧制温度命名热解炭样品为PC4-G0—G40和PC8-G0—G40.
-
使用粉末电阻率分析仪(ST2742B,晶格,中国)测量了热解炭电导率. 热解炭的表面积由表面积分析仪(ASAP
2460 ,Micromeritics,美国)测定. 表面官能团的类型和含量采用傅立叶变换红外光谱(Nicolet iS50,Thermo Scientific,美国)分析. 热解炭的粒径分布由激光粒度仪(Mastersizer3000 ,马尔文帕纳科,英国)测定. -
使用电化学工作站(CHI460e,上海辰华,中国)测量循环伏安曲线,用于评估热解炭的电化学性能. 本实验首先研磨热解炭样品,同时配制10 mL电解液(0.1 mol·L−1KCl、5 mmol·L−1 K2HPO4、5 mmol·L−1 AQDS,pH=7.0—7.2),然后,向电解液中加入不同质量(2 mg、4 mg、8 mg)和两种热解温度的热解炭样品和空白对照,每组实验重复3次,并静置24 h,使吸附达到平衡. 接着,在电化学工作站中使用三电极体系对所有样品进行循环伏安测试(CV),其中Ag/AgCl电极为参比电极,铂丝为辅助电极,玻碳为工作电极. 扫描速率为100—800 mV·s−1,电位范围为-1.6—0.6 V,扫描圈数为8圈,每次测定后,使用氧化铝粉末对电极进行打磨,并进行下一次的测定,以保证电极的稳定性.
-
采用紫外分光光度计(UV-
2600 ,Shimadzu,日本)测定并计算AQDS浓度. 所有样品测定结束后,取溶液2 mL,使用高速离心机在8000 r·min−1的速度下离心5 min,取上清液0.5 mL并稀释至10 mL,在测定前,用紫外分光光度仪扫描波段410 nm,并用空白组溶液进行空白校正,以消除背景干扰. 在测定时,将样品溶液注入比色皿中,选择扫描波段410 nm,测量其吸收光谱,并读取测量数据. 最后,通过标准曲线计算得到AQDS的吸附量,并进行结果分析. -
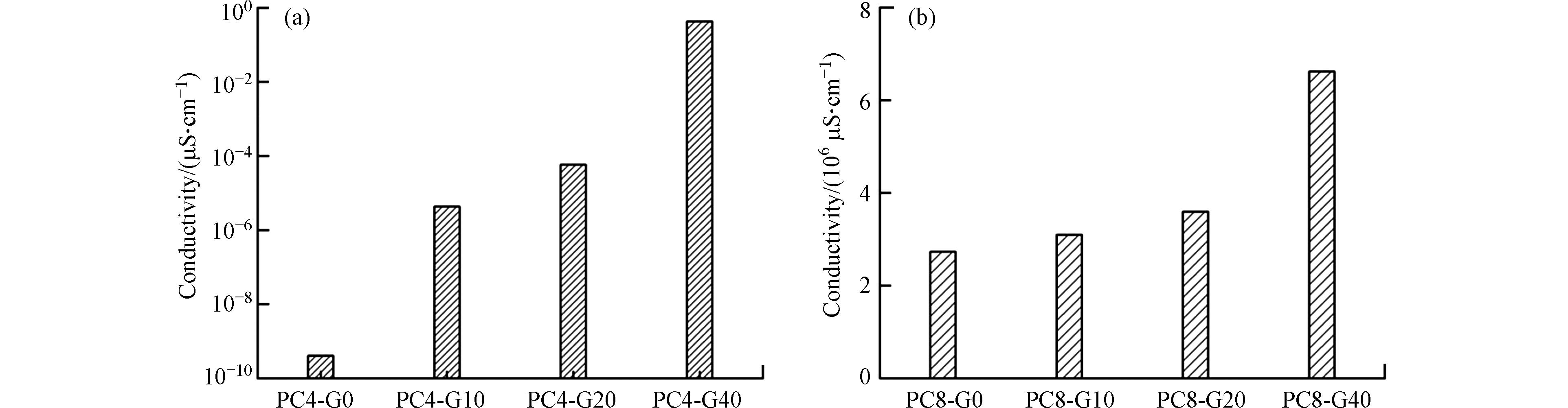
图1显示了随着石墨烯掺杂量的增加,PC4和PC8的电导率逐渐升高. 在相同的热解温度下,PC8的电导率远高于PC4. 随着石墨烯添加量的增多,PC4的电导率从4.08×10-10 μS·cm−1(G0)增加到0.42 μS·cm−1(G40),PC8的电导率从2.73×106 μS·cm−1(G0)提升到6.62×106 μS·cm−1(G40),分别提升了1.03×109倍和2.42倍. 由于石墨烯是由单层碳原子以六边形结构通过共享π键连接而成的材料,能够在热解炭内构筑快速的电子传递通道,所以具有良好的导电性[23]. 在两种温度下,由于PC4的电导率远低于石墨烯,因此,相比PC8,添加石墨烯对电导率的促进作用更加显著[24].
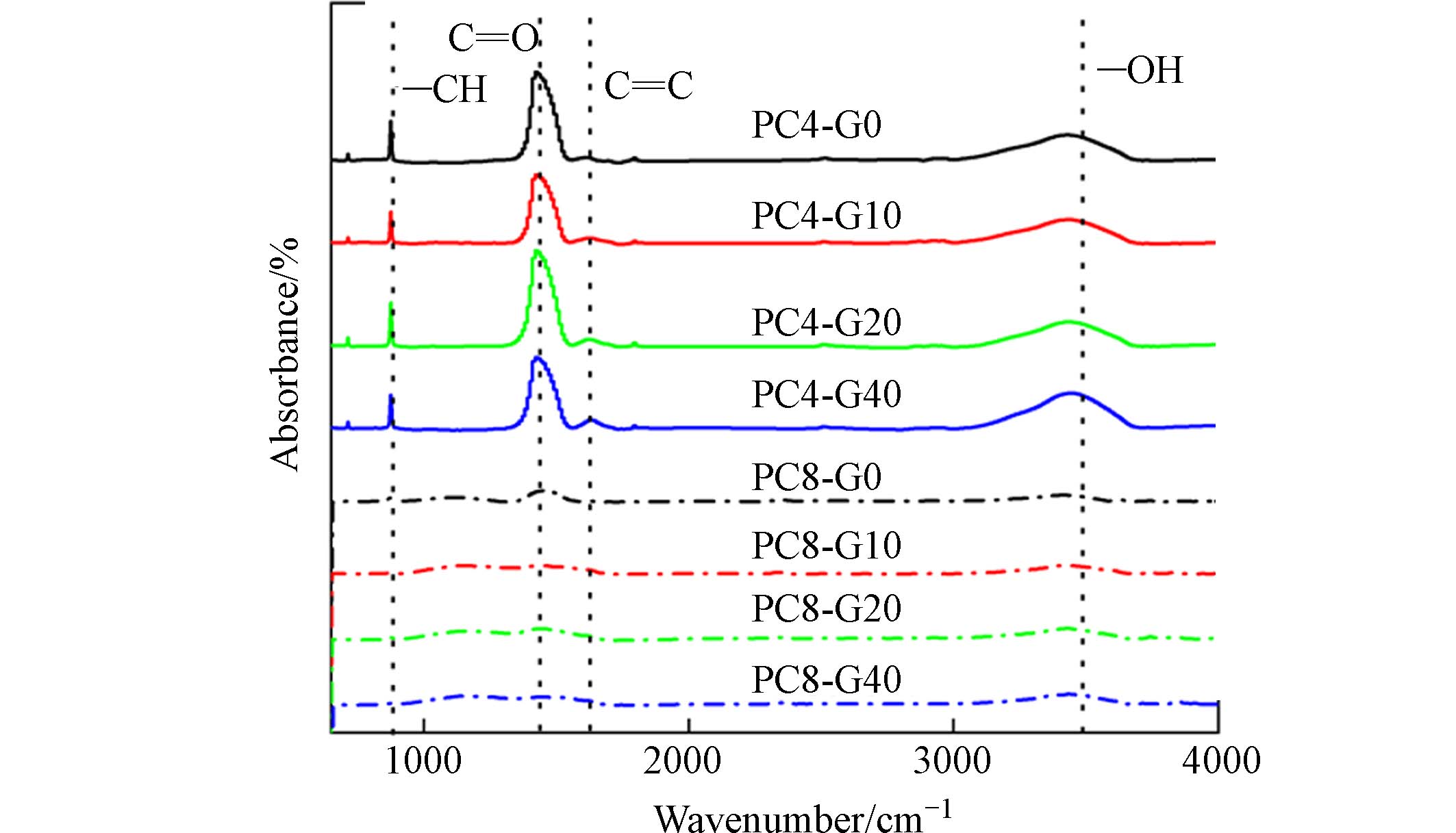
如图2所示,同一热解温度下的热解炭(G0—G40)的官能团种类基本相同. 位置在850—
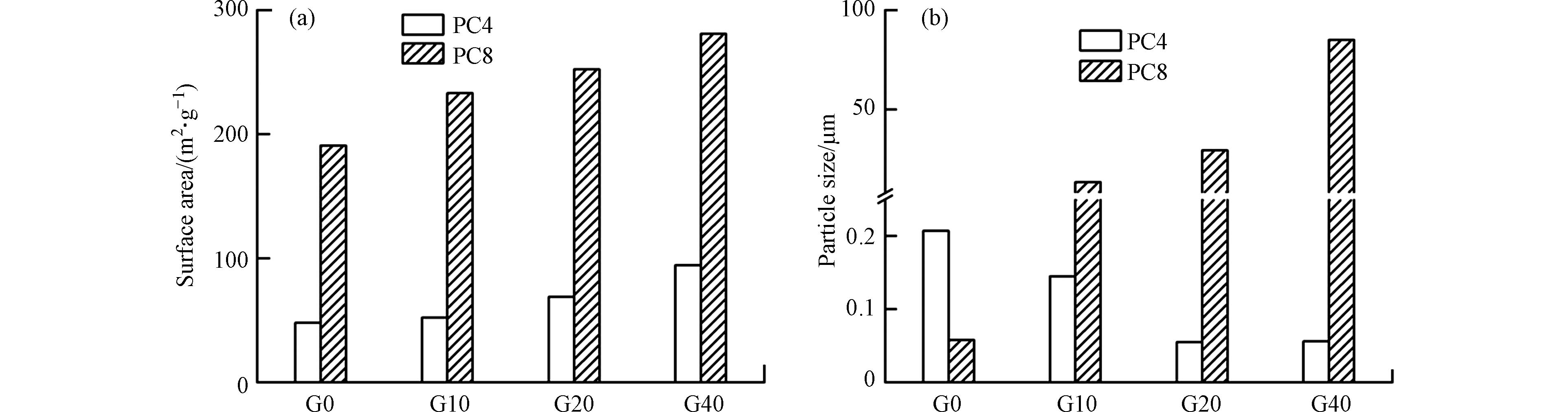
1000 cm−1的C—H伸缩振动,反映了热解炭中存在半纤维素和纤维素的成分;随着热解温度从400 ℃升高到800 ℃,该吸收峰强度逐渐减弱,表明半纤维素和纤维素在高温下发生分解[25]. 位置在1300 —1600 cm−1为羧基的C=O伸缩振动,其峰强度也随着温度升高而逐渐减弱,这可能是由于随着热解温度的升高,会伴随更多的生物油和热解气体的产出,而C=O的不饱和状态较易生成气体或液体副产物,因此C=O键显著减少[26]. PC4中位置在1300 —1600 cm−1的C=C伸缩振动表明该热解炭含有羰基等官能团;但是这类官能团含量较低,然后随着温度升高酚类物质逐渐挥发,在PC8中消失. 位置在3000 —3600 cm−1处的—OH伸缩振动对应于热解炭中醇酚羟基;随着热解温度升高,热解炭的羟基峰强度显著下降,这可能是由于热解炭在热解过程中伴随着结合水的脱离,导致羟基键逐渐断裂. 然而,在同一热解温度下,上述C—H、—OH和C=C等吸收峰随着石墨烯添加量的增多并没有明显变化;这一结果表明,石墨烯的添加更多地改变了热解炭的内部结构,对其表面官能团影响较小.随着石墨烯添加量的增加,PC4和PC8的比表面积、粒径变化如图3所示. 随着石墨烯的添加量增多,PC4和PC8的比表面积均有所提高,最高可提升97.14%(PC4-G40)和47.17%(PC8-G40). PC4和PC8的粒径随着石墨烯的添加量的增加出现产生不同的变化:相对于PC4-G0,PC4-G10—G40的粒径减小了29.95%—73.43%;而相对于PC8-G0,PC8-G10—G80的粒径则增大了231.55倍—
1465.07 倍. 除G0以外,PC4的粒径都显著小于PC8,表明石墨烯在不同温度下对热解炭粒径具有不同的效果. 800 ℃下,热解炭的制备过程中,石墨烯可能发挥一定的粘连作用,与海藻酸钠分子相互作用,形成较大颗粒[27];而400 ℃下,石墨烯可能起到分散作用,使颗粒变小[28]. 这两种效果也随着石墨烯添加量的增多而愈加明显. -
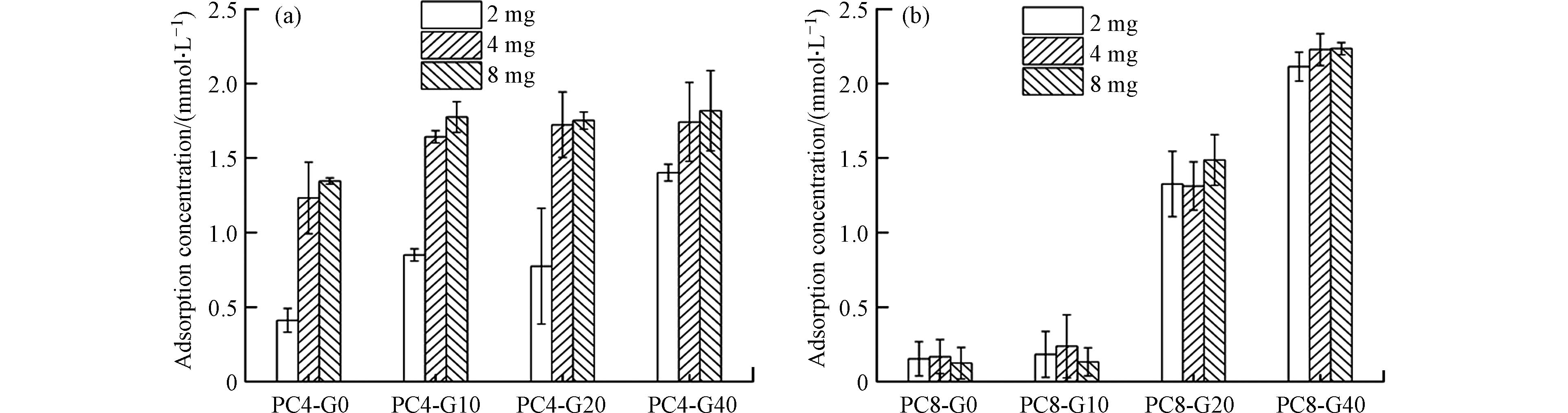
热解炭对AQDS吸附量变化如图4所示. AQDS溶液的初始浓度为5 mmol·L−1,随着PC4和PC8添加量的增多(2 mg逐渐升高到8 mg),AQDS的吸附量不断增大,最大吸附量分别提升4.44倍(PC4-G40)和14.87倍(PC8-G40). 然而,热解炭对于AQDS的吸附量并不随着PC4或者PC8的添加量呈线性增长,这可能是由于过多热解炭的加入形成了团聚效应,从而降低了其吸附量[29]. 在相同的石墨烯添加量下,PC8对AQDS的吸附能力低于PC4. 而对于G40样品,PC8的吸附能力则高于PC4. 热解炭的比表面积与表面含氧官能团是吸附AQDS的关键因素[30]. PC4丰富的表面含氧官能团对AQDS的吸附起主导作用. 相反,PC8含氧官能团含量显著降低,比表面积随着石墨烯的添加远远超过PC4,使得比表面积成为AQDS吸附的主要决定因素.
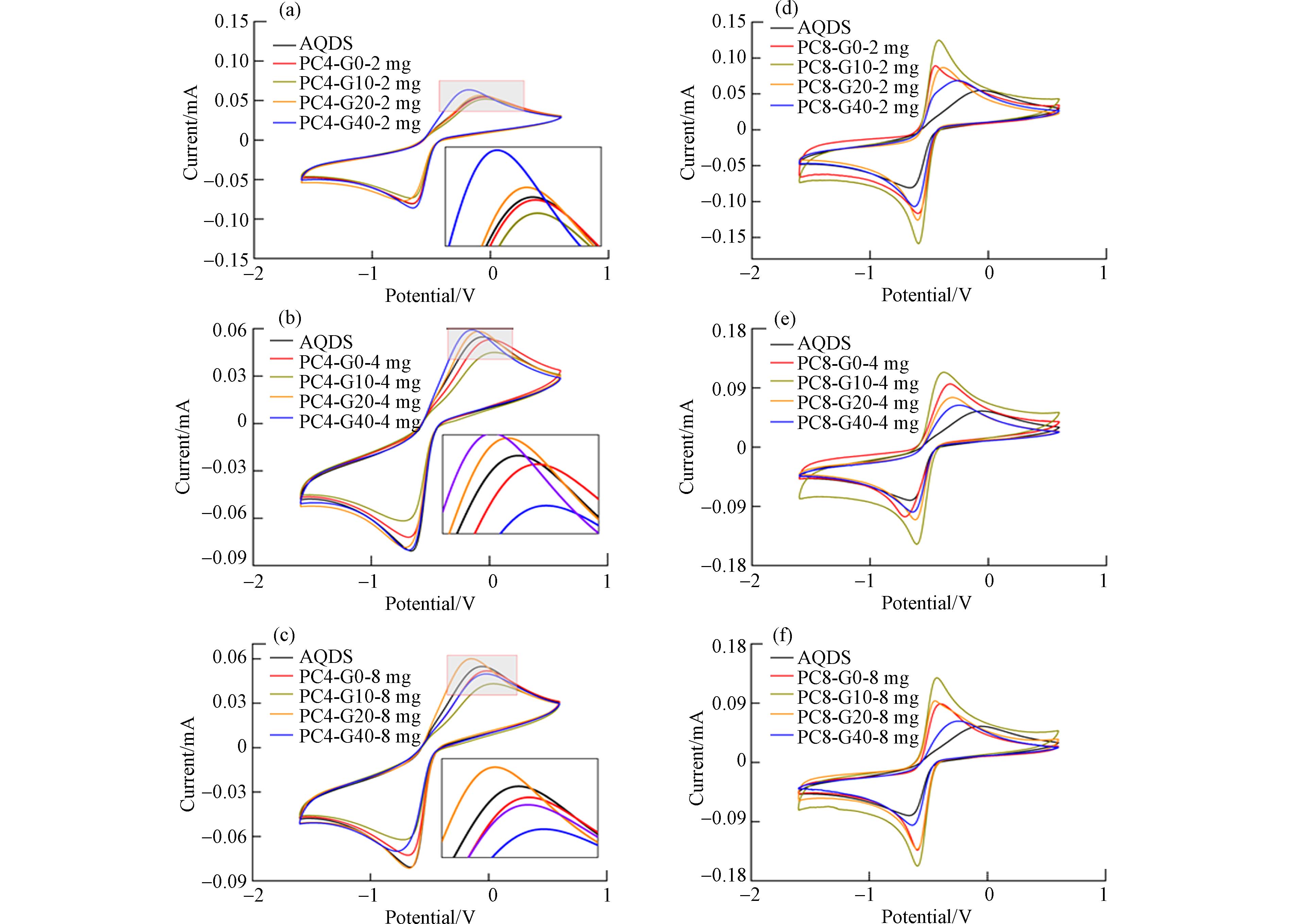
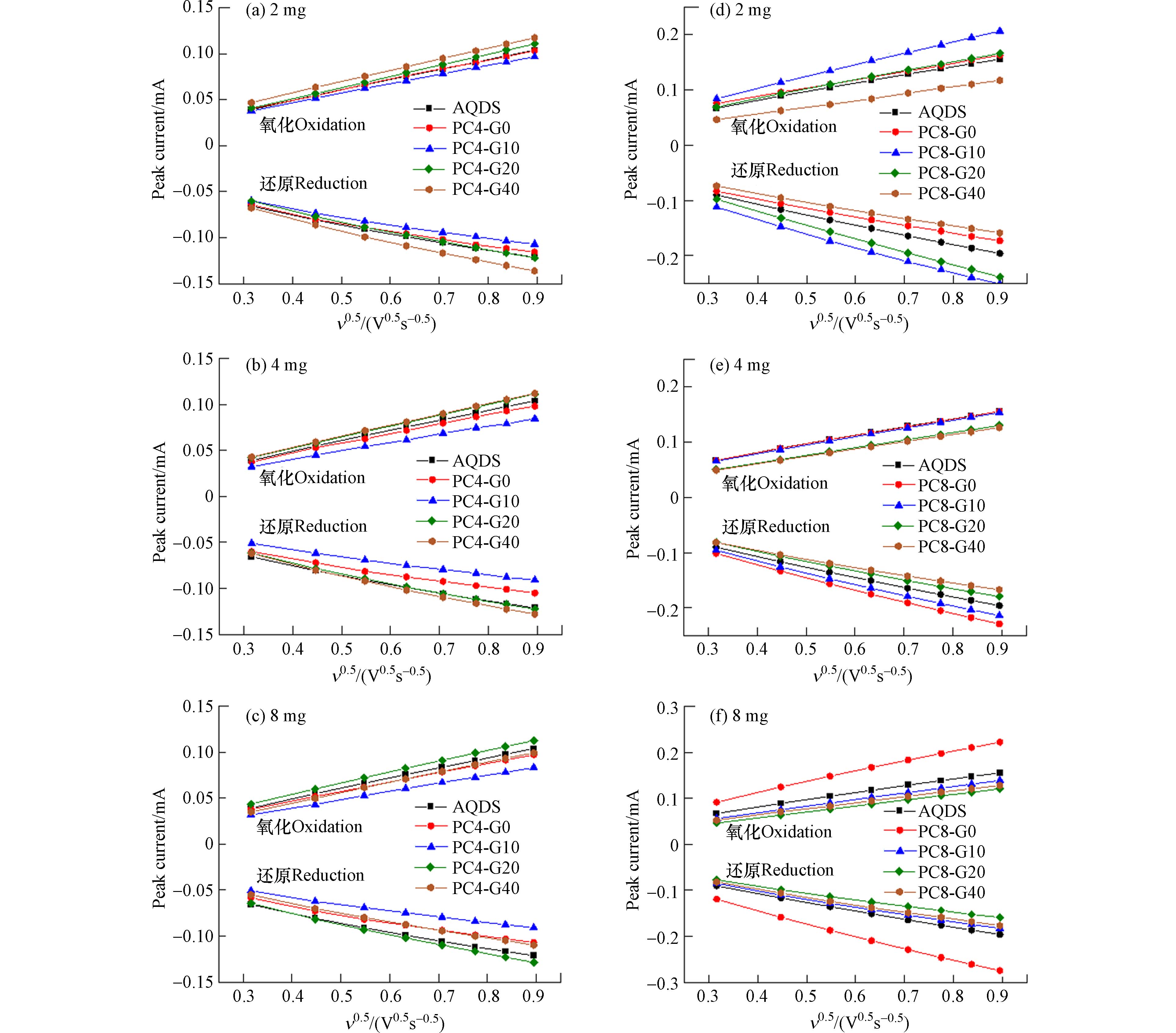
在PC4和PC8的不同添加量下,AQDS溶液的循环伏安曲线(扫描速率200 mV·s−1)见图5. 溶液中AQDS浓度是影响电流强度的关键,AQDS浓度越高,循环伏安曲线的峰电流也越高[31]. 由于PC4中G0和G10的吸附作用,使得AQDS剩余浓度降低,导致氧化峰电流分别下降1.82%和5.45% (图5a).
然而,PC4中的G20和G40虽然也能吸附更多的AQDS,但是相比于对照组,其氧化峰电流却分别增加了1.82%和16.36%. 考虑到从G0到G40逐渐升高的导电性,导电性能的改善促进了AQDS的电子传递,进而使氧化峰电流增强. 类似的现象也在PC8中观察到,在加入PC8后,虽然AQDS浓度下降,氧化峰电流仍然显著增加;随着热解炭中石墨烯含量的增加,氧化峰电流增加了61.82%(G0)、127.27%(G10)、58.18%(G20)、25.45%(G40). 这可能是由于PC8电导率远远超过PC4,因此对AQDS溶液中电子转移速率的提高更为明显. 在更高浓度的热解炭添加量下(4 mg和8 mg)也出现类似的规律(图5e和图5f).
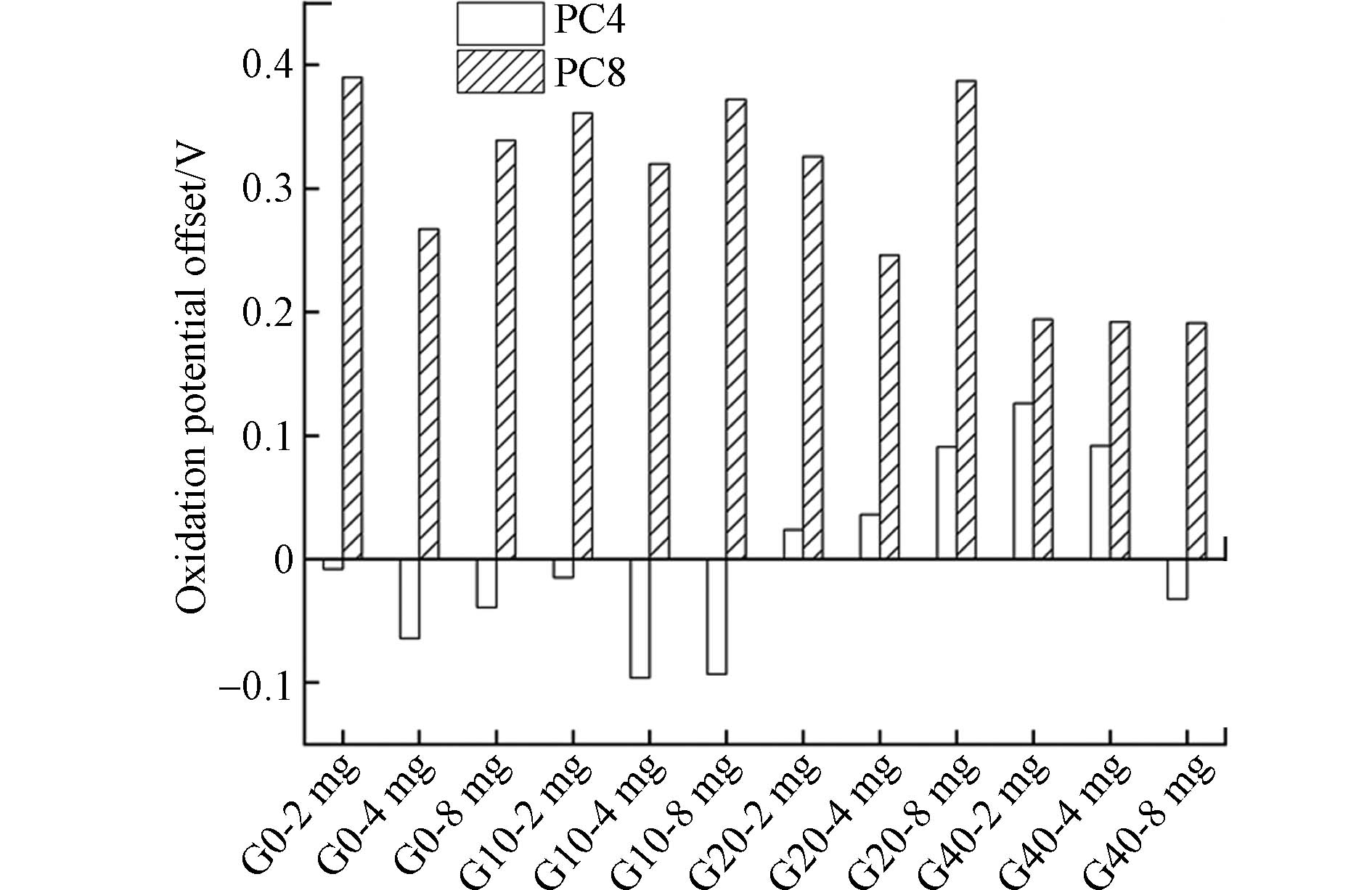
在循环伏安曲线分析中,还可以通过氧化的峰电位来分析AQDS的电子传递过程. 氧化峰电位偏移量为正值时,表明氧化电位越高,氧化反应越容易发生;氧化电位偏移量为负值时,表明氧化电位越低,氧化反应越不容易发生[32]. 由图6可知,在加入PC4与PC8后,PC4-G0—G10添加的AQDS溶液体系中氧化峰往负电位偏移,这说明AQDS在电极表面的氧化反应的发生更加困难;而PC4-G20—G40与PC8的氧化峰电位往正电位偏移,说明AQDS在电极表面的氧化过程更加容易. 这一结果也表明,由于热解炭导电性的提高,改善了AQDS在电极表面的氧化还原过程的反应条件,导致氧化过程更容易进行.
-
为了判断热解炭对AQDS介导电子传递能力的影响,通过Randles−Sevcik方程(式(1))计算了理论峰电流,并观察实际峰值电流与外加电位扫描速率的平方根的关系:
式中ip是理论峰电流,n(n=2)是AQDS的转移电子数,A(
0.0314 cm−2)是电极表面积,C是电解液中AQDS的剩余浓度,v(0.2 V·s−1)表示电位扫描速率,D0(9.663×10−7cm2·s−1)是电解液中AQDS的扩散系数.如图7所示,循环伏安测试过程中,可以观察到峰值电流与外加电位扫描速率的平方根的线性关系符合式(1),表明即使在热解炭存在的条件下,AQDS在溶液中的氧化还原反应为准可逆反应.
基于在循环伏安中观察到的还原和氧化峰电位的广泛分离,进一步通过式(2)计算了溶液中AQDS的电子转移速率常数(k0),更直接地反映出溶液中AQDS协同热解炭的电子传递速率的变化.
式中k0为电子转移速率常数,截距是从峰值电流绝对值(ln|ip|)的自然对数和过电位(即峰电位和形式电位之间的差)的线性拟合中在不同的扫描速率下获得的. F是法拉第常数,n(n=2)是AQDS的转移电子数,A(0.0314 cm2)是电极表面积,C是电解液中AQDS的剩余浓度.
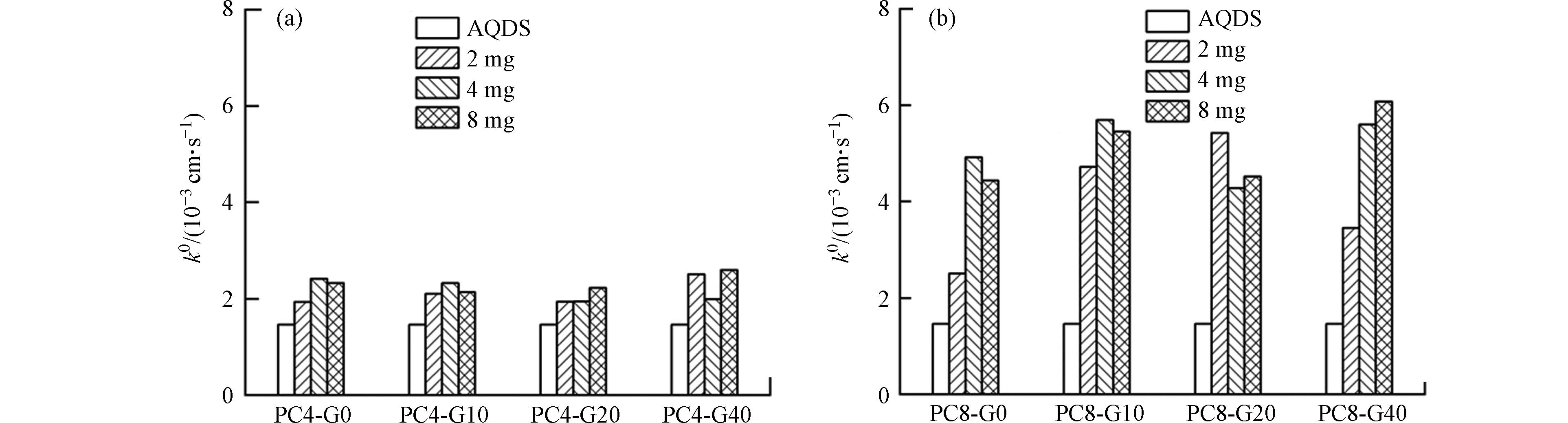
由图8(a,b)可知,AQDS溶液的k0为1.46×10−3 cm·s−1,与文献报道的数据一致[31]. 当加入PC4和PC8时,溶液的k0均有所提高. 在PC4-G0添加下,随着热解炭添加越多,电子传递速度越快,溶液的k0增至2.41×10−3 cm·s−1(PC4-G0-4 mg),但是电子传递速率升高到一定程度就不再升高,这是因为热解炭碳化温度较低,整体电导率较低. 在PC4-G10—G40添加的体系中,也有相似的结果. 而在PC8-G0—G40中,由于PC8的导电性强于PC4,所以其对AQDS电子传递速率的提高作用更加显著;随着生物炭添加量的增多,电子传递速率升高到一定程度也不再升高,这可能是因为热解炭产生团聚效应,对电子传递速率造成负面影响. 这些结果表明,溶液中AQDS在与热解炭的共存情况下,热解炭良好的导电性是强化AQDS介导电子转移能力的关键因素.
-
本文的研究发现,在AQDS溶液中添加PC4和PC8后,CV氧化峰电流出现了升高或降低两种不同的现象. 这是因为热解炭对AQDS的吸附和热解炭自身导电性的双重作用下,电子传递速率发生了相应的改变:低导电性热解炭导致氧化峰电流降低,高导电性热解炭导致氧化峰电流升高. 由于PC8的电导率远高于PC4,因此它能够更有效地提高AQDS溶液中的电子传递速率. 因此,导电性热解炭影响NOM电子传递速度的关键. 本文的研究结果,聚焦于热解炭和NOM的协同介导电子传递过程,有利于准确理解两者的生物地球化学协同效应.
热解炭和AQDS协同介导电子传递过程
Study on electron transport process mediated by pyrolyed carbon and AQDS
-
摘要: 随着热解炭在环境中应用的增多,天然有机质(nature organic matter,NOM)与热解炭在环境中的共存现象也越来越普遍;两者都具有介导电子传递的能力,但两者的联合介导电子传递过程却没得到相应研究. 本文以蒽醌-2,6-二磺酸二钠(anthraquinone-2,6-disulfonate,AQDS)作为NOM在实验室条件下的模拟物,添加不同质量的石墨烯与海藻酸钠混合制备具有明显电导率差异的热解炭,通过电化学工作站扫描AQDS与热解炭混合后的循环伏安曲线,计算分析其电子转移速率的变化. 由于具有较大的比表面积和丰富的含氧官能团,热解炭可以吸附一定的AQDS. 通过电子传递常数分析发现,虽然部分AQDS被吸附,但是热解炭可以强化溶液中剩余AQDS的电子转移能力;且这一强化作用随着热解炭的导电性的升高而增强. 由于热解炭和NOM介导的电子传递过程在碳氮循环等众多生物地球化学过程中扮演重要角色,因此本研究将为准确评估热解炭和NOM的地球化学效应提供理论支撑.Abstract: With the increasing application of pyrolyzed carbon (PC) in the environment, the coexistence of natural organic matter (NOM) and PC in the environment is becoming more and more common. Both of them have the ability of mediating electron transport, but the combined mediating electron transfer process by both PC and NOM has not been studied. In this paper, anthraquinone-2,6-disulfonate (AQDS) is used as the simulation of NOM under laboratory conditions, and different qualities of graphene are combined with sodium alginate to prepare PC samples with obvious conductivity differences. The cyclic voltammetry curves of AQDS mixed with PC with different conductivity were scanned by the electrochemical workstation, and the changes of electron transfer constant rate were calculated and analyzed. Due to its large specific surface area and abundant oxygen-containing functional groups, PC can adsorb certain AQDS. The electron transfer constant rate analysis shows that although some AQDS are adsorbed, the electron transfer capacity of remaining AQDS in solution could be enhanced by PC. The strengthening effect was enhanced with the conductivity increase of PC. Since the electron transfer process mediated by both PC and NOM plays an important role in many biogeochemical processes such as carbon and nitrogen cycles in the environment, this study will provide theoretical support for accurately evaluating the combined geochemical effects of PC and NOM.
-
Key words:
- pyrolyzed carbon /
- NOM /
- conductivity /
- electron transport.
-

-
-
[1] ZHOU Z, MUEHE E M, TOMASZEWSKI E J, et al. Effect of natural organic matter on the fate of cadmium during microbial ferrihydrite reduction[J]. Environmental Science & Technology, 2020, 54(15): 9445-9453. [2] FERNANDO MAHLER C, dal SANTO SVIERZOSKI N, AUGUSTO ROLIM BERNARDINO C. Chemical characteristics of humic substances in nature[M]// ABDELHADI M, editor. Humic Substance. IntechOpen, 2021 [3] MAYHEW L, SINGH A P, LI P, et al. Differentiation between humic and non-humic substances using alkaline extraction and ultraviolet spectroscopy[J]. Journal of AOAC International, 2023, 106(3): 748-759. doi: 10.1093/jaoacint/qsad001 [4] BAI Y G, MELLAGE A, CIRPKA O A, et al. AQDS and redox-active NOM enables microbial Fe(III)-mineral reduction at cm-scales[J]. Environmental Science & Technology, 2020, 54(7): 4131-4139. [5] YANG P J, JIANG T, CONG Z Y, et al. Loss and increase of the electron exchange capacity of natural organic matter during its reduction and reoxidation: The role of quinone and nonquinone moieties[J]. Environmental Science & Technology, 2022, 56(10): 6744-6753. [6] KELLER J K, WEISENHORN P B, MEGONIGAL J P. Humic acids as electron acceptors in wetland decomposition[J]. Soil Biology and Biochemistry, 2009, 41(7): 1518-1522. doi: 10.1016/j.soilbio.2009.04.008 [7] KAPPLER A, BENZ M, SCHINK B, et al. Electron shuttling via humic acids in microbial iron(III) reduction in a freshwater sediment[J]. FEMS Microbiology Ecology, 2004, 47(1): 85-92. doi: 10.1016/S0168-6496(03)00245-9 [8] ZHUANG X Z, SONG Y P, ZHAN H, et al. Pyrolytic conversion of biowaste-derived hydrochar: Decomposition mechanism of specific components[J]. Fuel, 2020, 266: 117106. doi: 10.1016/j.fuel.2020.117106 [9] KWIECIŃSKA B K, PUSZ S. Pyrolytic carbon—Definition, classification and occurrence[J]. International Journal of Coal Geology, 2016, 163: 1-7. doi: 10.1016/j.coal.2016.06.014 [10] GHANI W, MOHD A, Da SILVA G, et al. Biochar production from waste rubber-wood-sawdust and its potential use in C sequestration: Chemical and physical characterization[J]. Industrial Crops and Products, 2013, 44: 18-24. doi: 10.1016/j.indcrop.2012.10.017 [11] JIEN S H, WANG C S. Effects of biochar on soil properties and erosion potential in a highly weathered soil[J]. CATENA, 2013, 110: 225-233. doi: 10.1016/j.catena.2013.06.021 [12] ZHANG Y P, ADI V S K, HUANG H L, et al. Adsorption of metal ions with biochars derived from biomass wastes in a fixed column: Adsorption isotherm and process simulation[J]. Journal of Industrial and Engineering Chemistry, 2019, 76: 240-244. doi: 10.1016/j.jiec.2019.03.046 [13] AHMAD M, RAJAPAKSHA A U, LIM J E, et al. Biochar as a sorbent for contaminant management in soil and water: A review[J]. Chemosphere, 2014, 99: 19-33. doi: 10.1016/j.chemosphere.2013.10.071 [14] ZHANG Y, XU X Y, ZHANG P Y, et al. Pyrolysis-temperature depended quinone and carbonyl groups as the electron accepting sites in barley grass derived biochar[J]. Chemosphere, 2019, 232: 273-280. doi: 10.1016/j.chemosphere.2019.05.225 [15] LIU X Y, YANG L, ZHAO H T, et al. Pyrolytic production of zerovalent iron nanoparticles supported on rice husk-derived biochar: Simple, in situ synthesis and use for remediation of Cr(VI)-polluted soils[J]. Science of the Total Environment, 2020, 708: 134479. doi: 10.1016/j.scitotenv.2019.134479 [16] ZHAO N N, LIU Y H, ZHANG Y F, et al. Pyrogenic carbon facilitated microbial extracellular electron transfer in electrogenic granular sludge via geobattery mechanism[J]. Water Research, 2022, 220: 118618. doi: 10.1016/j.watres.2022.118618 [17] ZHOU L, CHI T Y, ZHOU Y Y, et al. Stimulation of pyrolytic carbon materials as electron shuttles on the anaerobic transformation of recalcitrant organic pollutants: A review[J]. The Science of the Total Environment, 2021, 801: 149696. doi: 10.1016/j.scitotenv.2021.149696 [18] XIANG Y J, XU Z Y, WEI Y Y, et al. Carbon-based materials as adsorbent for antibiotics removal: Mechanisms and influencing factors[J]. Journal of Environmental Management, 2019, 237: 128-138. [19] DAI Y J, ZHANG N X, XING C M, et al. The adsorption, regeneration and engineering applications of biochar for removal organic pollutants: A review[J]. Chemosphere, 2019, 223: 12-27. doi: 10.1016/j.chemosphere.2019.01.161 [20] MUZYKA R, MISZTAL E, HRABAK J, et al. Various biomass pyrolysis conditions influence the porosity and pore size distribution of biochar[J]. Energy, 2023, 263: 126128. doi: 10.1016/j.energy.2022.126128 [21] LI L D, LONG A, FOSSUM B, et al. Effects of pyrolysis temperature and feedstock type on biochar characteristics pertinent to soil carbon and soil health: A meta-analysis[J]. Soil Use and Management, 2023, 39(1): 43-52. doi: 10.1111/sum.12848 [22] SUN T R, LEVIN B D A, GUZMAN J J L, et al. Rapid electron transfer by the carbon matrix in natural pyrogenic carbon[J]. Nature Communications, 2017, 8: 14873. doi: 10.1038/ncomms14873 [23] GABHI R S, KIRK D W, JIA C Q. Preliminary investigation of electrical conductivity of monolithic biochar[J]. Carbon, 2017, 116: 435-442. doi: 10.1016/j.carbon.2017.01.069 [24] GABHI R, BASILE L, KIRK D W, et al. Electrical conductivity of wood biochar monoliths and its dependence on pyrolysis temperature[J]. Biochar, 2020, 2(3): 369-378. doi: 10.1007/s42773-020-00056-0 [25] LI X M, SHEN Q R, ZHANG D Q, et al. Functional groups determine biochar properties (pH and EC) as studied by two-dimensional (13)C NMR correlation spectroscopy[J]. PLoS One, 2013, 8(6): e65949. doi: 10.1371/journal.pone.0065949 [26] JANU R, MRLIK V, RIBITSCH D, et al. Biochar surface functional groups as affected by biomass feedstock, biochar composition and pyrolysis temperature[J]. Carbon Resources Conversion, 2021, 4: 36-46. doi: 10.1016/j.crcon.2021.01.003 [27] ZHANG M, GAO B, YAO Y, et al. Synthesis, characterization, and environmental implications of graphene-coated biochar[J]. Science of the Total Environment, 2012, 435/436: 567-572. doi: 10.1016/j.scitotenv.2012.07.038 [28] XU X J, QIN J G, LI Z. Large-scale preparation of graphene sheets and their easy incorporation with other nanomaterials[J]. Polymer Bulletin, 2012, 69(8): 899-910. doi: 10.1007/s00289-012-0803-1 [29] HE P J, LIU Y H, SHAO L M, et al. Particle size dependence of the physicochemical properties of biochar[J]. Chemosphere, 2018, 212: 385-392. doi: 10.1016/j.chemosphere.2018.08.106 [30] FAN Q Y, SUN J X, CHU L, et al. Effects of chemical oxidation on surface oxygen-containing functional groups and adsorption behavior of biochar[J]. Chemosphere, 2018, 207: 33-40. doi: 10.1016/j.chemosphere.2018.05.044 [31] BAI Y G, SUN T R, ANGENENT L T, et al. Electron hopping enables rapid electron transfer between quinone-/ hydroquinone-containing organic molecules in microbial iron(III) mineral reduction[J]. Environmental Science & Technology, 2020, 54(17): 10646-10653. [32] ELGRISHI N, ROUNTREE K J, McCARTHY B D, et al. A practical beginner’s guide to cyclic voltammetry[J]. Journal of Chemical Education, 2018, 95(2): 197-206. doi: 10.1021/acs.jchemed.7b00361 -



 下载:
下载: