-
自上世纪80年代以来,水中的砷(As)污染已被视为最严重的环境健康危害因素之一. 在天然水体中,砷的主要存在形式为无机砷酸盐与亚砷酸盐,也有少量的砷以甲基砷化物等有机砷形式存在[1]. 砷的毒性与其存在形态有关,其中无机亚砷酸盐的毒性最大. 无机亚砷酸盐主要存在于地下水等还原性环境中. 当As污染的地下水被用作饮用水、农业灌溉用水或渔业用水后,人群通过食物链长期接触会导致多种癌症及心血管、免疫、神经、内分泌问题的发生率增加[2]. 据估计,全球有
9400 万至2.2亿人可能受高浓度As污染地下水影响,其中绝大多数(94%)在亚洲[1]. 在中国,有近2000万人存在As污染饮用水暴露风险[3]. As的慢性毒性没有阈值,应尽可能地减少其摄入,在使用As地下水之前进行处理,是降低其健康风险的最可行和最佳策略[4].吸附是成本效益高且操作方便的除砷技术. 铁基材料,包括磁铁矿氧化物[5]、赤铁矿氧化物[6]、零价铁[7 − 8]、施氏矿物[9]、铁与其他金属的复合氧化物[10 − 12]及各种载体材料负载的铁氧化物[13 − 15]等,常被用作水体As吸附剂. 其中,纳米级吸附剂尤其受青睐,因为其较大的比表面积和表面活性,对As具有较大的吸附容量和吸附速率[16]. 近年来,磁性纳米氧化铁吸附剂引起了研究人员的广泛关注[17 − 18]. 磁性吸附剂在使用后,可以在外加磁场的作用下,非常便利地从水中分离. 典型的磁性氧化铁包括Fe3O4和γ-Fe2O3等. 研究人员发展了多种磁性纳米氧化铁的制备方法,如NaBH4还原[19]、金属有机物热分解[20]和羰基铁蒸气氢火焰燃烧[21]等,这些方法需要用到特殊原料,或者制备条件苛刻,需要用到特殊设备等. 简单和低成本的磁性纳米铁基吸附剂制备方法是研究开发的方向之一.
本研究的目的是开发简单的乙酸盐热分解法制备磁性纳米氧化铁,探究制备条件对材料结构的影响,并揭示材料对地下水中常见的亚砷酸盐形态砷(As(III))的吸附性能.
-
乙酸铁(含铁量18%—22%)购自武汉市伟琪博星生物科技有限公司,亚砷酸钠购自成都艾科达化学试剂有限公司,其余试剂产自国药化学试剂公司.
-
将10 g乙酸铁分别在空气和氮气中于250 ℃焙烧2 h,得到的样品分别命名为FeAc-A和FeAc-N. 其中焙烧时的升温速率为10 ℃·min−1,在空气中焙烧是在马弗炉中进行,在氮气中焙烧是在管式炉中进行且氮气气体流量为30 mL·min−1.
-
X射线衍射(XRD)在X射线衍射仪(荷兰PANALYTICAL)上测定,使用铜靶光源,其中XRD的扫描范围为10°—80°,扫描速率为10°·min−1. 透射电镜(TEM)图在JEM-2100F型透射电子显微镜(日本JEOL)上获得. BET比表面积用V-sorb 2800P型比表面积与孔径分析仪(北京金埃谱)测定,样品测定前在300 ℃真空中脱气2 h. 磁化曲线用
7404 型振动样品磁强计(美国LakeShore)测定. -
用稀HCl或稀NaOH溶液将一定浓度的亚砷酸钠溶液调至一定的pH值,取10 mL该溶液加入到25 mL的螺口样品瓶中,加入4 mg吸附剂,盖紧瓶盖后,在摇床上振荡10 h(25 ℃,250 r·min−1)确保达到吸附平衡,离心后,测上清液中As的浓度.
-
不同初始As浓度(1—50 mg∙L−1)吸附实验,以吸附剂的平衡吸附量对溶液中As的平衡浓度作图,得到As的吸附等温线. 分别用Langmuir模型和Freundlich模型进行吸附等温线数据拟合.
Langmuir模型描述了匀质表面的单层吸附行为,其线性表达式如式(1)所示[22 − 23]:
式中,Ce(mg∙L−1)和Qe(mg∙g−1)分别指溶液中As的平衡浓度和吸附剂对As的平衡吸附量,Qm(mg∙g−1)是最大吸附容量,b(L∙mg−1)是吸附常数,与吸附能有关.
Freundlich模型描述了非匀质表面的多层吸附行为,其线性表达式如式(2)所示[22 − 23]:
式中,Ce(mg∙L−1)和Qe(mg∙g−1)分别指溶液中As的平衡浓度和吸附剂对As的平衡吸附量,Kf(mg·g−1)与吸附容量有关,常数n与吸附强度有关并反映了浓度对吸附的影响.
根据Langmuir模型中的吸附平衡常数b(L∙mol−1),可以依据式(3)计算吸附过程的吉布斯自由能变化量:
式中,ΔG°(kJ∙mol−1)是吸附过程的吉布斯自由能变化量,R是通用气体常数(8.31 J∙mol−1∙K−1),T是吸附发生时的温度(K). 如果ΔG°小于0,说明吸附是自发的.
-
在一系列25 mL的样品瓶中各加入6 mg吸附剂,然后各加入10 mL浓度为10 mg∙L−1的亚砷酸钠溶液,将溶液pH调为7,放在摇床上(25 ℃,250 r·min−1),在不同设定时间取出一个样品瓶,测定溶液中As的浓度,即可计算得到反应不同时间后的吸附量,分别用准一级动力学模型和准二级动力学模型进行数据拟合.
准一级动力学模型与准二级动力学模型的公式分别如式(4)与式(5)所示[19 − 20]:
式中,Qe(mg∙g−1)和Qt(mg∙g−1)分别为达到吸附平衡时和吸附时间为t时吸附剂对砷的吸附量,k1(min−1)代表准一级动力学吸附速率常数,k2(g∙mg−1∙min−1)为准二级动力学吸附速率常数.
为明确扩散过程对吸附的影响,用颗粒内扩散模型(Webber-Morris模型)对吸附动力学数据进行拟合,表达式如式(6)所示[22 − 23]:
式中,Qt(mg∙g−1)为吸附时间为t(min)时吸附剂对As的吸附量,kp(mg∙g−1∙min−0.5)为内扩散速率常数,c(mg∙g−1)反映了边界层对吸附速率的影响. 如果Qt对t0.5作图所得曲线是通过原点的直线,则内扩散是决速步;如果不过原点,内扩散不是唯一的决速步. 常数c的值越大,则边界层的扩散速率对吸附速率的影响也越大.
-
采用氢化物发生-原子荧光法(HJ 694—2014)在AFS-
8220 型原子荧光光度计(北京吉天仪器)上测定上清液中残留As的浓度,根据式(7)计算吸附剂对As的平衡吸附量,根据式(8)计算吸附剂对As的去除率. -
图1是吸附剂的TEM图. FeAc-N由较小的纳米颗粒组成,且粒径分布范围窄,多数颗粒的粒径为10—12 nm. 相比之下,FeAc-A的粒径较大,且分布范围宽,多数为20—50 nm. FeAC-A的颗粒表现出更显著的棱角分明的晶体特征. 在空气中焙烧时,有机配体氧化释放出大量热,不可避免造成样品局部温度过高,发生烧结团聚,生长成较大的晶体粒子,因此,FeAc-A的粒径较大.
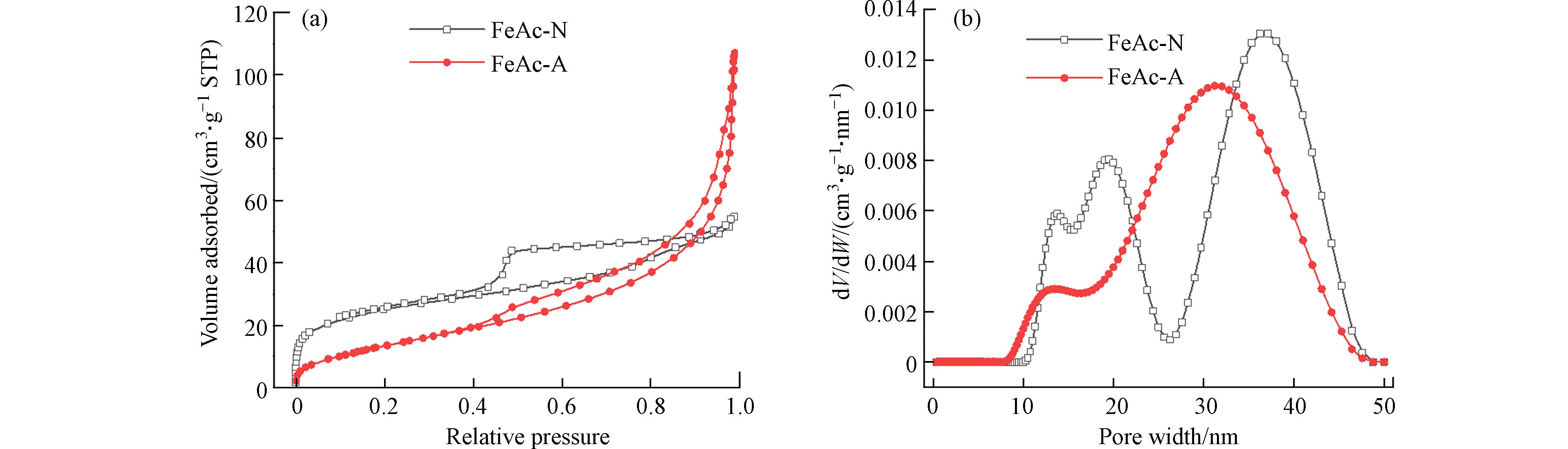
N2吸附-脱附等温线和NLDFT孔径分布曲线如图2所示. 两个材料的等温线都有显著的迟滞环,表明具有介孔结构. 而且,N2的吸附量随着相对压力的提高一直增加,在最高相对压力处也没有出现饱和平台,表明了材料的颗粒堆积孔特征[24]. 孔径分布曲线表明,主要孔径分布位于10—50 nm介孔范围内,微孔很少. 较大的孔径可归因于颗粒堆积的间隙较大,这是纳米颗粒组成的材料的特征. 测得的FeAc-N和FeAc-A的BET比表面积分别为90 m2∙g−1和53 m2∙g−1,这与TEM观察的结果一致,FeAc-N的粒径较小,因此暴露出更多的表面积.
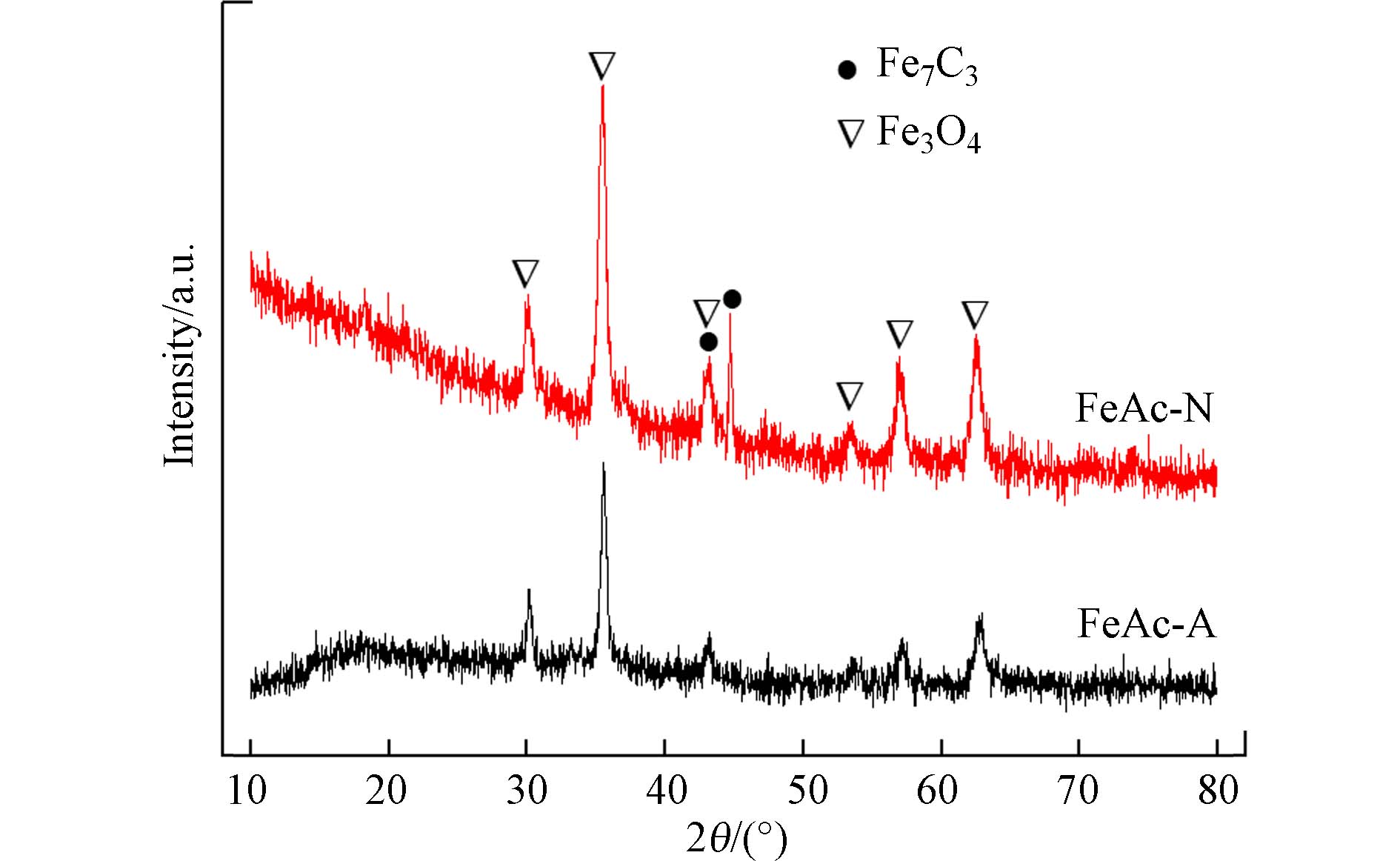
图3为吸附剂的XRD图谱. FeAc-A的衍射峰与磁铁矿相Fe3O4(JCPDS No.19-0629)的特征峰一致,且没有其他物相的显著衍射;而FeAc-N中除了含有Fe3O4外,在42.6°和44.9°处的微弱衍射峰归属于六方相Fe7C3(JCPDS No.17-0333),表明FeAc-N还含有Fe7C3. 在N2氛围下热分解乙酸铁,乙酸根配体作为碳源,生成了部分碳化物.
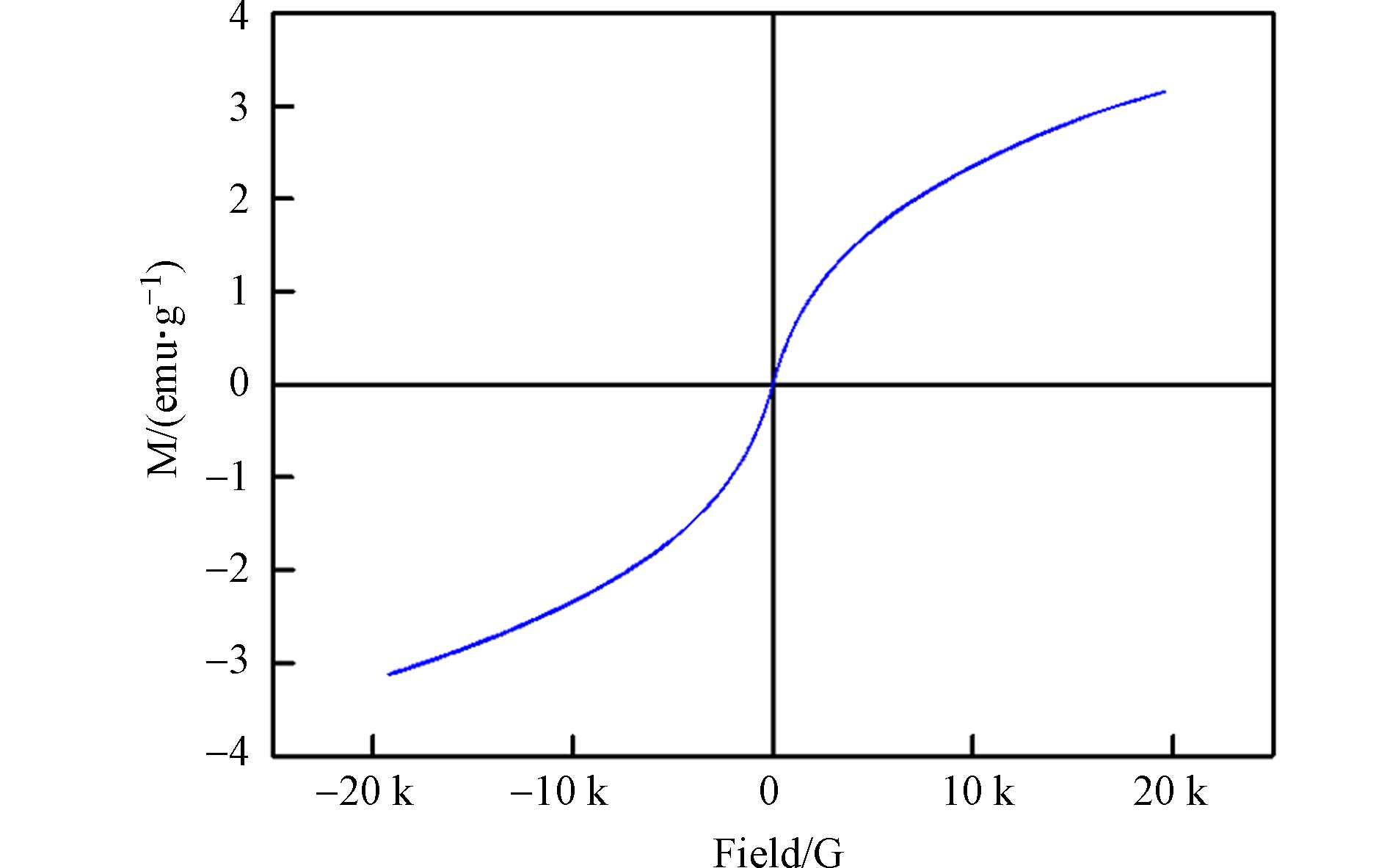
图4为FeAc-N的磁化曲线及退磁曲线. 退磁曲线和磁化曲线几乎重合,没有出现磁滞环,矫顽力和剩磁为零,说明样品具有超顺磁性,这是纳米磁性颗粒的特征[17,25]. 磁铁矿相Fe3O4的存在,使得材料可以对外部磁场做出响应,在水中作为吸附剂使用后,可以用外加磁场进行分离[22].
-
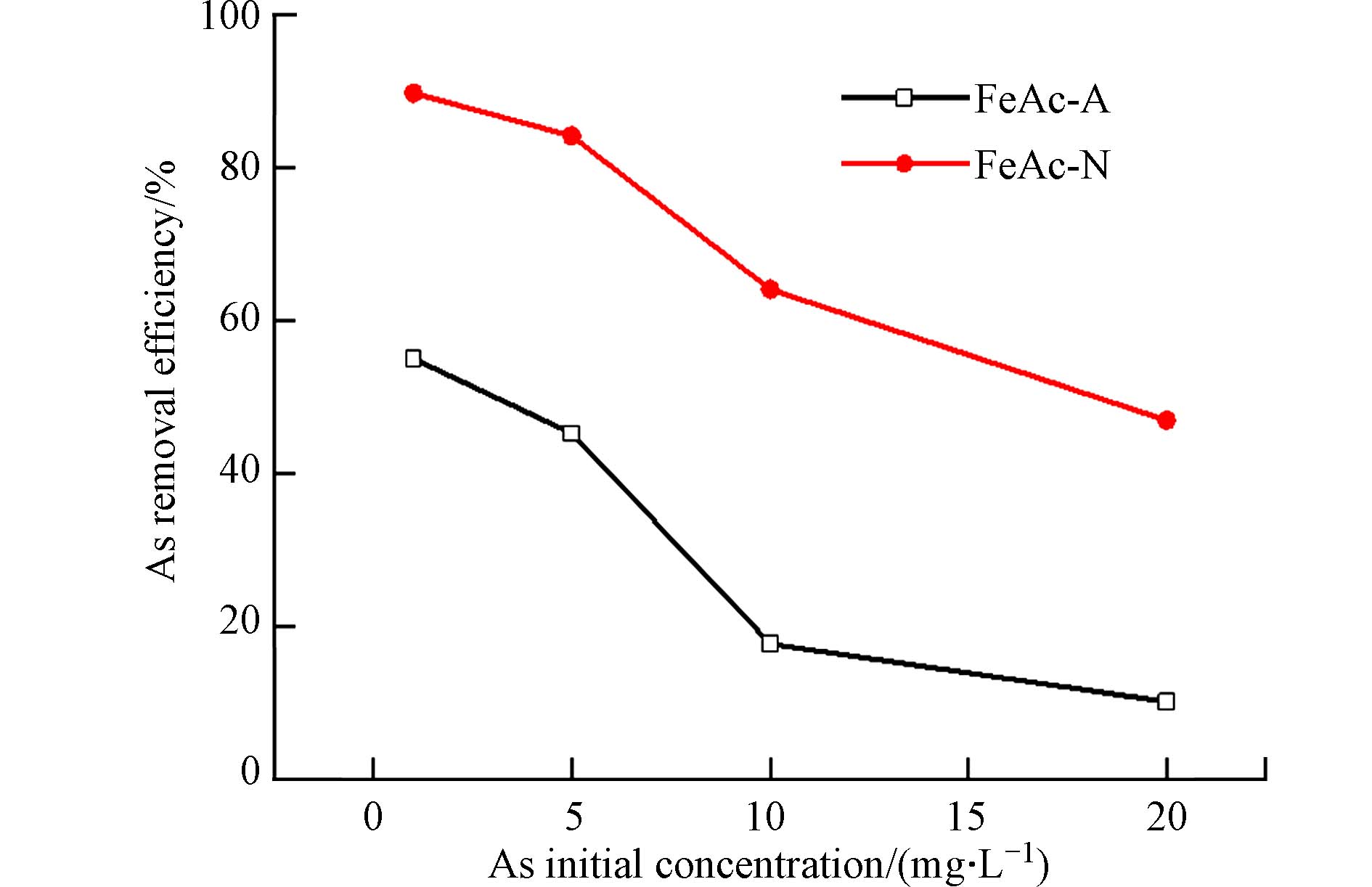
图5为中性条件、不同的As初始浓度下,0.4 g∙L−1的FeAc-N和FeAc-A对As的去除率. FeAc-N对As的去除率显著高于FeAc-A,这归因于前者具有更高的比表面积. 因此,选择FeAc-N进一步进行吸附性能研究.
-
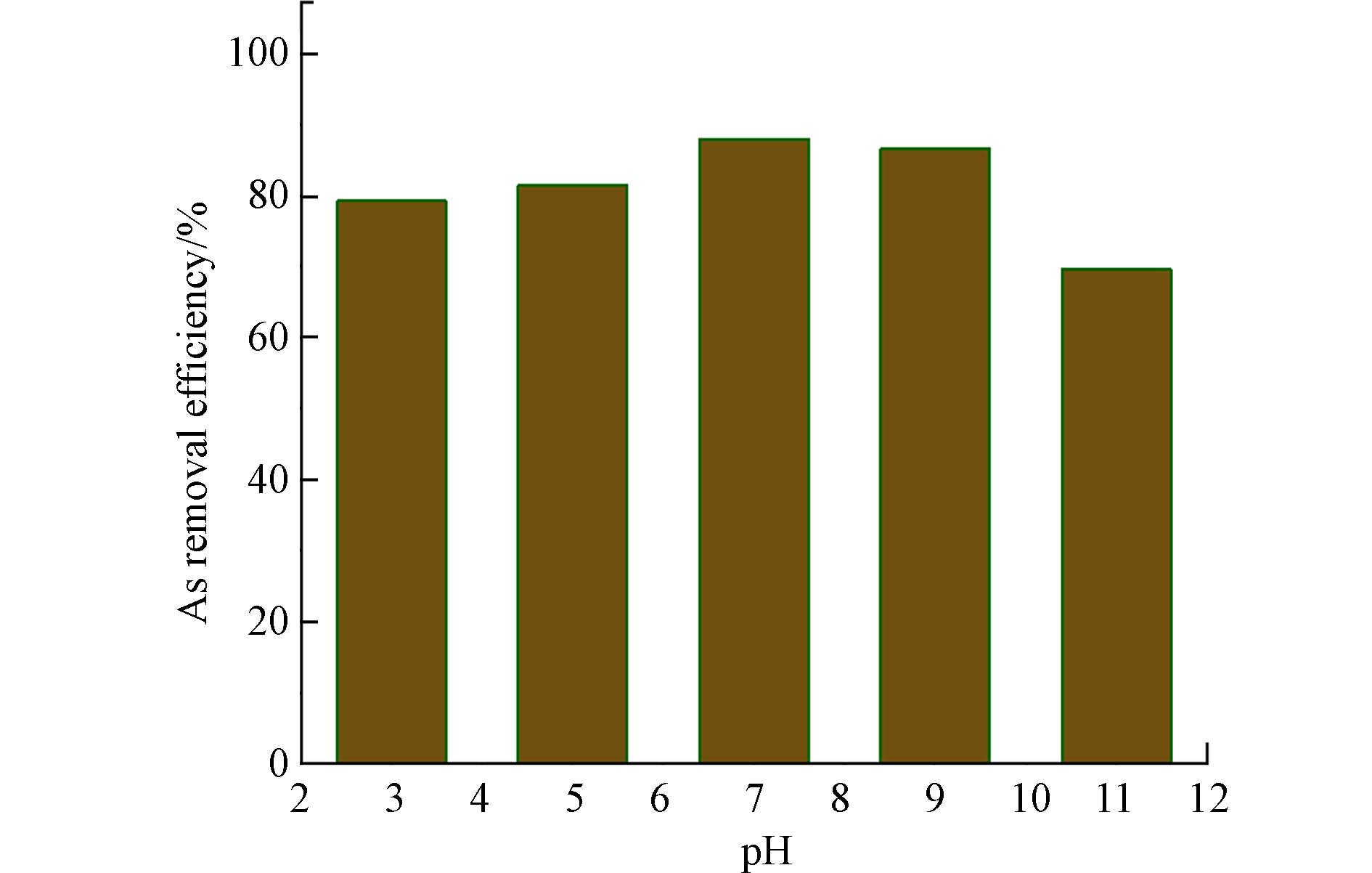
图6为不同pH下FeAc-N对As的去除率. 在pH 7时,去除效果最好. 研究表明,As的去除效率与吸附剂的表面化学和As的形态密切相关. H3AsO3的pKa为9.2,当pH < 9.2时,As主要以H3AsO3分子的形态存在,而当pH > 9.2时,H2AsO3−则成为主要的形态[19 − 20]. Fe3O4的等电点约为pH 6.5[26],在过高的pH下,Fe3O4表面发生去质子化而使净电荷为负,与H2AsO3−存在静电斥力,因而不利于As吸附. Goldberg等[27]总结了氧化铁和砷表面的羟基在吸附过程中形成内层络合物的表面反应过程,如式(9)和(10)所示. 在这些反应式中,氧化铁表面的羟基和砷分子的羟基参与了表面配位反应. 在等电点附近,吸附剂表面存在最多的电荷中性的表面羟基,这可能是pH 7时As的去除率最高的原因,先前研究中也观察到类似的现象[22].
-
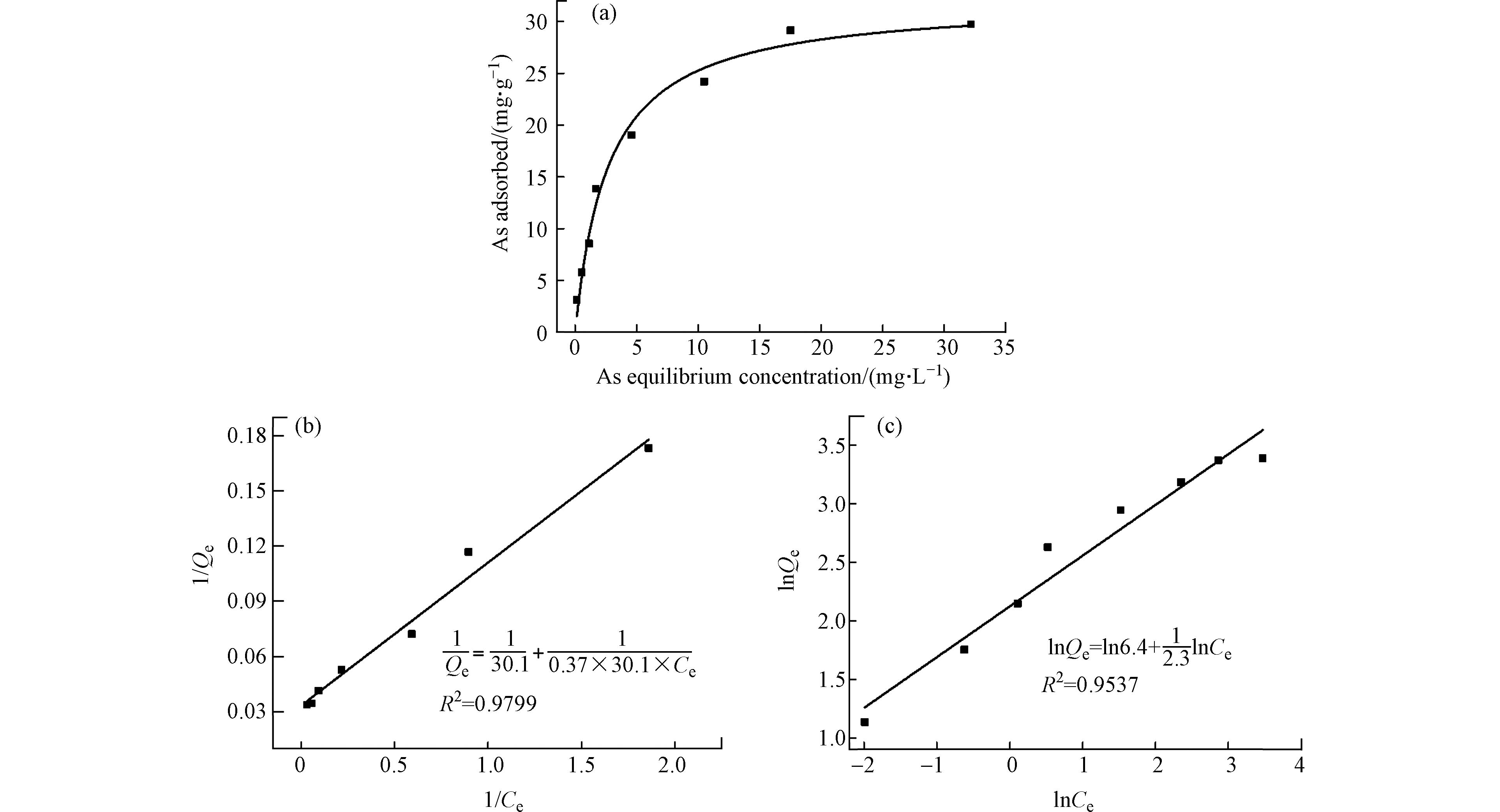
图7为pH 7、25 ℃条件下As在FeAc-N上的吸附等温线以及Langmuir和Freundlich等温线模型拟合.
等温线(图7a)显示,FeAc-N对As(Ⅲ)的最大吸附量约30 mg∙g−1. 对比两种等温线模型拟合的相关系数(R2),Langmuir模型(图7b)比Freundlich模型(图7c)的拟合度更高,说明Langmuir模型能更好的描述FeAc-N对As(Ⅲ)的吸附,即As吸附为单层吸附. 从Langmuir模型预测的FeAc-N对As的最大吸附量是30.1 mg∙g−1,与从等温线观察到的数据吻合.
Langmuir模型中As的吸附平衡常数b为0.37 L∙mg−1(即2.8 × 104 L∙ mol−1),根据公式(3)计算得到的As在FeAc-N上吸附的ΔG°为−25.5 kJ∙mol−1,该值为负值,说明吸附是不需要消耗外部能量的自发过程.
-
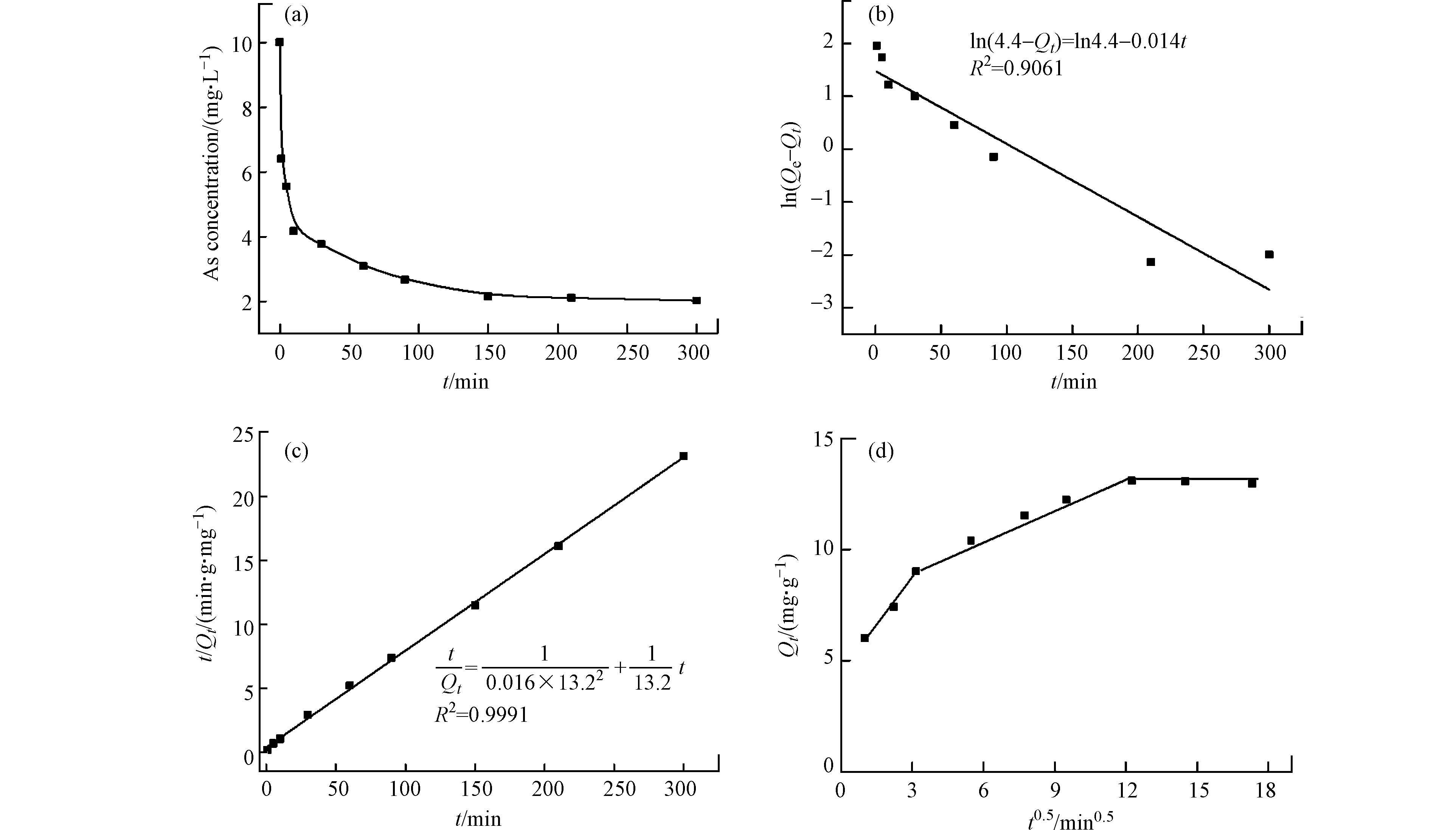
图8a是批吸附实验过程中As的浓度随时间的变化情况. 在前10 分钟,As浓度迅速下降,随后浓度下降速率变缓,约150 min后,浓度不再改变,达到吸附平衡. 图8b与图8c分别是动力学数据的准一级模型和准二级模型拟合的结果. 根据拟合的相关系数(R2),准二级动力学模型能更好的描述As在FeAc-N上的吸附动力学,符合准二级动力学常被当作化学吸附发生的标志[22 − 23]. 对于As在氧化物表面的吸附,砷酸分子与表面羟基之间发生配体交换形成内层络合物是常见的吸附机制(如式7和式8所示),该过程伴随中心原子配位水分子(羟基)的失去,为化学过程.
图8d为用颗粒内扩散模型对吸附动力学数据进行拟合的结果. 颗粒内扩散模型的拟合通常可以分为3个阶段,第一阶段的斜率较大,反映了吸附质被吸附到吸附剂外表面的过程,即As扩散到吸附剂的外表面快速占据表面吸附位点,对应吸附动力学曲线的前10 min(图8a),这个阶段中吸附质分子在边界层的扩散是决速步;第二阶段反映了吸附质被吸附到吸附剂内表面的过程,即As扩散到吸附剂的孔道中,对应吸附动力学曲线上As浓度缓慢下降阶段(图8a),这个阶段颗粒内扩散是决速步;第三段与X轴平行,表示吸附剂的外表面和内部孔道都占据了吸附质,吸附过程已达到平衡. 在本研究中,颗粒内扩散拟合曲线不过原点,说明As在FeAc-N上吸附过程中,颗粒内扩散不是唯一的决速步. 如前所示,FeAc-N有纳米颗粒堆积而成的较大孔,因而内扩散阻力小,这也是纳米吸附剂在应用中的优点之一[16].
-
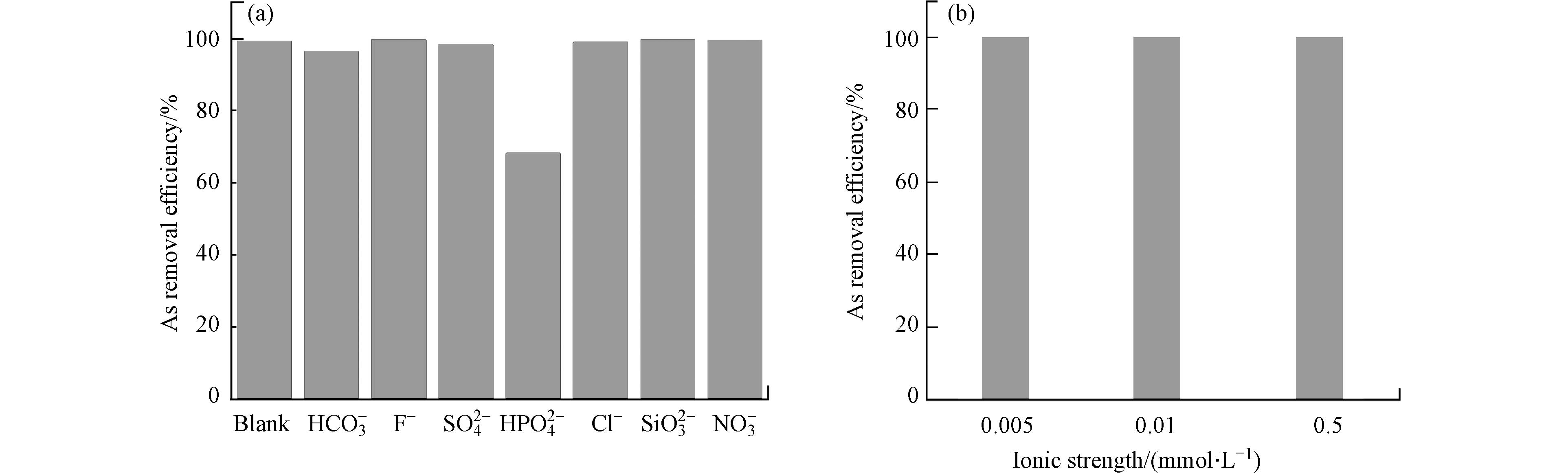
As污染的地下水中通常存在其他共存阴离子,其可能会与As竞争吸附剂表面的位点,从而抑制As的去除. 本工作中还研究了共存离子对吸附性能的影响. 向1 mg∙L−1(0.013 mmol∙L−1)的As溶液中加入1 mmol∙L−1的共存电解质,包括Na2SO4、NaHCO3、NaCl、Na2SiO3、NaF、Na2HPO4、NaNO3等,再开展批吸附实验(FeAc-N剂量0.6 g∙L−1),结果如图9a所示. 虽然共存离子的浓度远高于As的浓度,HCO3−、F−、SO42−、Cl−、SiO32−、NO3−等对As吸附几乎没有影响,只有HPO42−将As(Ⅲ)的去除率从99.1%降低到68.1%. P和As都位于元素周期表的第七主族,它们的离子形态相似,因此存在较强的竞争性吸附. 尽管如此,As的去除率仍然接近70%. 在地下水中,共存离子浓度不会远远超过As的浓度,因此不会严重干扰FeAc-N对As的吸附.
本工作也研究了离子强度对As吸附的影响. 向As溶液中加入5—500 mmol∙L−1的NaNO3,再开展批次吸附实验,结果如图9b所示. 离子强度的增加对砷的去除率没有影响. 离子强度会降低静电吸附形成的外层络合物的稳定性,但是不会减弱内层化学吸附[22 − 23]. 因此,离子强度的影响实验也表明,As在FeAc-N表面的吸附机制是通过表面化学配位形成了内层络合物.
-
通过在250 ℃焙烧乙酸铁,可以简单快捷的制备得到磁性纳米氧化铁,尤其是在氮气氛围下焙烧得到纳米颗粒粒径约10—12 nm,材料的BET比表面积约90 m2∙g−1,颗粒堆积孔较大,主要孔径分布在10—50 nm. 将材料用于水体中As的吸附,在pH 3—9范围内都有较好的去除率,其中在pH 7下的效果最好. 吸附等温线符合Langmuir模型,最大吸附量约30 mg∙g−1. 吸附动力学符合准二级模型,吸附机制为表面化学配位,离子强度对吸附没有影响. 水中的常见共存离子对As的吸附没有显著影响. 本论文方法制备的磁性纳米氧化铁有望作为低成本的水体除砷材料.
乙酸铁热分解制备磁性纳米氧化铁及对砷的吸附性能
Preparation of magnetic nano iron oxide by thermal decomposition of ferric acetate and its adsorption performance for arsenic
-
摘要: 磁性纳米氧化铁可以高效吸附去除水体中的砷(As),且可通过外加磁场进行分离,但是材料的制备过程一般较复杂. 本研究通过简单的乙酸铁热分解法制备了磁性纳米氧化铁,对其进行了表征,并通过批次吸附实验探究了其对As的吸附性能. 在氮气氛围中250 ℃热分解乙酸铁,得到的纳米颗粒粒径约10—12 nm,材料的BET比表面积约90 m2∙g−1,主要孔径分布为10—50 nm,为颗粒堆积孔结构. 材料在pH 3—9范围内都能高效去除水体中的As,其中在pH 7下的效果最好. 吸附等温线符合Langmuir模型,最大吸附量约30 mg∙g−1. 吸附动力学符合准二级模型,吸附机制为表面化学配位形成内层络合物,离子强度对吸附没有影响. 地下水中的常见共存离子对As的吸附没有显著影响. 乙酸铁热分解法可作为制备磁性纳米铁基除砷吸附剂的低成本方法.Abstract: Magnetic iron oxide nanoparticles can efficiently adsorb and remove arsenic from water, and can be separated by an external magnetic field. However, the preparation process of the material is generally complicated. In this study, magnetic iron oxide nanoparticles were prepared using a simple thermal decomposition method, and characterized with different techniques, and then their adsorption performance for As were investigated. The study showed that ferric acetate thermal decomposition at 250 ℃ under a nitrogen atmosphere produced nanoparticles with a particle size of about 10—12 nm. The BET specific surface area of the material is approximately 90 m2∙g−1, with a predominant pore size distribution of 10—50 nm, and possessing a particle aggregate pore structure. The synthesized adsorbents can efficiently remove As from water in the pH range of 3—9, with the best performance achieved at pH 7. The adsorption isotherm fits the Langmuir model, with a maximum adsorption capacity of approximately 30 mg∙g−1. The adsorption kinetics follow the pseudo-second order model, and the adsorption mechanism involves surface chemical coordination to form an innersphere complex, which is not affected by ionic strength. The common co-existing ions in groundwater have no significant effects on As removal. The ferric acetate thermal decomposition method can serve as a low-cost method for preparing magnetic iron-based arsenic adsorbents.
-
Key words:
- arsenic /
- nano iron oxide /
- magnetic adsorbent /
- water purification /
- adsorption.
-

-
-
[1] PODGORSKI J, BERG M. Global threat of arsenic in groundwater[J]. Science, 2020, 368(6493): 845-850. doi: 10.1126/science.aba1510 [2] TYLER C R, ALLAN A M. The effects of arsenic exposure on neurological and cognitive dysfunction in human and rodent studies: A review[J]. Current Environmental Health Reports, 2014, 1(2): 132-147. doi: 10.1007/s40572-014-0012-1 [3] RODRÍGUEZ-LADO L, SUN G F, BERG M, et al. Groundwater arsenic contamination throughout China[J]. Science, 2013, 341(6148): 866-868. doi: 10.1126/science.1237484 [4] LIU R P, QU J H. Review on heterogeneous oxidation and adsorption for arsenic removal from drinking water[J]. Journal of Environmental Sciences, 2021, 110: 178-188. doi: 10.1016/j.jes.2021.04.008 [5] CHOWDHURY S R, YANFUL E K. Arsenic and chromium removal by mixed magnetite-maghemite nanoparticles and the effect of phosphate on removal[J]. Journal of Environmental Management, 2010, 91(11): 2238-2247. doi: 10.1016/j.jenvman.2010.06.003 [6] DICKSON D, LIU G L, CAI Y. Adsorption kinetics and isotherms of arsenite and arsenate on hematite nanoparticles and aggregates[J]. Journal of Environmental Management, 2017, 186: 261-267. [7] 赵雅光, 万俊锋, 刘奉滨, 等. 零价铁(ZVI)治理水体砷污染研究进展[J]. 环境化学, 2013, 32(10): 1943-1949. doi: 10.7524/j.issn.0254-6108.2013.10.018 ZHAO Y G, WAN J F, LIU F B, et al. Application of zero-valent iron(ZVI)technology for arsenic removal from aqueous environment[J]. Environmental Chemistry, 2013, 32(10): 1943-1949 (in Chinese). doi: 10.7524/j.issn.0254-6108.2013.10.018
[8] 胡一帆, 王文兵, 仵彦卿. 弱磁场强化零价铁去除水中砷的效果[J]. 环境化学, 2019, 38(5): 1074-1081. doi: 10.1002/etc.4383 HU Y F, WANG W B, WU Y Q. The role of weak magnetic field in accelerating the removal of arsenic by zero-valent iron[J]. Environmental Chemistry, 2019, 38(5): 1074-1081 (in Chinese). doi: 10.1002/etc.4383
[9] 罗灿钰, 张琢, 赵华甫. 施氏矿物的矿物学特征及其除砷研究进展[J]. 环境化学, 2021, 40(11): 3530-3543. doi: 10.7524/j.issn.0254-6108.2020070302 LUO C Y, ZHANG Z, ZHAO H F. The mineralogical characteristics of schwertmannite and its progress in arsenic removal[J]. Environmental Chemistry, 2021, 40(11): 3530-3543 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020070302
[10] 吴川, 黄柳, 薛生国, 等. 赤泥对砷污染的调控研究进展[J]. 环境化学, 2016, 35(1): 141-149. doi: 10.7524/j.issn.0254-6108.2016.01.2015071004 WU C, HUANG L, XUE S G, et al. Review on the application of bauxite residue on As contamination remediation[J]. Environmental Chemistry, 2016, 35(1): 141-149 (in Chinese). doi: 10.7524/j.issn.0254-6108.2016.01.2015071004
[11] LI M, KUANG S P, KANG Y, et al. Recent advances in application of iron-manganese oxide nanomaterials for removal of heavy metals in the aquatic environment[J]. Science of the Total Environment, 2022, 819: 153157. doi: 10.1016/j.scitotenv.2022.153157 [12] 曾辉平, 于亚萍, 吕赛赛, 等. 基于铁锰泥的除砷颗粒吸附剂制备及其比较[J]. 环境科学, 2019, 40(11): 5002-5008. ZENG H P, YU Y P, LÜ S S, et al. Preparation and comparison of arsenic removal granular adsorbent based on iron-manganese sludge[J]. Environmental Science, 2019, 40(11): 5002-5008 (in Chinese).
[13] VIEIRA B R C, PINTOR A M A, BOAVENTURA R A R, et al. Arsenic removal from water using iron-coated seaweeds[J]. Journal of Environmental Management, 2017, 192: 224-233. [14] ABU-NADA A, McKAY G, ABDALA A. Recent advances in applications of hybrid graphene materials for metals removal from wastewater[J]. Nanomaterials, 2020, 10(3): 595. doi: 10.3390/nano10030595 [15] 韦婧, 刘昳晗, 涂晨, 等. 铁修饰生物炭的制备及在砷污染土壤修复中的应用[J]. 环境科学, 2023, 44(2): 965-974. WEI J, LIU Y H, TU C, et al. Preparation of iron modified biochar and its application in arsenic contaminated soil remediation[J]. Environmental Science, 2023, 44(2): 965-974 (in Chinese).
[16] SAMUEL M S, SELVARAJAN E, SARSWAT A, et al. Nanomaterials as adsorbents for As(III) and As(V) removal from water: A review[J]. Journal of Hazardous Materials, 2022, 424: 127572. doi: 10.1016/j.jhazmat.2021.127572 [17] JAIN R. Recent advances of magnetite nanomaterials to remove arsenic from water[J]. RSC Advances, 2022, 12(50): 32197-32209. doi: 10.1039/D2RA05832D [18] 芦琳, 颜利玲, 梁美娜, 等. 磁性氧化铁/桑树杆生物炭的制备及其对砷污染土壤溶解性有机碳和砷形态的影响[J]. 环境科学, 2022, 43(11): 5214-5223. LU L, YAN L L, LIANG M N, et al. Preparation of magnetic iron oxide/mulberry straw biochar and its effects on dissolved organic carbon and arsenic forms in arsenic contaminated soil[J]. Environmental Science, 2022, 43(11): 5214-5223 (in Chinese).
[19] MAGRO M, MOLINARI S, VENERANDO A, et al. Colloidal maghemite nanoparticles with oxyhydroxide-like interface and chiroptical properties[J]. Applied Surface Science, 2020, 534: 147567. doi: 10.1016/j.apsusc.2020.147567 [20] LIU Z M, WU S H, JIA S Y, et al. Novel hematite nanorods and magnetite nanoparticles prepared from MIL-100(Fe) template for the removal of As(V)[J]. Materials Letters, 2014, 132: 8-10. doi: 10.1016/j.matlet.2014.06.059 [21] DAS G K, BONIFACIO C S, de ROJAS J, et al. Ultra-long magnetic nanochains for highly efficient arsenic removal from water[J]. Journal of Materials Chemistry A, 2014, 2(32): 12974-12981. doi: 10.1039/C4TA02614D [22] CHENG W, XU J, WANG Y J, et al. Dispersion-precipitation synthesis of nanosized magnetic iron oxide for efficient removal of arsenite in water[J]. Journal of Colloid and Interface Science, 2015, 445: 93-101. doi: 10.1016/j.jcis.2014.12.082 [23] CHENG W, ZHANG W D, HU L J, et al. Etching synthesis of iron oxide nanoparticles for adsorption of arsenic from water[J]. RSC Advances, 2016, 6(19): 15900-15910. doi: 10.1039/C5RA26143K [24] FERREIRA L S, TRIERWEILER J O. Modeling and simulation of the polymeric nanocapsule formation process[J]. IFAC Proceedings Volumes, 2009, 42(11): 405-410. doi: 10.3182/20090712-4-TR-2008.00064 [25] 韩帅鹏, 唐李文, 刘勤, 等. 磁性含磷油茶壳生物炭对水中磺胺甲噁唑的吸附特性[J]. 环境科学,2024, 45(2): 898-908. HAN S P, TANG L W, LIU Q, et al. Adsorption properties of magnetic phosphorous oil tea shell biochar on sulfamethoxazole in water[J]. Environmental Science, 2024, 45(2): 898-908(in Chinese).
[26] MILONJIĆ S K, KOPEČNI M M, ILIĆ Z E. The point of zero charge and adsorption properties of natural magnetite[J]. Journal of Radioanalytical Chemistry, 1983, 78(1): 15-24. doi: 10.1007/BF02519745 [27] GOLDBERG S, JOHNSTON C T. Mechanisms of arsenic adsorption on amorphous oxides evaluated using macroscopic measurements, vibrational spectroscopy, and surface complexation modeling[J]. Journal of Colloid and Interface Science, 2001, 234(1): 204-216. doi: 10.1006/jcis.2000.7295 -




 下载:
下载: