-
碳中和及排放峰值战略的实施促使污水处理向着节能绿色方向发展,由此短程硝化(PN)因其优异的节能降碳效果成为重要研究对象. PN是指氨氮(NH4+-N)被氨氧化微生物(AOM)氧化为亚硝态氮(NO2−-N)后,不会再被亚硝酸盐氧化细菌(NOB)氧化为硝态氮(NO3−-N). PN的实现可缩短反硝化从NO3−-N到NO2−-N的步骤,从而节省25%的曝气量和40%的电子供体[1]. 然而,在实际运行过程中PN难以稳定运行,其根本原因在于难以在维持AOM活性的前提下稳定抑制NOB活性.
近年来,学者提出多种方法以维持PN稳定运行,如高游离氨(FA)[2]、高游离亚硝酸盐(FNA)[3]、短污泥停留时间(SRT)[4]等方式. 但在实际运行过程中,因处理效果不佳或运行成本较高而无法有效普及,这促使研究者研发新的工艺以在实际运行过程中能较好的维持PN. 在脱氮过程中,氧气作为其中的电子受体,且在实际操作过程中易于控制,所以众多的研究采用控制溶解氧(DO)来启动并维持PN. 许多研究讨论了PN的启动及稳定运行,但是存在多种繁杂的原因解释且存在一定争议.
对此,本综述从DO对AOM的影响入手,系统阐述在PN过程中DO对AOM的影响机制,然后分析了 DO对破坏PN菌种的反馈机制,从生物种群富集与演替角度解释控制DO启动及维持PN. 并以此为基础综述了现有以控制DO为媒介的PN运行工艺,并点明了其优缺点,为实现更高效更稳定的PN提供新思路.
-
理想状态的PN工艺仅包含由AOM主导的氨氧化过程,因此要深入了解DO对PN工艺的影响,必须深入了解氨氧化过程机理及DO在其中所承担的职责. 总的来说,AOM可分为两类,分别为氨氧化菌(AOB)和氨氧化古菌(AOA),这两类细菌都可以完成氨氧化过程. 本节从作用机理的角度阐述DO在氨氧化过程中所承担的职责及因DO变化而引起AOB及AOA生化反应变化,意图在电子传递层次揭示DO在实现及维持PN的重要作用.
-
在传统硝化过程中,AOB将氨氮氧化为亚硝态氮,是整个硝化过程的第一步,也是整个硝化过程的限速步骤[5]. 而在这一步中,氨氮的氧化又可分为两小步,首先是氨氮在氨单加氧酶(AMO)的作用下转化为羟胺(NH2OH),然后NH2OH在羟胺氧化酶(HAO)的作用下转化为亚硝态氮. 但在2017年,CARANTO等[6]证明了NO为氨氮氧化的中间产物, HAO 将NH2OH氧化为NO而不是之前认为的亚硝酸盐. 然后再由一氧化氮还原酶(NOO)将NO转化为NO2−-N,但是其中的NOO尚未确定. nitrosocyanin(由基因NcyA编码)可能为尚未发现的NOO,且根据蛋白质组学的比较研究发现,Ncy A 在3株不同的AOB菌株中高表达,被认为可能是NOO [7-8]. 这一创新性的发现对PN工艺有着重大而又深远的影响,使得氨氮的氧化被分为三步,其与传统观念的主要区别为,在HAO作用下NH2OH转化为NO而不是直接转化为NO2−-N,再经过一氧化氮还原酶(NOO)或nitrosocyanin(NcyA)的作用下再转化为NO2−-N [9].
NH3在AMO的作用下,以一份O2作为电子受体,同时吸收两份H+及两份电子,从而生成一份NH2OH和一份H2O [10]. 此过程为氨氧化过程中最重要的一步,若这一步发生变化将对后续反应产生巨大影响. 在短程硝化过程中所有电子的最终归宿为电子受体或新细胞物质[11]. 新细胞物质的合成又取决于ATP合成量,而ATP合成量又取决于电子传递数量,若在PN过程中电子受体缺失将在一定程度上影响细菌生长.
在低DO条件下,由于电子受体缺失,AOB可能会利用NO2−-N作为替代的电子受体,促使AOB进行反硝化作用. 一部分AOB具有编码部分反硝化作用所需要的酶:在AOB的基因组中,人们检测到了编码NO2−和NO还原酶(NIR和NOR)的基因,但是没有检出编码N2O还原酶(NOS)基因[12]. 这意味着,AOB进行反硝化的途径终点产物是N2O而不是N2. 目前普遍认为硝化细菌反硝化作用是好氧硝化过程产生N2O的主要途径[13]. 综上可知,若当AOB被限制O2的获取时,可能会进行反硝化作用,使得AOB产生的亚硝酸盐及NO转化为温室气体N2O. 并且反硝化作用对AOB的能量代谢并不重要,但是在高氨氮情况下,反硝化可能是电子耗散的重要途径[8, 14]. 这也就说明电子的正常耗散对于AOB正常工作有着显著影响,而氧气充当电子受体,也就对AOB正常工作有着显著影响. 综上所述,O2在氨氧化过程中充当电子受体,当O2缺失时,可能会促使AOB活性下降,进行反硝化等一系列不良反应,使得PN促使的节能减排效果不理想.
-
在传统观念中,氨氧化过程一般通过AOB菌完成,但在2004年,VANTER等首次在马尾藻海区古菌宏基因组中发现AMO基因( amo A )序列[15]. 这表明,某些未知的古菌也可能驱动着氨氧化反应. 2005年,第一株古菌Nitrosopumilus mar-itimus SCM1被成功分离并纯培养[16]. 该菌具有amo A、amo B和amo C基因,以NH4+-N作为唯一氮源和能源,并且固定CO2进行无机自养生长,表明AOA与AOB具有相似的氨氧化能力. 2007年,AOA被划分为一个新的古菌门,命名为奇古菌(Thaumarchaeota)[17]. 迄今为止,根据16S rRNA基因序列,AOA被鉴定为8个主要类群[18-19] Nitrosotalea, Nitrosoarchaeum, Nitrososphaera, Nitrosopelagicus, Nitrosopumilus, Nitrosocaldus, Nitrosotenuis和Nitrosocosmicus.
目前关于AOA在氨氮氧化过程中的具体作用及相关反应的酶存在诸多猜想. 较多的猜想认为:AOA的相关氨氮氧化途径与AOB类似,但将NH2OH氧化为NO及将NO氧化为NO2−-N的酶均未确定[20-22]. 图1展现了AOB、AOA、NOB参与氮素转化的酶及在高低DO环境中反应的变化情况. AOA的AMO与AOB存在较大差异,这种差异可能会诱导氨氮氧化时产生不同的副产物[23].
AOA在自然界中分布较广,且AOA对于DO适应范围较广(0.1—6.0 mg·L−1)[24-25]. 低DO环境可以促进AOA的生长,且在低氧浓度下AOA比AOB具有竞争优势[26]. 表1展示了不同环境中AOB、AOA、NOB的氧半饱合系数. Xie等[34] 发现在实际水厂中,AOA对DO和氨氮的半饱和常数低于AOB,表明AOA比AOB更能将氨氧化成亚硝酸盐. AOA可以适应极低的电子供体/受体条件,这使得AOA可以在低氧条件下清除氨氮[36]. 这表明,在低DO环境中氨氧化菌的优势菌种可能为AOA,且在低DO环境中AOA有着较高的氨氮亲和力,故可更加彻底的去除污水中的氨氮,有利于满足污水排放标准.
DO不但影响AOA生长与活性,还会影响其相关酶活性及产物,使得产生许多副产物,从而促使AOA产生N2O. TRIMMER等[37]发现在好氧环境中,N2O主要通过NH2OH氧化途径产生. Xie等[34]研究发现 N2O是NH2OH氧化生成亚硝酸盐的副产物,且NH2OH积累促进了N2O的生成. 这都表明,在好氧环境中,N2O的生成与NH2OH有关. 当DO不足时,AOA的类细菌硝化细菌反硝化作用可能是AOA生成N2O的主要途径[38]. 此外,由于有氧条件的转变引起的电子不平衡(即缺氧到好氧或其他),N2O产量的峰值通常在这样的条件下出现[23]. 综上所述,AOA产生N2O的途径较多,这可归结为其酶功能特性与AOB有着巨大差异.
-
在实际PN反应器中,虽然AOM菌种占据主导地位,但是其中仍然含有少量的NOB或Comammox,在长期运行过程中反应器会因二者的过量增殖导致PN崩溃. 因此想要使得实际PN反应器能长久运行,必须深入了解能破坏PN的菌种的反应机理及溶解氧在其中所承担的职责.
-
在理想PN中,并没有NOB的参与,但是实际污泥中含有众多微生物,其中就包含了NOB等可能破坏PN过程的微生物,且NOB的活性恢复或过量增殖都有可能导致PN的崩溃. Wang等[29]发现,当DO发生较大变化时,正是由于NOB的活性恢复及增殖导致PN的崩溃.
在整个硝化过程中,NOB的作用是将亚硝酸盐氧化为硝酸盐,其中O2作为电子受体,接受在亚硝酸盐氧化过程中产生的电子及H+. 依据现有研究,亚硝酸盐的氧化过程仅需NXR酶即可进行,并且反应极易进行且无电子及H+释放. 若要实现短程硝化,需将NOB淘洗出活性污泥控制硝化过程停留在亚硝态氮阶段,可从动力学角度列式(1)分析NOB淘汰,并以此为根据促使NOB淘汰.
由动力学方程可知,实现NOB淘汰可以从三个方面着手:降低生长速率(μNOB),提高衰减速率(bNOB),如施加超声波[40]、添加FA[2]、使NOB遭受饥饿[41]等,或提高污泥耗损率(1 / SRT)来实现. 但提高bNOB需要额外的设备或者额外投加药剂,而短SRT会造成污泥流失,使得AOB菌种数量下降,从而使得脱氮效果下降,不适宜推广. 综上所述降低μNOB是一个较为实用的方向,因此列出主要影响μNOB的详细式(2)[42]:
其中,f为环境因素(温度,pH,盐度等)在实际运行中难以控制或费用较高,所以实际运行中主要通过控制DO浓度来限制NOB对于O2的获取. 综上所述,O2对于NOB的淘汰有重要作用.
关于NOB的淘汰根本原因,一直没有较为清晰的理论体系,众多文献是根据表观参数(如NAR等)、AOB与NOB的生物活性、菌种丰度等来判断NOB是否被淘汰,但这些都是通过观测结果来判断NOB是否被淘汰,并未深入研究导致NOB淘汰根本原因. YANG等[43]发现,NOB原位活性远远低于异位最大活性. 这表明在特定环境中NOB活性下降,使得无法获取维持自身活动的能量,从而导致NOB淘汰. Hausherr等[44]指出,PN的成功启动主要依靠NOB失活,但是NOB失活机制尚不清晰. 这都表明,NOB淘汰主要是由于原位活性降低所致.
尽管如此,NOB可以通过优势种群的转变逐渐适应特殊环境,这将导致PN崩溃[39]. 这说明,NOB优势种群转变前由于特殊外界环境使得NOB活性下降从而逐步淘汰,然而当NOB优势菌种发生变化后,新NOB种群可以适应特殊环境,使得NOB活性上升,从而导致NOB过量增殖,最终导致PN崩溃. 因此,NOB淘汰的根本原因是NOB菌种无法适应特殊环境,从而导致原位活性下降,造成AOM与NOB产生活性差,从而引起NOB淘汰.
-
硝化过程分为两步,分别是由AOM主导的氨氧化过程及由NOB主导的亚硝酸盐氧化过程. 2006年Coast等[45]依据热力学及动力学理论,大胆预测了可能存在可将氨氮氧化为硝态氮的全程氨氧化细菌(Comammox)的存在. 2015年,Daims等[46]及van Kessel等[47]才成功的从不同环境中富集了Comammox,证明了它的存在. Comammox的存在极大程度冲击了人们对于生物脱氮的传统观念. Palomo等[48]依据amoA基因序列,将Comammox划分为clade A型和clade B型.
Comammox具有高氨氮亲和力和低亚硝态氮亲和力的特点. 但是由于富集的Comammox菌群较少,暂无文献报道Comammox的氧亲和力. Comammox中存在高氧亲和力的bd型末端氧化酶[48]且Paul等[49]通过控制反应器DO浓度(<1 mg·L−1),从而实现Comammox的富集. 这说明,在低DO环境中,PN的破坏可能是由于Comammox的富集. 由于这些发现,有研究者认为在高DO条件下,Comammox可能不能在与传统AOB的竞争中胜出. 然而随着研究的不断深入,Beach等发现[50]在低DO环境中有些Comammox有较高的丰度,但是也有些Comammox丰度较低. 2020年,Sakoula等[51]在50%氧饱和度的条件下获得了一株全新的Comammox富集体,并命名为Ca. N. kreftii. 这些都说明不同的DO环境中的Comammox种类可能不同,且不同种类Comammox的特性也可能不同.
Comammox具备硝化关键功能酶 (AMO ,HAO 和NXR)的完整基因组[46 − 47],故其可以在单个细菌中将氨氮转化为硝态氮. 但是除硝化作用外,Comammox的基因组有编码亚硝酸盐还原酶基因(nir)而缺少一氧化氮还原酶基因(nor),理论上可在好氧或缺氧环境中产生NO,但是不能通过生物途径产生N2O[52]. 因此在低DO环境中,Comammox为优势菌种的硝化污泥N2O生成量较AOB为优势菌种的硝化污泥大幅下降.
-
在实际运行工艺中,控制DO对启动及维持PN有重要影响,基于DO控制方法实现PN启动及稳定运行是最为便利的方法,以下将通过几种不同基于控制DO的策略来说明控制DO在实际应用方面对PN的影响.
-
低DO条件能有效提高氧传质效果[53],减少能源消耗,可推动污水处理向节能绿色方向发展. 在低DO条件下,维持AOB活性的同时选择性抑制NOB,从而实现PN的启动[54]. 对于在低DO环境中成功启动PN的原因,普遍认为是NOB的淘汰,但是对于NOB淘汰的原因暂无统一观点.
低DO环境中污泥中AOB的氧半饱和常数(
$K_{{\mathrm{O}}_2} $ )一般低于NOB[55],使得AOB优先利用环境中不多的氧气,使得NOB难以获取足够的氧气维持自身的生长所需[56],导致活性污泥中NOB数量不断下降,亚硝酸盐氧化速率不断下降,从而实现短程硝化. 在低DO条件下,NOB的活性与适宜条件下相比有大幅下降[57]. 也有研究者发现,运用其他工艺可以在反应器中构造一个低DO环境,从而利用低DO环境特点更好的运行PN. Huang等[40]指出,利用低强度超声波可以增强AOB活性,并产生一个低DO环境,这有利于提升PN的运行效率. 刘若男等[58]指出,在微氧条件下控制曝气可提升微生物燃料电池脱氮效率. 这说明,利用低DO环境的特点与其他工艺联合可以有效的运行PN.在低DO环境中可以实现PN的启动,但是在长期运行中,NOB可以通过优势种群的转化来适应环境,从而使得NOB活性上升,导致PN崩溃[39, 53]. 通过菌种分析得知,由于活性污泥中的NOB优势种群由Nitrobacter(高
$K_{{\mathrm{O}}_2} $ )转变为Nitrospira(低$K_{{\mathrm{O}}_2} $ ),使得NOB重新获得较多的氧气,亚硝酸氧化速率上升. 在低DO条件长期运行中,转变后NOB 的$K_{{\mathrm{O}}_2} $ 与AOB相近,使得短程硝化变为全程硝化[29]. 这表示单凭低DO即使实现PN也难以长期稳定运行.在低DO条件下,当AOB获取O2困难时,会进行反硝化,从而产生温室气体N2O. 且该研究表示,反硝化对AOB的能量代谢无关紧要,但在高氨氮浓度下,反硝化可能是电子耗散的重要途径[8]. 随着DO升高,AOB产生的N2O将会减少,并且溶解氧的改变会影响短程硝化过程N2O的产生途径[59].
-
随着研究的不断深入,许多研究者发现在低DO环境中,AOB的
$K_{{\mathrm{O}}_2} $ 不一定低于NOB(见表1),因此在低DO环境中可能无法正常启动PN,并且低DO条件下运行短程硝化工艺,即使成功启动了,在长期运行中,也会由于NOB的优势种群的转变导致短程硝化的破坏[39],而低DO条件也可能使得AOB产生较多的N2O,对此研究者开发了其它启动并维持PN的技术.在低DO环境中实现PN,是基于同时降低AOB与NOB的活性的基础上[60 − 61],因为AOB对氧气的竞争力高于NOB,促使双方发生竞争从而使得NOB淘汰. 但是低DO仍然在一定程度上降低了氨氧化速率,基于此在高DO环境中能否启动PN成为了研究的新方向. 杨庆等[62]指出在高DO条件下长期运行,AOB的
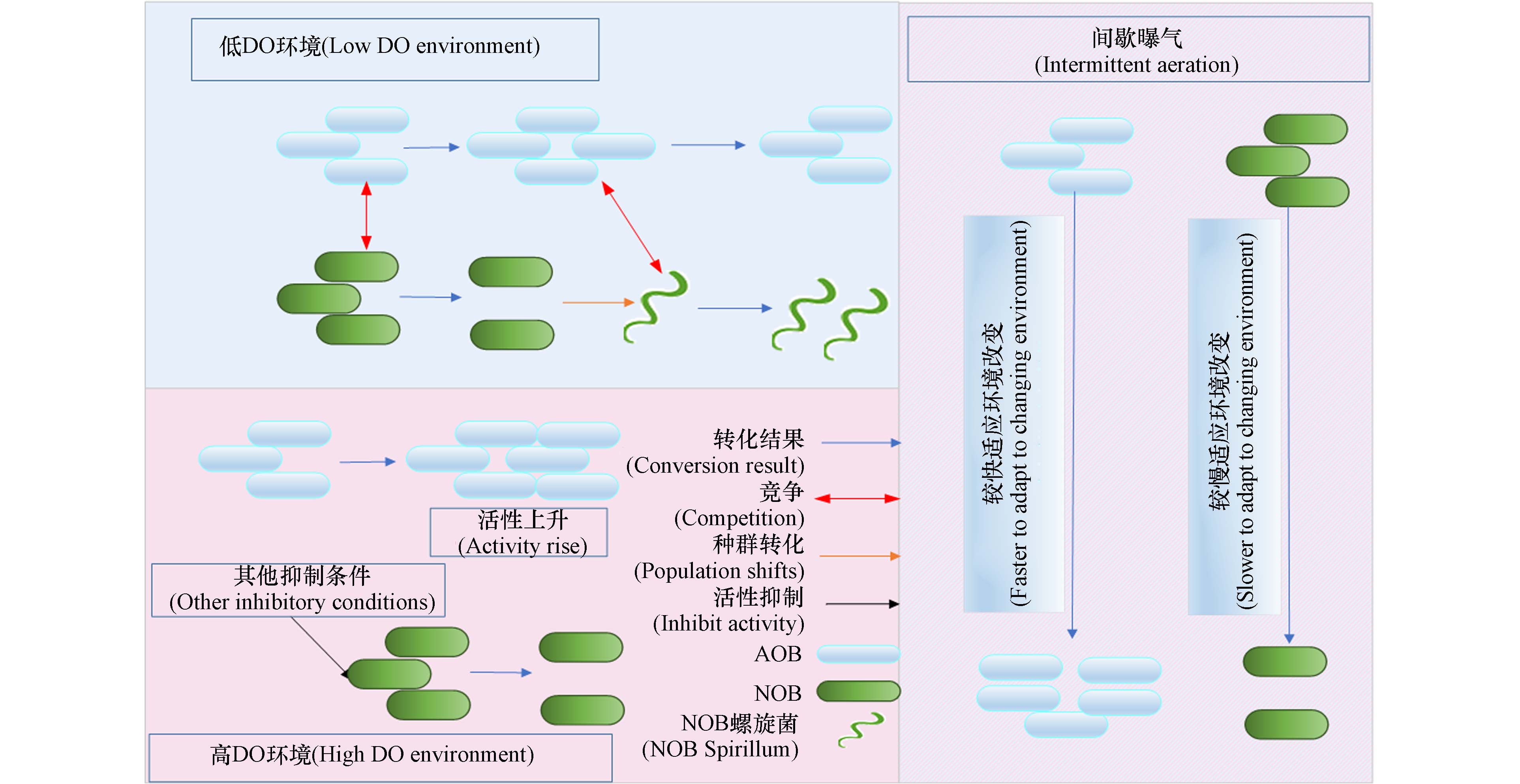
$K_{{\mathrm{O}}_2} $ ((0.064±0.008)mg·L−1,按O2计算)远低于在低DO条件下培养的AOB的$K_{{\mathrm{O}}_2} $ ((0.281±0.026) mg·L−1 按O2计算). 这说明在高DO条件下,培养的AOB的氧亲和力更高,AOB更具有活性. Jiang等[63]在高DO条件下成功实现了AOB活性的上升及NOB活性的抑制. 这表明,在高DO环境中,只要控制好外界环境完全可以较好的启动PN乃至PN的稳定运行,这打破了PN只能通过低DO启动的局限. 图2展示了低DO、高DO、间歇曝气等3种不同的工艺启动PN的原因.针对高DO环境中运行PN的特性,研究者进行了许多的研究. Cui等[32]控制接种污泥运行条件等外界因素,在两个不同的DO条件下运行PN,探究DO浓度对短程硝化长期运行的影响. 在低DO条件下(0.5 mg·L−1),短程硝化性能在运行周期为100左右就开始破坏,到130周期就基本转为全程硝化. 而在高DO条件下,短程硝化性能得到良好的维持. 这说明高DO对于PN稳定运行有一定的优势之处. 杨庆等[29]指出,同种污泥在不同DO环境中运行PN,高DO比低DO运行更加稳定. 综上所述,高DO下运行PN,有利于维持PN的稳定. 高DO浓度,由于AOB更快适应高DO环境,使得NOB在氧气竞争时处在劣势从而导致污泥中的AOB大量增殖,NOB被快速淘洗[64]. 且在高DO环境中,对于 AOB,该环境将导致其活性上升使得氨氧化速率维持在较高的水准,对于NOB来说,Nitrobacter更占生长优势,使得Nitrospira难以获取优势种群地位,可能Nitrospira不在占据生长优势,是实现及维持PN的一个重要原因[29].
但高曝气将导致水厂运行费用上升,难以成为主流手段,且在高DO环境中,将会使得PN难以与厌氧氨氧化及反硝化一体化耦合脱氮,高DO将会使一体化PNA系统崩溃[65]. 因此需要研究一种节能环保能稳定运行PN的新工艺.
-
高DO工艺,虽然可以有效的运行短程硝化,但是由于维持高DO条件将会使得运行成本上升,与研究短程硝化的初衷不符. 由于上述两种工艺的缺陷,并且随着间歇曝气工艺可以有效的抑制NOB[66- 67]这一特性被发现,间歇曝气启动及维持PN受到众多研究者的青睐.
间歇曝气模式,从本质上说就是人为的在一个反应器在不同的时间与空间中营造出不同的DO分区,利用AOM,NOB的特性,实现AOM的增殖与NOB的抑制,间歇曝气模式可以很好地启动PN [68]. 探究其可以成功启动PN的原因,可归功于其特殊的DO分区,在这种特殊的DO分区中,AOB有 “饱食饥饿”特性,可以在DO浓度发生显著变化之后,迅速适应外界环境的变化,而 NOB 难以及时适应DO环境的剧烈变化,使得其逐渐被淘汰[69 − 70]. Xie等[34]发现,间歇曝气有利于AOA的生长. 这说明AOM都可以较好的适应间歇曝气模式,而NOB活性会被抑制,从而实现PN. 蒋轶锋等[71]发现,AOB可以在间歇曝气工艺中提高其产率系数(Y)使得其比增殖速率(μ)及氨氮氧化速率保持相对稳定,而NOB并不具备这一特性,使得NOB的比增殖速率以及亚硝酸盐氧化速率下降. 这是间歇曝气可以成功启动PN的直接原因. Xu等[72]发现,曝气期DO浓度和缺氧期持续时间对NOB的抑制有显著影响,低DO浓度(0.5 mg·L−1)对NOB的抑制作用强于高DO浓度(1.5 — 1.8 mg·L−1). 这说明,在间歇曝气工艺中曝气段DO浓度会极大地影响其对PN的启动及维持作用. Kornaros等[73]表明,NOB在间歇曝气中,由于DO的显著变化引起NOB活性地缓慢恢复,是由于控制NOB生长的关键酶在缺氧段失活,而在好氧段重新激活较为缓慢,从而使得NOB的最大比增长速率下降.
间歇曝气模式除了可以启动PN外还有其他优点. 刘宏等[74]发现,利用间歇曝气模式可以在PN崩溃后,较好的实现PN的恢复. 这说明间歇曝气模式可以有效的恢复AOB活性,并且控制好外界条件还可以有效抑制NOB活性. Sun等[75]发现,间歇曝气模式通过控制曝气时间和DO浓度可以提高氮去除率. 间歇曝气模式中还有一些特性未进行深入探究,如间歇曝气模式中的N2O排放主要集中在好氧区间且排放特征尚未清晰,需要研究者进一步探究.
-
PN启动工艺及破坏条件繁多,但其根本原因是在反应器中多种微生物相互作用下功能菌电子耗散途径及相关酶活性发生变化. O2作为脱氮过程中的重要参与者,在不同的DO环境中细菌电子耗散途径及相关酶活性有着显著差异,可利用此差异实现PN的启动及稳定运行.
低DO环境中,AOB因缺乏电子受体导致其电子耗散途径及相关酶活性变化,使其进行反硝化产生N2O,且由于
$K_{\mathrm{O}_2} $ 不同导致NOB抑制、AOA代替AOB优势地位等变化,可能发生NOB优势种群转化导致PN崩溃. 高DO环境中,AOB活性上升使得脱氮效率上升,此时可通过其他方式抑制NOB实现PN启动,其优势为PN可以长期稳定运行,但其曝气成本较高. 间歇曝气模式一定程度上综合以上两种工艺优势,利用AOB较快适应DO变化特性实现PN启动,但其参数设置对其效果有较大影响且暂无明确参数设计理论. Comammox的发现极大的冲击了传统硝化脱氮观念,但是对Comammox对硝化过程的影响特别是对PN过程的影响暂时没有进行较为深入的探究. Comammox虽然能将NH4+-N转化为NO3−-N,但是在不同DO环境中其电子耗散途径及相关酶活性是否发生变化从而导致其可帮助PN的启动及稳定运行,需要研究者进行深入的研究. 本文结合在不同DO环境中细菌电子耗散途径及酶活性变化的系统分析,提出未来可行的研究方向包括:1)PN的启动是通过营造AOM与NOB之间的活性差来实现,且NOB的活性下降主要归功于NOB的原位活性下降,但是对于NOB的失活机制暂无一个较为清晰的理论说明. 可从不同DO环境中NOB的电子耗散途径及相关酶活性的变化角度,来探究NOB的失活机制.
2)间歇曝气模式从本质看就是在一个反应器内营造DO分区,因此可从DO角度探究在不同DO环境及DO转变过程中,反应器内部功能菌电子耗散途径及酶活性的变化,从电子耗散及酶活性角度探究DO变化对PN启动及维持的作用,并以此为基础建立间歇曝气的参数选取方法.
溶解氧对短程硝化影响研究进展
Research progress and application of the effect of dissolved oxygen on partial nitrification
-
摘要: 短程硝化作为全程自养脱氮、短程硝化耦合反硝化除磷等新型脱氮工艺的关键步骤,是实现高效生物脱氮的重要环节. 通过控制溶解氧浓度启动及维持短程硝化具有广阔的工程应用前景,但溶解氧对短程硝化的影响机制具有争议性,已成为了制约其工程化应用的瓶颈. 论文综述了溶解氧对不同微生物的影响,着重论述了不同溶解氧下氨氧化细菌酶活性与生化反应的关联性,指出溶解氧变化使得亚硝酸盐氧化菌失活是其产生竞争性淘汰的根本原因,并分析了溶解氧变化对全程氨氧化菌的影响,从而揭示控制溶解氧工艺可以成功启动短程硝化的原因,并归纳总结了低溶解氧、高溶解氧、间歇曝气三种模式下短程硝化工艺的控制策略,旨在为溶解氧控制短程硝化的启动及稳定化运行提供参考.Abstract: Partial nitrification, as a key step of new nitrogen removal processes such as whole-process autotrophic nitrogen removal and partial nitrification coupled with denitrifying phosphorus removal, is an important link to achieve efficient biological nitrogen removal. Starting and maintaining partial nitrification by controlling the concentration of dissolved oxygen has a broad engineering application prospect, but the mechanism of the effect of dissolved oxygen on partial nitrification is controversial, which has become a bottleneck restricting its engineering application. This paper reviews the effects of dissolved oxygen on different microorganisms, focuses on the correlation between enzyme activity and biochemical reaction of ammonia-oxidizing bacteria under different dissolved oxygen, points out that the change of dissolved oxygen inactivation of nitrite oxidizing bacteria is the fundamental reason for their competitive elimination, and analyzes the influence of dissolved oxygen change on the whole ammonia-oxidizing bacteria. In this paper, the reasons for the successful initiation of short-range nitrification by controlled dissolved oxygen process were revealed, and the control strategies of partial nitrification process under three modes of low dissolved oxygen, high dissolved oxygen and intermittent aeration were summarized, aiming to provide reference for the start-up and stabilization of partial nitrification controlled by dissolved oxygen.
-

-
表 1 AOB,NOB,AOA氧半饱合常数
Table 1. AOB, NOB, AOA Oxygen half-saturation constant
外界条件
External condition细菌种类
Bacterial species氧半饱和常数 $K_{{\mathrm{O}}_2} $
Oxygen half-saturation constant文献
References反应器
ReactorDO/(mg·L−1) AOB NOB AOA 生物滤池 0.2—1.5 — 0.106±001 — — [27] SBR反应器 0.6—5 — 0.22±0.09—0.67±0.12 0.03±0.02—0.45±0.02 — [28] SBR反应器 0.5±0.1 Nitrospira(NOB) 0.28±0.026 0.28±0.035 — [29] 2.5±0.5 0.064±0.008 — 连续流反应器 0.4 Nitrosomonas(AOB),
Nitrobacter(NOB)0.033±0.003 0.43±0.08 — [30] AAO反应器 0.5 Nitrosomonas and Nitrosomonadaceae (AOB),
Nitrospira and Nitrobacter (NOB)0.29 ± 0.04 0.09 ± 0.01 — [31] 2 0.39 ± 0.05 0.29 ± 0.03 SBR反应器 0.5 Nitrosomonas(AOB),
Nitrospira(NOB)0.28 0.085 — [32] 2.5 0.489 0.296 血清瓶 — DW(AOA) — — 0.0928 ±0.016[33] AC2(AOA) 0.0928 ±0.0416 N.viennensis(AOA) 0.0896 ±0.0448 血清瓶 — Nitrosocosmicus(AOA) — — 0.1312 ±0.08[34] 血清瓶 — SCM1(AOA) — — 0.10912 ±0.000416 [35] PS0(AOA) — — 0.03776 ±0.00048 -
[1] NSENGA KUMWIMBA M, LOTTI T, ŞENEL E, et al. Anammox-based processes: How far have we come and what work remains? A review by bibliometric analysis[J]. Chemosphere, 2020, 238: 124627. doi: 10.1016/j.chemosphere.2019.124627 [2] JIANG H, YANG P, WANG Z, et al. Novel insights into overcoming nitrite oxidation bacteria acclimatization problem in treatment of high-ammonia wastewater through partial nitrification[J]. Bioresource Technology, 2021, 336: 125254. doi: 10.1016/j.biortech.2021.125254 [3] LIU Y C, ZHU Y L, WU D S, et al. Effect of free nitrous acid on nitritation process: Microbial community, inhibitory kinetics, and functional biomarker[J]. Bioresource Technology, 2023, 371: 128595. doi: 10.1016/j.biortech.2023.128595 [4] ZHANG W K, YU D S, ZHANG J H, et al. Start-up of mainstream anammox process through inoculating nitrification sludge and anammox biofilm: Shift in nitrogen transformation and microorganisms[J]. Bioresource Technology, 2022, 347: 126728. doi: 10.1016/j.biortech.2022.126728 [5] WANG H, YANG M, LIU K, et al. Insights into the synergy between functional microbes and dissolved oxygen partition in the single-stage partial nitritation-anammox granules system[J]. Bioresource Technology, 2022, 347: 126364. doi: 10.1016/j.biortech.2021.126364 [6] CARANTO J D, LANCASTER K M. Nitric oxide is an obligate bacterial nitrification intermediate produced by hydroxylamine oxidoreductase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(31): 8217-8222. [7] LANCASTER K M, CARANTO J D, MAJER S H, et al. Alternative bioenergy: Updates to and challenges in nitrification metalloenzymology[J]. Joule, 2018, 2(3): 421-441. doi: 10.1016/j.joule.2018.01.018 [8] STEIN L Y. Insights into the physiology of ammonia-oxidizing microorganisms[J]. Current Opinion in Chemical Biology, 2019, 49: 9-15. doi: 10.1016/j.cbpa.2018.09.003 [9] SOLER-JOFRA A, PÉREZ J, van LOOSDRECHT M C M. Hydroxylamine and the nitrogen cycle: A review[J]. Water Research, 2021, 190: 116723. doi: 10.1016/j.watres.2020.116723 [10] SUZUKI I, DULAR U, KWOK S C. Ammonia or ammonium ion as substrate for oxidation by Nitrosomonas europaea cells and extracts[J]. Journal of bacteriology, 1974, 120(1): 556-558. doi: 10.1128/jb.120.1.556-558.1974 [11] 彭永臻, 孙洪伟, 杨庆. 短程硝化的生化机理及其动力学[J]. 环境科学学报, 2008, 28(5): 817-824. PENG Y Z, SUN H W, YANG Q. The biochemical reaction mechanism and kinetics of partial nitrification[J]. Acta Scientiae Circumstantiae, 2008, 28(5): 817-824 (in Chinese).
[12] YU R, KAMPSCHREUR M J, van LOOSDRECHT M C M, et al. Mechanisms and specific directionality of autotrophic nitrous oxide and nitric oxide generation during transient anoxia[J]. Environmental Science & Technology, 2010, 44(4): 1313-1319. [13] NI B J, PENG L, LAW Y, et al. Modeling of nitrous oxide production by autotrophic ammonia-oxidizing bacteria with multiple production pathways[J]. Environmental Science & Technology, 2014, 48(7): 3916-3924. [14] HINK L, LYCUS P, GUBRY-RANGIN C, et al. Kinetics of NH3-oxidation, NO-turnover, N2O-production and electron flow during oxygen depletion in model bacterial and archaeal ammonia oxidisers[J]. Environmental Microbiology, 2017, 19(12): 4882-4896. doi: 10.1111/1462-2920.13914 [15] VENTER J C, REMINGTON K, HEIDELBERG J F, et al. Environmental Genome Shotgun Sequencing of the Sargasso Sea[J]. Science, 2004, 304(5667): 66-74. doi: 10.1126/science.1093857 [16] KÖNNEKE M, BERNHARD A E, deLa TORRE J R, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J]. Nature, 2005, 437: 543-546. doi: 10.1038/nature03911 [17] CAFFREY J M, BANO N, KALANETRA K, et al. Ammonia oxidation and ammonia-oxidizing bacteria and Archaea from estuaries with differing histories of hypoxia[J]. The ISME Journal, 2007, 1(7): 660-662. doi: 10.1038/ismej.2007.79 [18] YANG Y C, HERBOLD C W, JUNG M-Y, et al. Survival strategies of ammonia-oxidizing Archaea (AOA) in a full-scale WWTP treating mixed landfill leachate containing copper ions and operating at low-intensity of aeration[J]. Water Research, 2021, 191: 116798. doi: 10.1016/j.watres.2020.116798 [19] LIU L T, LI S R, HAN J M, et al. A two-step strategy for the rapid enrichment of Nitrosocosmicus-like ammonia-oxidizing thaumarchaea[J]. Frontiers in Microbiology, 2019, 10: 875. doi: 10.3389/fmicb.2019.00875 [20] JIANG Z, TANG S Y, LIAO Y H, et al. Effect of low temperature on contributions of ammonia oxidizing archaea and bacteria to nitrous oxide in constructed wetlands[J]. Chemosphere, 2023, 313: 137585. doi: 10.1016/j.chemosphere.2022.137585 [21] AL-AJEEL S, SPASOV E, SAUDER L A, et al. Ammonia-oxidizing archaea and complete ammonia-oxidizing Nitrospira in water treatment systems[J]. Water Research X, 2022, 15: 100131. doi: 10.1016/j.wroa.2022.100131 [22] PARK J-G, LEE B, HEO T-Y, et al. Metagenomics approach and canonical correspondence analysis of novel nitrifiers and ammonia-oxidizing archaea in full scale anaerobic-anoxic-oxic (A2/O) and oxidation ditch processes[J]. Bioresource Technology, 2021, 319: 124205. doi: 10.1016/j.biortech.2020.124205 [23] WU L, CHEN X M, WEI W, et al. A critical review on nitrous oxide production by ammonia-oxidizing Archaea[J]. Environmental Science & Technology, 2020, 54(15): 9175-9190. [24] REIGSTAD L J, RICHTER A, DAIMS H, et al. Nitrification in terrestrial hot springs of Iceland and Kamchatka[J]. FEMS Microbiology Ecology, 2008, 64(2): 167-174. doi: 10.1111/j.1574-6941.2008.00466.x [25] ZHANG C L, YE Q, HUANG Z Y, et al. Global occurrence of archaeal amoA genes in terrestrial hot springs[J]. Applied and Environmental Microbiology, 2008, 74(20): 6417-6426. doi: 10.1128/AEM.00843-08 [26] ZHAO W H, BI X J, BAI M, et al. Research advances of ammonia oxidation microorganisms in wastewater: Metabolic characteristics, microbial community, influencing factors and process applications[J]. Bioprocess and Biosystems Engineering, 2023, 46(5): 621-633. doi: 10.1007/s00449-023-02866-5 [27] 武文君, 刘秀红, 崔斌, 等. 溶解氧对Anammox滤池内功能菌群及活性的影响[J]. 中国环境科学, 2021, 41(3): 1415-1421. WU W J, LIU X H, CUI B, et al. Effect of dissolved oxygen on the community and activities of functional bacteria in anammox biofilter[J]. China Environmental Science, 2021, 41(3): 1415-1421 (in Chinese).
[28] 吴军, 张悦, 徐婷, 等. AOB溶解氧亲和力低于NOB条件下序批反应器中NOB淘汰的实现机制[J]. 中国环境科学, 2016, 36(12): 3583-3590. WU J, ZHANG Y, XU T, et al. Mechanisms of partial nitrification in sequencing batch reactor under the condition of AOB oxygen affinity lower than NOB[J]. China Environmental Science, 2016, 36(12): 3583-3590 (in Chinese).
[29] 杨庆, 杨玉兵, 杨忠启, 等. 溶解氧对短程硝化稳定性及功能菌群的影响[J]. 中国环境科学, 2018, 38(9): 3328-3334. YANG Q, YANG Y B, YANG Z Q, et al. Effect of dissolved oxygen on the stability and functional microbial communities of the partial nitrification[J]. China Environmental Science, 2018, 38(9): 3328-3334 (in Chinese).
[30] BLACKBURNE R, YUAN Z G, KELLER J. Partial nitrification to nitrite using low dissolved oxygen concentration as the main selection factor[J]. Biodegradation, 2008, 19(2): 303-312. doi: 10.1007/s10532-007-9136-4 [31] WANG L, LI B R, LI Y M, et al. Enhanced biological nitrogen removal under low dissolved oxygen in an anaerobic-anoxic-oxic system: Kinetics, stoichiometry and microbial community[J]. Chemosphere, 2021, 263: 128184. doi: 10.1016/j.chemosphere.2020.128184 [32] CUI B, YANG Q, LIU X H, et al. The effect of dissolved oxygen concentration on long-term stability of partial nitrification process[J]. Journal of Environmental Sciences, 2020, 90: 343-351. doi: 10.1016/j.jes.2019.12.012 [33] STRAKA L L, MEINHARDT K A, BOLLMANN A, et al. Affinity informs environmental cooperation between ammonia-oxidizing Archaea (AOA) and anaerobic ammonia-oxidizing (Anammox) bacteria[J]. The ISME Journal, 2019, 13(8): 1997-2004. doi: 10.1038/s41396-019-0408-x [34] XIE J H, YAN J, HE H X, et al. Evaluation of the key factors to dominate aerobic ammonia-oxidizing Archaea in wastewater treatment plant[J]. International Biodeterioration & Biodegradation, 2021, 164: 105289. [35] QIN W, MEINHARDT K A, MOFFETT J W, et al. Influence of oxygen availability on the activities of ammonia-oxidizing Archaea[J]. Environmental Microbiology Reports, 2017, 9(3): 250-256. doi: 10.1111/1758-2229.12525 [36] ROY D, McEVOY J, BLONIGEN M, et al. Seasonal variation and ex-situ nitrification activity of ammonia oxidizing Archaea in biofilm based wastewater treatment processes[J]. Bioresource Technology, 2017, 244: 850-859. doi: 10.1016/j.biortech.2017.08.060 [37] TRIMMER M, CHRONOPOULOU P M, MAANOJA S T, et al. Nitrous oxide as a function of oxygen and archaeal gene abundance in the North Pacific[J]. Nature Communications, 2016, 7: 13451. doi: 10.1038/ncomms13451 [38] FRAME C H, LAU E, NOLAN E J 4th, et al. Acidification enhances hybrid N2O production associated with aquatic ammonia-oxidizing microorganisms[J]. Frontiers in Microbiology, 2017, 7: 2104. [39] WANG Z Y, ZHENG M, HU Z T, et al. Unravelling adaptation of nitrite-oxidizing bacteria in mainstream PN/a process: Mechanisms and counter-strategies[J]. Water Research, 2021, 200: 117239. doi: 10.1016/j.watres.2021.117239 [40] HUANG S C, ZHU Y C, ZHANG G M, et al. Effects of low-intensity ultrasound on nitrite accumulation and microbial characteristics during partial nitrification[J]. Science of the Total Environment, 2020, 705: 135985. doi: 10.1016/j.scitotenv.2019.135985 [41] LIU W L, YANG Q, MA B, et al. Rapid achievement of nitritation using aerobic starvation[J]. Environmental Science & Technology, 2017, 51(7): 4001-4008. [42] WANG Z Y, ZHENG M, DUAN H R, et al. A 20-year journey of partial nitritation and anammox (PN/a): From sidestream toward mainstream[J]. Environmental Science & Technology, 2022, 56(12): 7522-7531. [43] YANG Y D, JIANG Y M, LONG Y N, et al. Insights into the mechanism of the deterioration of mainstream partial nitritation/anammox under low residual ammonium[J]. Journal of Environmental Sciences, 2023, 126: 29-39. doi: 10.1016/j.jes.2022.04.005 [44] HAUSHERR D, NIEDERDORFER R, BÜRGMANN H, et al. Successful mainstream nitritation through NOB inactivation[J]. Science of the Total Environment, 2022, 822: 153546. doi: 10.1016/j.scitotenv.2022.153546 [45] COSTA E, PÉREZ J, KREFT J U. Why is metabolic labour divided in nitrification?[J]. Trends in Microbiology, 2006, 14(5): 213-219. doi: 10.1016/j.tim.2006.03.006 [46] DAIMS H, LEBEDEVA E V, PJEVAC P, et al. Complete nitrification by Nitrospira bacteria[J]. Nature, 2015, 528: 504-509. doi: 10.1038/nature16461 [47] van KESSEL M A H J, SPETH D R, ALBERTSEN M, et al. Complete nitrification by a single microorganism[J]. Nature, 2015, 528: 555-559. doi: 10.1038/nature16459 [48] PALOMO A, PEDERSEN A G, FOWLER S J, et al. Comparative genomics sheds light on niche differentiation and the evolutionary history of comammox Nitrospira[J]. The ISME Journal, 2018, 12(7): 1779-1793. doi: 10.1038/s41396-018-0083-3 [49] ROOTS P, WANG Y B, ROSENTHAL A F, et al. Comammox Nitrospira are the dominant ammonia oxidizers in a mainstream low dissolved oxygen nitrification reactor[J]. Water Research, 2019, 157: 396-405. doi: 10.1016/j.watres.2019.03.060 [50] BEACH N K, NOGUERA D R. Design and assessment of species-level qPCR primers targeting comammox[J]. Frontiers in Microbiology, 2019, 10: 36. doi: 10.3389/fmicb.2019.00036 [51] SAKOULA D, KOCH H, FRANK J, et al. Enrichment and physiological characterization of a novel comammox Nitrospira indicates ammonium inhibition of complete nitrification[J]. The ISME Journal, 2021, 15: 1010-1024. doi: 10.1038/s41396-020-00827-4 [52] KITS K D, JUNG M Y, VIERHEILIG J, et al. Low yield and abiotic origin of N2O formed by the complete nitrifier Nitrospira inopinata[J]. Nature Communications, 2019, 10: 1836. doi: 10.1038/s41467-019-09790-x [53] LIU G Q, WANG J M. Long-term low DO enriches and shifts nitrifier community in activated sludge[J]. Environmental Science & Technology, 2013, 47(10): 5109-5117. [54] HANAKI K, WANTAWIN C, OHGAKI S. Nitrification at low levels of dissolved oxygen with and without organic loading in a suspended-growth reactor[J]. Water Research, 1990, 24(3): 297-302. doi: 10.1016/0043-1354(90)90004-P [55] MA Y, PENG Y Z, WANG S Y, et al. Achieving nitrogen removal via nitrite in a pilot-scale continuous pre-denitrification plant[J]. Water Research, 2009, 43(3): 563-572. doi: 10.1016/j.watres.2008.08.025 [56] 杜贺, 李冬, 周川, 等. 控制低溶解氧实现亚硝化的稳定性[J]. 环境科学, 2010, 31(10): 2365-2369. DU H, LI D, ZHOU C, et al. Achieving the stability of nitrosation under low DO concentration[J]. Environmental Science, 2010, 31(10): 2365-2369 (in Chinese).
[57] ZHENG M, LI H J, DUAN H R, et al. One-year stable pilot-scale operation demonstrates high flexibility of mainstream anammox application[J]. Water Research X, 2023, 19: 100166. doi: 10.1016/j.wroa.2023.100166 [58] 刘若男, 赵博玮, 岳秀萍. 曝气量对微生物燃料电池脱氮的影响[J]. 环境化学, 2018, 37(6): 1317-1326. doi: 10.7524/j.issn.0254-6108.2017091001 LIU R N, ZHAO B W, YUE X P. Effect of aeration rate on nitrogen removal by microbial fuel cells[J]. Environmental Chemistry, 2018, 37(6): 1317-1326 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017091001
[59] 杨玉兵, 杨庆, 李洋, 等. 基于同位素技术的短程硝化过程N2O产生途径[J]. 环境科学, 2018, 39(11): 5051-5057. YANG Y B, YANG Q, LI Y, et al. N2O production pathways in partial nitrification based on isotope technology[J]. Environmental Science, 2018, 39(11): 5051-5057 (in Chinese).
[60] LU J, ZHANG Y X, WU J, et al. Nitrogen removal in recirculating aquaculture water with high dissolved oxygen conditions using the simultaneous partial nitrification, anammox and denitrification system[J]. Bioresource Technology, 2020, 305: 123037. doi: 10.1016/j.biortech.2020.123037 [61] CHEN Z G, WANG X J, CHEN X Z, et al. Nitrogen removal via nitritation pathway for low-strength ammonium wastewater by adsorption, biological desorption and denitrification[J]. Bioresource Technology, 2018, 267: 541-549. doi: 10.1016/j.biortech.2018.07.084 [62] 杨庆, 杨玉兵, 刘秀红, 等. 不同溶解氧环境下氨氧化菌的氧半饱和常数比较[J]. 中国给水排水, 2017, 33(23): 22-26. YANG Q, YANG Y B, LIU X H, et al. Oxygen half-saturation constants of ammonia oxidizing bacteria (AOB) in nitrification sludge under different dissolved oxygen[J]. China Water & Wastewater, 2017, 33(23): 22-26 (in Chinese).
[63] JIANG H, PENG Y Z, LI X Y, et al. Advanced nitrogen removal from mature landfill leachate via partial nitrification-Anammox biofilm reactor (PNABR) driven by high dissolved oxygen (DO): Protection mechanism of aerobic biofilm[J]. Bioresource Technology, 2020, 306: 123119. doi: 10.1016/j.biortech.2020.123119 [64] CUI H H, ZHANG L, PENG Y Z, et al. Achieving stable nitritation for mainstream anammox by combining nitrite exposure inhibition with high DO reactivation[J]. Journal of Water Process Engineering, 2022, 46: 102589. doi: 10.1016/j.jwpe.2022.102589 [65] WANG H, GONG H, DAI X H, et al. Metagenomics reveals the microbial community and functional metabolism variation in the partial nitritation-anammox process: From collapse to recovery[J]. Journal of Environmental Sciences, 2024, 135: 210-221. doi: 10.1016/j.jes.2023.01.002 [66] MA Y J, PISCEDDA A, deLa C VERAS A, et al. Intermittent aeration to regulate microbial activities in membrane-aerated biofilm reactors: Energy-efficient nitrogen removal and low nitrous oxide emission[J]. Chemical Engineering Journal, 2022, 433: 133630. doi: 10.1016/j.cej.2021.133630 [67] LI J P, ELLIOTT D, NIELSEN M, et al. Long-term partial nitrification in an intermittently aerated sequencing batch reactor (SBR) treating ammonium-rich wastewater under controlled oxygen-limited conditions[J]. Biochemical Engineering Journal, 2011, 55(3): 215-222. doi: 10.1016/j.bej.2011.05.002 [68] HASSAN M O, GANI K M, KUMARI S, et al. Start-up of partial nitrification by intermittent aeration, pH shocks and sulfide addition in a sequential batch reactor[J]. Journal of Chemical Technology & Biotechnology, 2022, 97(8): 2186-2195. [69] 周梦雨, 彭党聪, 韩芸, 等. 间歇曝气对部分硝化-厌氧氨氧化处理氨氮废水的影响[J]. 中国环境科学, 2022, 42(3): 1120-1127. ZHOU M Y, PENG D C, HAN Y, et al. Partial nitrification-anaerobic ammonia oxidation for the treatment of moderately concentrated ammonia-nitrogen wastewater: Effect of intermittent aeration on nitrogen removal performance[J]. China Environmental Science, 2022, 42(3): 1120-1127 (in Chinese).
[70] 曾薇, 张悦, 李磊, 等. 生活污水常温处理系统中AOB与NOB竞争优势的调控[J]. 环境科学, 2009, 30(5): 1430-1436. ZENG W, ZHANG Y, LI L, et al. Competition and optimization of AOB and NOB for domestic wastewater treatment at normal temperatures[J]. Environmental Science, 2009, 30(5): 1430-1436 (in Chinese).
[71] 蒋轶锋, 陈浚, 王宝贞, 等. 间歇曝气对硝化菌生长动力学影响及NO2-积累机制[J]. 环境科学, 2009, 30(1): 85-90. JIANG Y F, CHEN J, WANG B Z, et al. Effect of intermittent aeration on growth kinetics of nitrifiers and mechanism for NO2- accumulation[J]. Environmental Science, 2009, 30(1): 85-90 (in Chinese) .
[72] XU Z Z, ZHANG L, GAO X J, et al. Optimization of the intermittent aeration to improve the stability and flexibility of a mainstream hybrid partial nitrification-anammox system[J]. Chemosphere, 2020, 261: 127670. doi: 10.1016/j.chemosphere.2020.127670 [73] KORNAROS M, DOKIANAKIS S N, LYBERATOS G. Partial nitrification/denitrification can be attributed to the slow response of nitrite oxidizing bacteria to periodic anoxic disturbances[J]. Environmental Science & Technology, 2010, 44(19): 7245-7253. [74] 刘宏, 南彦斌, 李慧, 等. 间歇曝气模式下曝气量对短程硝化恢复的影响[J]. 环境科学, 2018, 39(2): 865-871. LIU H, NAN Y B, LI H, et al. Effect of aeration rate on shortcut nitrification recovery in intermittent aeration mode[J]. Environmental Science, 2018, 39(2): 865-871 (in Chinese).
[75] SUN Y P, GUAN Y T, PAN M, et al. Enhanced biological nitrogen removal and N2O emission characteristics of the intermittent aeration activated sludge process[J]. Reviews in Environmental Science and Bio/Technology, 2017, 16(4): 761-780. doi: 10.1007/s11157-017-9444-z -




 下载:
下载: