-
作为污水处理过程副产物,污泥资源化回收利用已然成为污水处理工程的重要内容。预计2025年我国剩余污泥年产量可达9×107 t (以含水率80%计) [1]。剩余污泥含有微生物胞外聚合物和细胞内含物等大量有机物质[2],通过碱性发酵、湿式氧化、热水解等预处理方法可回收利用剩余污泥中有机碳源[3]。污泥热水解预处理技术 (thermal hydrolysis pretreatment,THP) 是国际水协会推荐的未来污水处理领域最具前景的18项技术之一[4]。剩余污泥经165~175 ℃水热处理30~60 min后,细胞壁破裂,胞内物质溶出,部分大分子有机物被水解为小分子有机物[5],如挥发性脂肪酸 (volatile fatty acids,VFAs) [6],进而更利于微生物的摄取和利用。与此同时,我国污水处理厂普遍存在进水COD/N较低的问题[7],为满足日趋严格的排放标准,通常需外加甲醇、乙酸钠等有机碳源。据统计,满足一级A排放标准的碳源需求量约为23.28 kg·m−3[7],这无疑将大大增加污水处理成本。
非传统碳源的使用可一定程度上降低外碳源的购置费用,比如天然纤维素物质[8]、可生物降解聚合物[9]、污泥或餐厨垃圾发酵液[10]等。鉴于THP可加速污泥中有机物的溶出,将其由固相转移至液相。因此,在THP处理的剩余污泥脱水液 (此后称之为污泥热水解滤液) 中富含有机物质,可将其用作污水处理厂主流或侧流工艺的外碳源,此举可在实现污泥减量的同时减少外碳源的购置费用。已有研究指出,污泥热水解滤液作为有机碳源时反硝化速率与乙酸钠相近,最高可达3.85 mg·(g VSS·h)−1[11]。WU等[3]研究表明,将80 ℃、90 min所得污泥热水解滤液用于A/O工艺外碳源时,系统出水可满足排放标准。值得注意的是,污泥热水解滤液含有一定浓度的氮和磷,外加污泥热水解滤液可造成系统氮、磷负荷提升,进而致使生物处理系统性能受到负面影响。除此以外,THP条件是决定污泥中有机物溶出效率和水解效率的关键因素[5],污泥热水解滤液中COD浓度与THP温度 (130~170 ℃) 和水解时间 (10~60 min) 紧密相关[12]。然而较高的THP温度可显著促进难降解有机物的生成[13-14],这不仅将降低污泥热水解滤液中有机物的可生化性,而且将对脱氮功能菌产生定向筛选作用[15],改变活性污泥中微生物群落结构。因此,探明污泥热水解滤液添加对生物脱氮过程的影响,将有助于推动污泥热水解滤液作为非传统碳源的工程化应用。
本研究旨在阐明污泥热水解滤液添加对生物脱氮系统的影响,首先探究热水解温度与污泥热水解滤液中有机物分布及反硝化速率的相关关系;其次,以乙酸钠为对照,分析污泥热水解滤液作为外碳源对厌氧/缺氧/好氧 (anaerobic/anoxic/oxic,A2/O) 系统的生物脱氮性能和微生物群落结构的影响,为污泥热水解滤液用作生物脱氮系统外碳源提供一定的理论支撑。
-
污泥热水解滤液。剩余污泥取自陕西省西安市某城市污水处理厂A2/O工艺的生物反应池,过筛 (1.0 mm) 后,投加聚丙烯酰胺进行沉降脱水,以将含固率调整为10%。THP过程如下:取2.5 L含固率为10%的剩余污泥加入高温高压反应釜 (KCF-5,北京世纪森朗实验仪器有限公司) ,分别于125、145、165和185 ℃条件下热水解处理30 min;冷却至室温后,于10 000 r·min−1、4 ℃下离心10 min (5804R,德国Eppendorf) ,上清液即为污泥热水解滤液。
-
A2/O反应器有效容积为30 L,其中厌氧池、缺氧池和好氧池的池容分别为4.20、9.02和16.70 L,反应器装置示意图见图1。水力停留时间分别为2.0、4.3和8.0 h。混合液内回流比和污泥外回流比分别为2.6和0.6。A2/O系统接种污泥取自上述污水处理厂好氧池,其MLSS为5.98 g·L−1,MLVSS为2.93 g·L−1,MLVSS/MLSS=0.49。连续运行期间,活性污泥MLSS约为3 g·L−1。
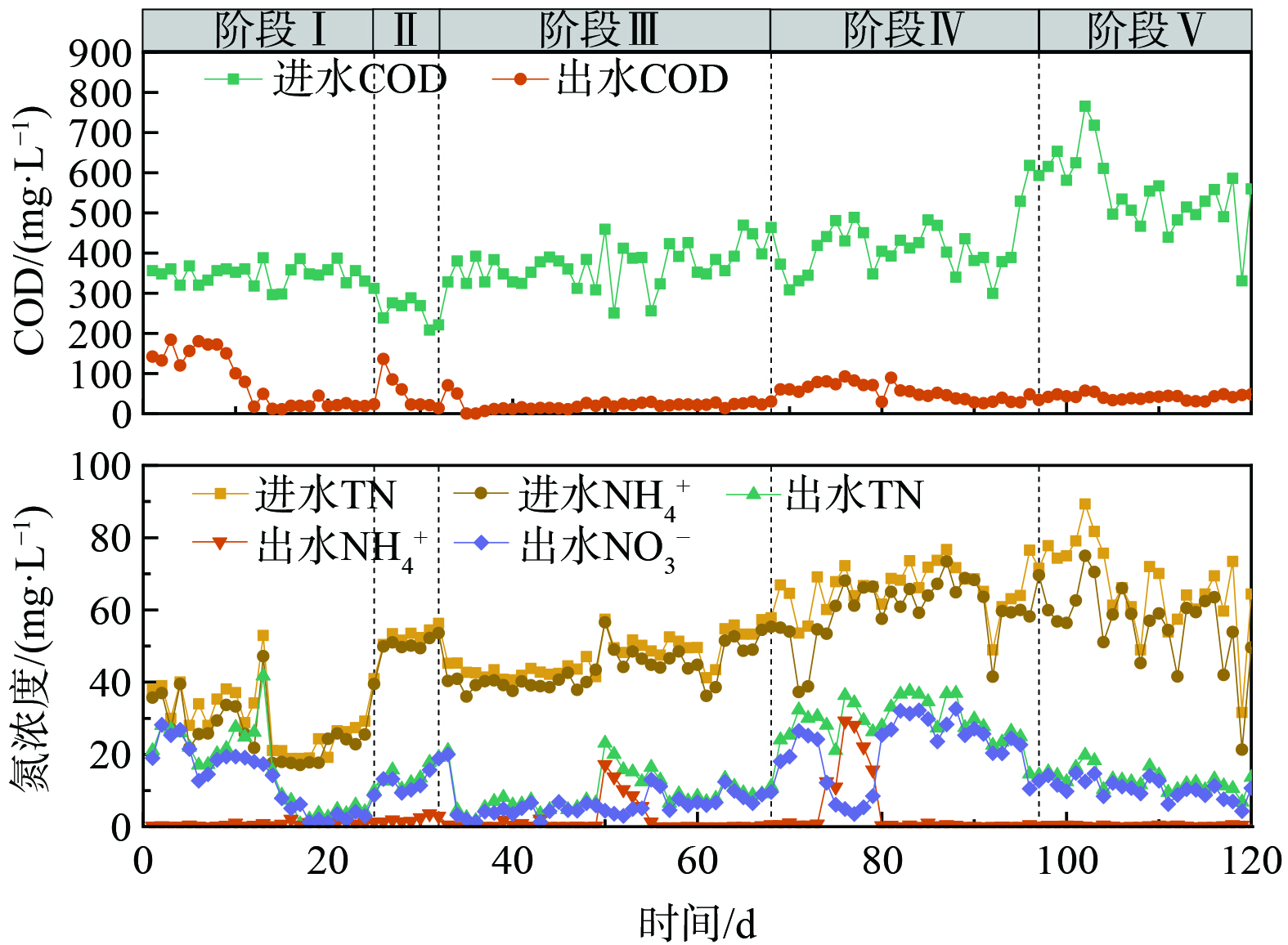
反应器的进水流量为50 L·d−1。连续运行试验共进行120 d,根据进水水质差异,将其分为5个阶段,各阶段运行方式和进水水质指标如表1所示。
-
不同THP温度下污泥热水解滤液反硝化速率。反硝化速率批次试验所用碳源为THP温度分别为125、145、165和185 ℃ (反应30 min) 下制备所得污泥热水解滤液。试验污泥取至上述污水处理厂好氧池,反应装置容积为1.0 L,试验开始前添加NaNO3浓溶液使得初始NaNO3浓度为40 mg N·L−1,并通过改变污泥热水解滤液投加量使初始COD/N为8,初始pH值调节至7.5左右,通入N2维持缺氧环境。以30 min间隔取样,测定NO3−-N、NO2−-N和COD浓度,并以MLVSS表征微生物浓度。
功能微生物活性测定。连续运行期间,定期测定各阶段稳定期时脱氮功能菌的最大活性。微生物活性测定过程主要参照BRDJANOVIC等[16]推荐方法。氨氧化菌 (ammonia oxidizing bacterium,AOB) 和亚硝酸盐氧化菌 (nitrite oxidizing bacterium,NOB) 活性测定步骤为:从A2/O反应器中收集400 mL活性污泥,以3 000 r·min−1离心5 min (TD5M-WS,上海卢湘仪实验室仪器有限公司) ,淘洗3次;将离心后的活性污泥添加至烧杯中,使用自来水重悬至400 mL。试验开始前,向烧杯中加入初始浓度为30 mg N·L−1的NH4Cl溶液 (或20 mg N·L−1的NaNO2溶液) 测定AOB (或NOB活性) ,控制溶解氧和温度分别为2.0~3.0 mg·L−1和30 ℃,并调节pH为7.50~8.40。测定NH4+-N或NO2−-N浓度变化速率。反硝化菌活性测定步骤为:从A2/O反应器中收集800 mL活性污泥,以3 000 r·min−1离心5 min (TD5M-WS,上海卢湘仪实验室仪器有限公司) ,淘洗3次;将淘洗后的活性污泥重悬至原体积,初始NO3−-N浓度为20 mg N·L−1,COD浓度为200 mg·L−1。调节pH为7.5左右,通入N2维持缺氧环境,测定NO3−-N和COD浓度变化速率。上述活性均以MLVSS表征微生物浓度。
-
NH4+-N和NO2−-N分别采用纳氏试剂分光光度法和N- (1-萘基) -乙二胺分光光度法测定;NO3−-N测定采用紫外分光光度法 (UV2600,上海尤尼柯仪器有限公司) [17]。COD测定采用快速消解法。总氮 (total nitrogen,TN) 和总磷 (total phosphorus,TP) 测定分别采用碱性过硫酸钾氧化-紫外分光光度法和过硫酸钾氧化-钼酸铵分光光度法;蛋白质采用Lowry法[18],以牛血清蛋白作为标准品;总VFAs测定采用异羟肟酸铁比色法[19]。TS、VS、MLSS和MLVSS采用重量法测定。
污泥热水解滤液的三维荧光光谱采用荧光分光光度计 (F-
7000 ,日本株式会社日立制作所) 测定,测试参数如下:发射波长 (Em) 和激发波长 (Ex) 分别为250~550 nm和200~500 nm,扫描步长5 nm,扫描速度为12 000 nm·min−1。荧光物质的相对定量采用荧光区域积分法 (fluorescence regional integration,FRI) [20]。 -
对各运行阶段的活性污泥样品进行16S rRNA基因测序,以研究活性污泥中微生物群落结构变化。活性污泥中DNA提取采用E.Z.N.ATM Mag-Bind Soil DNA Kit (OMEGA,上海奥米佳测量技术) 试剂盒并按照操作手册进行;采用1%琼脂凝胶电泳检测DNA的完整性,并使用紫外分光光度计 (NanoDrop 2000,美国赛默飞世尔科技公司) 测定DNA浓度及纯度。以提取的DNA为模板,采用V3-V4引物 (序列338F:5’-ACTCCTAGGGGAGGCAGCAG-3’和806R:5’-GGACTACHVGGGTWTATAAT-3’) 在PCR仪 (GeneAmp® 9700,爱普拜斯应用生物系统贸易 (上海) 有限公司) 进行PCR扩增。扩增产物在Illumina MiSeq高通量测序平台进行测序并对数据进行处理分析 (上海生工生物工程股份有限公司) 。
-
不同THP温度 (125、145、165和185 ℃) 下制备所得污泥热水解滤液特性见表2。THP的关键作用在于促进COD的溶出,SCOD浓度越高,则污泥水解破胞效果越好。由表2可知,在反应时间为30 min时,随着THP温度的增加,污泥热水解滤液中COD、蛋白质和VFAs等均呈现增加趋势。且THP温度由125 ℃升至165 ℃时,COD溶出率 (SCOD/TCOD) 由38.49%增加至44.23%;进一步提高THP温度至185 ℃,COD溶出率仅增加1.48%。于秋子等[21]研究指出,温度过高并不会显著提高COD溶出率。蛋白类物质是剩余污泥中主要有机组分,约占有机质的50%~60%[22]。不同THP温度下,高含固剩余污泥中蛋白质溶出率分别为44.51% (125 ℃) 、47.29% (145 ℃) 、48.92% (165 ℃) 和45.66% (185 ℃) 。在过高的THP温度下 (185 ℃) ,蛋白质水解率下降的主要原因可能是氨基酸类物质和还原性糖类发生Maillard反应所致[23]。THP温度由125 ℃升至185 ℃,可溶性TN由(1.73±0.08) g·L−1逐渐增至(3.21±0.05) g·L−1,说明蛋白质释放使得可溶性TN增加。不同THP温度制备得污泥热水解滤液的COD/N约11~13,高于生物去除TN的所需COD/N (COD/N=6) [24],因此污泥热水解滤液具备作为外碳源的潜力。
在不同 THP 温度下,污泥热水解滤液中溶解性有机物的三维荧光光谱图见图2。由图2(a)~(d)可知,高THP温度显著促进难降解有机物的生成。THP温度由125 ℃升至185 ℃时,污泥热水解滤液中Ⅲ区 (富里酸类) 和Ⅴ区 (腐殖酸类) 等难降解有机物的荧光信号显著增强。由FRI分析所得污泥热水解滤液中各区有机物占比可知(见图2(e)) ,随着THP温度的增加,易生物降解有机物 (Ⅰ、Ⅱ和Ⅳ区) 占比由86.28% (125 ℃) 降至60.02% (185 ℃) ;而难降解有机物占比分别由125 ℃的13.72%增加至15.13% (145 ℃) 、23.35% (165 ℃) 和39.98% (185 ℃) ,与STUCHEY等[25]研究结论相近。已有研究显示,由氨基酸和还原性糖类发生的Maillard反应可能是剩余污泥THP过程中难降解有机物的重要生成途径[23]。因此,将污泥热水解滤液用作外碳源时需关注此类难降解物质所造成的可生化性下降及其对系统性能的潜在影响。
-
经热水解预处理后,污泥中部分颗粒态有机物被释放至液相,大分子有机物被水解为小分子有机物,转化为可被反硝化细菌快速利用的有机碳源 (如VFAs) 。但不同THP温度条件下的污泥热水解滤液中VFAs含量有所差异 (表2) 。为探究不同THP温度下污泥热水解滤液作为有机碳源的反硝化性能,开展反硝化活性批次试验,结果见图3。
由图3可知,不同THP温度下污泥热水解滤液最大比反硝化速率,分别为3.08、2.86、2.93和3.27 mg·(g VSS·h)−1,可见,THP温度对污泥热水解滤液的最大比反硝化速率无显著影响。此外,试验过程中COD变化趋势与NO3−-N变化趋势相近,均呈现前期降解速率较高,而后期速率逐渐降低的趋势,应是前期消耗物质为易于反硝化菌利用的VFAs等,后期则主要利用如多糖、蛋白质等慢速降解有机物。值得注意的是,不同THP温度下污泥热水解滤液作为碳源时,均观察到NO2−-N的积累,且NO2−-N积累量最高可达10 mg·L−1。孙洪伟等[26]研究碳源类型对反硝化过程NO2−-N积累影响发现,以快速降解有机物作为反硝化碳源时 (如甲醇、乙酸、甲酸等) 可获得较高的NO3−-N转化为NO2−-N速率,从而系统出现NO2−-N积累现象。THP温度的升高,保证相同CON/TN前提下所引入的快速降解有机物 (如VFAs等) 含量降低,难降解有机物占比增加,从而使得NO2−-N最大积累量呈下降趋势。
-
考虑目前实际工程中普遍选取THP条件为165 ℃、30 min,且本研究中不同THP温度下污泥热水解滤液对最大反硝化速率无显著影响,故着重探讨典型THP条件下制备所得污泥热水解滤液作为外碳源对A2/O系统处理实际生活污水过程的影响。小试A2/O系统共运行120 d,连续运行结果见图4。第Ⅰ阶段 (1~25 d) 采用配制废水,平均进水COD/N为11.46,启动14 d后处理效果趋于稳定,出水COD浓度为20.88±8.57 mg·L−1,TN和NH4+-N浓度分别为 (5.75±4.06) 和 (1.09±0.50) mg·L−1,COD和TN去除率分别达到93.89%和80.96%。第Ⅱ阶段 (26~32 d) 为实际污水运行阶段,进水COT/N降至4.77,出水COD和TN相较于阶段Ⅰ均有所增加,分别为 (19.98±4.31) 和 (15.68±3.35) mg·L−1;且出水TN主要以NO3−-N形式存在,达14.05±4.00 mg·L−1,TN去除率降至71.04%。由于进水COD/N过低,化能异养型反硝化菌缺乏充足的有机碳源作为电子供体完成脱氮过程,进而致使TN去除率降低。基于此,第Ⅲ阶段 (33~68 d) 根据实际污水水质向反应器中添加乙酸钠作为外碳源,控制进水COD/N为7.82,稳定期时TN去除率提升至80.43%。
为探究污泥热水解滤液作为外碳源的效能,在第Ⅳ阶段 (69~97 d) ,以0.3%的体积投加率添加污泥热水解滤液,其所提供的COD约占进水总COD的36.11%。由于污泥热水解滤液中存在一定量TN (约6.60 mg·L−1) ,导致进水COD/N比仍处于较低水平 (约为6.1) 。运行稳定后系统出水COD和TN分别为 (63.73±32.12) 和 (31.32±6.13) mg·L−1,TN去除率下降至53.16%。相较于阶段Ⅱ,在较高的COD/N下并未达到理想的TN去除率,可能缘于反硝化功能菌尚未适应成分复杂的污泥热水解滤液,且污泥热水解滤液所提供碳源仍有不足。第Ⅴ阶段 (98~123 d) 进一步将污泥热水解滤液体积投加率提升至0.6%,此时进水中由污泥热水解滤液提供的COD约占总COD的49.84%,进水COD和TN分别达到554.63±87.94和67.03±11.67 mg·L−1。在稳定期时,出水TN降至 (13.90±4.25) mg·L−1,TN去除率达79.26%,与阶段Ⅲ的TN去除率相近。ZHU等[10]研究指出,以污泥发酵液作为外碳源TN去除率由65.3%提升至77.5%。综上所述,经微生物适应期后,以污泥热水解滤液为外碳源提供约50%进水COD可实现良好的生物脱氮效率。尽管污泥热水解滤液的加入导致系统进水COD和TN负荷分别增加49.84%和21.67%,但鉴于污泥热水解滤液的COD/N约为11~13,使得引入的有机碳源具备去除污水中TN的能力。另外,在阶段Ⅳ和阶段Ⅴ中系统出水COD浓度均因污泥热水解滤液的介入而有所提升,这主要因为污泥热水解滤液中含有一定量的难降解有机物。已有众多研究显示,非传统外碳源在实际应用时可能会抬升出水COD浓度,如厨余废水[27]、污泥发酵液[28-29]等。因此,在采用污泥热水解滤液等复杂碳源作为生物脱氮系统外碳源时,需特别关注可能由难生物降解物质所引起的出水COD浓度变化。
-
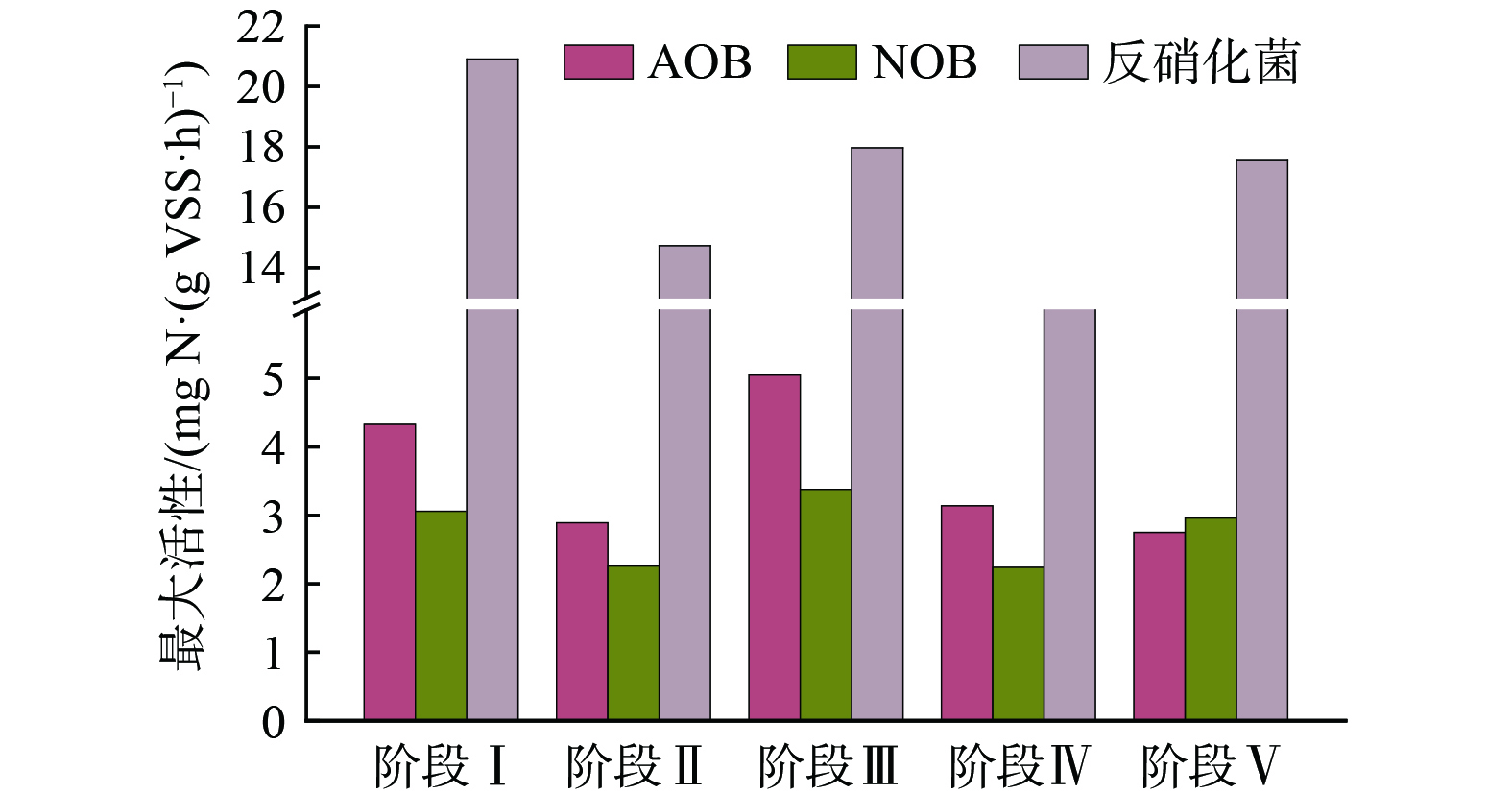
为探究污泥热水解滤液对活性污泥中功能菌活性的影响,在各阶段稳定运行期测定各功能菌最大活性,见图5。以污泥热水解滤液为外碳源的第Ⅳ阶段和第Ⅴ阶段AOB和NOB最大活性分别为3.14和2.96 mg N·(g VSS·h)−1,相较于添加乙酸钠作为外碳源阶段 (阶段Ⅲ) ,活性分别降低约37.21%和19.25%。尽管污泥热水解滤液的添加导致AOB最大活性受到影响,但系统出水NH4+-N仍低于1 mg·L−1,可见硝化性能未受到显著影响,这与WU等[3]研究结果一致。硝化菌为化能自养菌,因此硝化菌活性降低一方面可能由于污泥热水解滤液中可生物降解有机化合物对硝化细菌的直接抑制作用[15]及化能异养菌对DO的竞争,导致硝化细菌的生长速率降低;另一方面可能缘于颗粒和大胶体颗粒态有机物所造成的氧传质阻力增加[30]。
就反硝化菌最大活性而言,添加乙酸钠提升COD/N至7.82 (由阶段Ⅱ至阶段Ⅲ) ,最大反硝化速率由14.73 mg N·(g VSS·h)−1增加至17.97 mg N·(g VSS·h)−1,提高约22%。对于阶段Ⅳ,在碳源由乙酸钠置换为污泥热水解滤液后,反硝化活性有所降低,降幅约32.89%,这可能是由于污泥热水解滤液投加量不足且反硝化菌尚处于适应期所致,此阶段TN去除率也有所降低 (图4) 。通过提高污泥热水解滤液体积投加率 (阶段Ⅴ) ,COD/N达到8.27,反硝化菌活性增至17.55 mg N·(g VSS·h)−1,与阶段Ⅲ相近。在污泥热水解滤液作为外碳源处理实际污水时,反硝化菌活性最高可达16.01 mg N·(g VSS·h)−1[31],而污泥碱性发酵液的反硝化速率为7.94 mg N·(g VSS·h)−1[29],略低于本研究。可见,以污泥热水解滤液作为外碳源可维持系统反硝化能力,从而改善系统的脱氮性能。
-
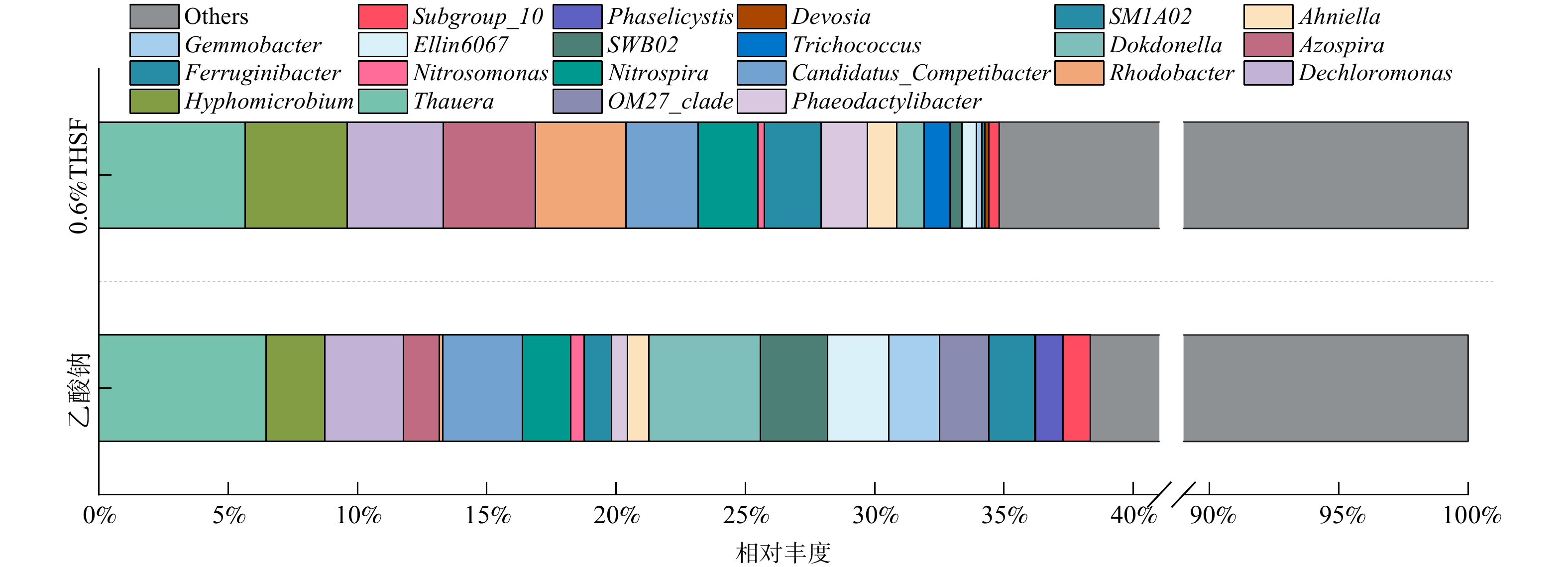
与乙酸钠相比,添加污泥热水解滤液后具有更高的微生物多样性指数。污泥热水解滤液添加前后活性污泥中微生物群落属水平相对丰度变化如图6所示。
Nitrosomonas (0.52%) 、Nitrospira (1.88%) 和Ellin6067 (2.37%) [32]、SM1A02 (1.78%) [33]为第Ⅰ阶段主要的硝化细菌,加入污泥热水解滤液后,Nitrosomonas和Ellin6067相对丰度分别降低50.77%和76.48%,Nitrospira相对丰度由1.88%增加至2.30%,这可能是污泥热水解滤液对微生物产生了定向选择。Devosia[34]可同时利用无机铵和有机氮 (芳香族硝基化合物) 产生NO2−-N或NO3−-N;污泥热水解滤液投加后,其相对丰度由0.03%升至0.16%,这可能是由于污泥热水解滤液中部分难降解物质与芳香族硝基化合物结构类似,进而有利于Devosia的生长。
污泥热水解滤液显著改变了反硝化菌的群落组成。污泥热水解滤液投加后典型部分反硝化菌Thauera相对丰度由6.47%降至5.66%,有研究显示富里酸类物质可抑制Thauera的生长[35]。Rhodobacter[36]和Phaeodactylibacter[37]为好氧反硝化细菌,引入污泥热水解滤液后两者相对丰度分别提高至3.50%和1.79%,这有助于提升COD利用率和总氮去除率。加入污泥热水解滤液后,以甲醇为电子供体参与反硝化过程的Hyphomicrobium[38]相对丰度由2.27%增加至3.94%,说明THP可能促进了后续反应过程中甲醇的生成,进而有利于Hyphomicrobium的生长。此外,Azospira中部分属具有强还原N2O能力[39],其相对丰度由1.38%增加至3.56%,污泥热水解滤液作为外碳源可能存在降低温室气体排放能力,但仍需进一步研究予以证实。
Dechloromonas被认为是反硝化除磷系统中主要的功能菌[40],可使用VFAs作为可用底物进行除磷代谢[41]。在污泥热水解滤液投加后,Dechloromonas相对丰度由3.04%增加至3.72%,说明污泥热水解滤液的投入可在一定程度上强化反硝化除磷效果,提高生物系统对有机碳源的利用效率。
综上,将污泥热水解滤液作为外碳源应用于实际污水,一方面可获得与乙酸钠相似的脱氮性能,降低成本和有机固体废弃物对环境影响;其次,污泥热水解滤液成分复杂,有利于促进不同代谢类型微生物协同作用,提高群落丰富度,进而提升系统抗冲击负荷的能力。
-
1) 随着热水解温度的增加,COD溶出率逐渐增加,但存在最大溶出率。过高的热水解温度可显著增加难降解有机物生成量,降低污泥热水解滤液的可生化性。
2) 以125、145、165和185 ℃的污泥热水解滤液作为反硝化外碳源,最大比反硝化速率分别为3.08、2.86、2.93和3.27 mg·(g VSS·h)−1,无明显差异。但NO2−-N的最大积累量与污泥热水解滤液中各有机物组分存在关联。
3) 污泥热水解滤液作为生物脱氮系统的外碳源处理实际污水时,TN去除率最高可达79.26%,与乙酸钠脱氮效果相当,说明污泥热水解滤液作为外碳源可强化生物反硝化过程,是回收生物能源和生物资源的有效途径。
4) 添加污泥热水解滤液后AOB与NOB活性分别降低37.21%和19.25%,但系统实际硝化性能未受影响;反硝化最大活性可达17.55 mg·(g VSS·h)−1,与添加乙酸钠时活性相当。污泥热水解滤液可增加活性污泥中微生物群落丰富度,反硝化细菌相对丰富度提高至18.55%,有利于提升系统的抗冲击负荷能力。
污泥热水解滤液作为外碳源对生物脱氮系统性能和微生物群落结构的影响
Effect of thermal hydrolyzed sludge filtrate as an external carbon source on the performance and microbial community structure of a biological nitrogen removal system
-
摘要: 剩余污泥热水解滤液作为生物脱氮系统的外碳源,可提高污泥中COD利用效率,实现污泥资源化利用。在探究不同热水解预处理温度所得热水解滤液特性的基础上,采用小试厌氧/缺氧/好氧 (anaerobic/anoxic/oxic,A2/O) 系统探究污泥热水解滤液作为外碳源对生物脱氮过程的影响。结果表明,不同热水解预处理温度所得污泥热水解滤液最大比反硝化速率无显著差异。热水解预处理条件为165 ℃、30 min,剩余污泥中COD溶出率和蛋白质溶出率较高,可分别达44.23%和48.92%。以实际工程所采用的热水解预处理条件 (165 ℃、30 min) 所得污泥热水解滤液作为外碳源进行连续试验。在污泥热水解滤液的体积投配率为0.6%时,系统TN去除率和最大反硝化速率最高可达79.62%和17.55 mg N·(g VSS·h)−1,与添加乙酸钠时脱氮性能相当。对比外碳源为乙酸钠时微生物群落结构,引入污泥热水解滤液后,反硝化菌相对丰度增至18.55%,且反硝化除磷菌Dechloromonas相对丰度由3.04%增至3.72%,说明污泥热水解滤液可强化反硝化过程与生物除磷过程的耦合,进而提升有机碳源利用效率。综上,污泥热水解滤液作为外碳源可显著提升A2/O系统反硝化性能,强化反硝化菌群结构,实现污泥资源化回收利用并同步提升污水营养物去除效率。Abstract: Thermal hydrolyzed sludge filtrate (THSF) can be used as an external carbon source for biological nitrogen removal system, which can improve the efficiency of COD utilization in sludge and achieve the resourceful utilization of sludge. Based on the exploration of the characteristics of THSF obtained at different thermal hydrolysis pretreatment temperatures, the effect of THSF as an external carbon source on the biological nitrogen removal process was investigated by using a lab-scale anaerobic/anoxic/oxic(A2/O) system. The results showed that there was no significant difference in the maximum specific denitrification rate of THSF obtained from different thermal hydrolysis pretreatment temperatures. Under the thermal hydrolysis pretreatment conditions of 165 ℃ and 30 min, the COD and protein dissolution rates in the waste-activated sludge were higher, which could be up to 44.23% and 48.92%, respectively. The THSF obtained from the thermal hydrolysis pretreatment conditions (165 °C, 30 min) used in the actual project was used as the external carbon source for continuous testing. The TN removal efficiency and maximum denitrification rate of the system reached up to 79.62% and 17.55 mg N·(g VSS·h)−1 at 0.6% volumetric addition ratio of the THSF, which were comparable to the denitrification performance when sodium acetate was added. Comparing the microbial community structure when the external carbon source was sodium acetate, the relative abundance of conventional denitrifying bacteria increased to 18.55% after the introduction of THSF, and the relative abundance of denitrifying phosphorus-removing bacteria Dechloromonas increased from 3.04% to 3.72%, which indicated that the THSF could strengthen the coupling between denitrifying process and biological phosphorus-removing process, and then enhance the efficiency of the utilization of organic carbon source. In conclusion, the THSF as an external carbon source can significantly enhance the denitrification performance of A2/O system and strengthen the structure of denitrifying bacterial community, which in turn can achieve the recycling of sludge resources and simultaneously enhance the removal efficiency of wastewater nutrient.
-

-
表 1 A2/O反应器运行方式和进水水质
Table 1. Operation modes and influent quality of A2/O reactor
进水 碳源类型 运行阶段 水质参数 COD/(mg·L−1) TN/(mg·L−1) 氨氮/(mg·L−1) COD/N 配制废水 乙酸钠 Ⅰ 346 30.2 26.9 11.46 实际污水 无外碳源 Ⅱ 253 53.13 50.8 4.77 乙酸钠 Ⅲ 370 47.35 43.87 7.82 0.3%滤液 Ⅳ 408 66.8 60.7 6.11 0.6%滤液 Ⅴ 555 67 56.7 8.28 表 2 不同温度热水解液特性比较
Table 2. Comparison of the characteristics of thermal hydrolysis supernatant at different temperatures
g·L−1 测定指标 原泥 热水解温度 125 ℃ 145 ℃ 165 ℃ 185 ℃ COD T 63.27±0.78 60.85±0.39 65.22±0.29 67.56±0.12 76.31±0.55 S 1.12±0.09 23.42±0.18 26.10±0.31 29.88±0.53 34.88±0.80 蛋白质 T 31.37±0.56 33.07±0.17 35.78±0.28 42.60±0.77 52.50±0.32 S 0.10±0.02 14.72±0.22 16.92±0.16 20.84±0.60 23.97±0.50 TN T 3.13±0.15 3.09±0.12 3.29±0.34 4.07±0.23 5.44±0.08 S 0.08±0.01 1.73±0.08 1.84±0.13 2.20±0.25 3.21±0.05 TP T 0.42±0.09 0.49±0.05 0.53±0.06 0.51±0.05 0.52±0.11 S 0.06±0.01 0.33±0.02 0.27±0.03 0.17±0.01 0.13±0.01 VFAs — 0.10±0.02 1.26±0.14 1.51±0.05 2.50±0.37 4.05±0.52 注:T代表总指标,S代表溶解态指标。 -
[1] 戴晓虎. 我国污泥处理处置现状及发展趋势[J]. 科学, 2020, 72(6): 30-34. [2] LIU H B, WANG Y Y, WANG L, et al. Stepwise hydrolysis to improve carbon releasing efficiency from sludge[J]. Water Research, 2017, 119: 225-233. doi: 10.1016/j.watres.2017.04.055 [3] WU Y Q, SONG K, JIANG Y H, et al. Effect of thermal hydrolysis sludge supernatant as carbon source for biological denitrification with pilot-scale two-stage anoxic/oxic process and nitrogen balance model establishment[J]. Biochemical Engineering Journal, 2018, 139(1): 132-138. [4] ANDREWS N, WILLIS J, MULLER C. Assessment of technology advancements for future energy reduction[M]. New York: IWA Pubilshing, 2016. [5] BARBER W P F. Thermal hydrolysis for sewage treatment: A critical review[J]. Water Research, 2016, 104(1): 53-71. [6] ZHU Y F, LIU H B, LIU H, et al. Filtration characteristics of anaerobic fermented sewage sludge for fatty acids production[J]. Separation and Purification Technology, 2015, 142: 8-13. doi: 10.1016/j.seppur.2014.11.037 [7] ZHANG J B, SHAO Y T, WANG H C, et al. Current operation state of wastewater treatment plants in urban China[J]. Environmental Research, 2021, 195: 110843. doi: 10.1016/j.envres.2021.110843 [8] BIKEM O. Batch biological denitrification using Arundo donax, Glycyrrhiza glabra, and Gracilaria verrucosa as carbon source[J]. Process Biochemistry, 2006, 41(6): 1289-1295. doi: 10.1016/j.procbio.2005.12.030 [9] TOKIWA Y, CALABIA B P, UGWU C U, et al. Biodegradability of plastics[J]. International Journal of Molecular Sciences, 2009, 10(9): 3722-3742. doi: 10.3390/ijms10093722 [10] ZHU X Y, CHEN Y G. Reduction of N2O and NO generation in anaerobic-aerobic (low dissolved oxygen) biological wastewater treatment process by using sludge alkaline fermentation liquid[J]. Environmental Science & Technology, 2011, 45(6): 2137-2143. [11] 韩露, 韩芸, 代洋. 等. 污泥热水解滤液作污水反硝化碳源的脱氮性能[J]. 中国环境科学, 2021, 41(8): 3653-3659. doi: 10.3969/j.issn.1000-6923.2021.08.021 [12] LU H W, XIAO S, LE T, et al. Evaluation of solubilization characteristics of thermal hydrolysis process[J]. Proceedings of the Water Environment Federation, 2014, 2014(15): 6312-6336. doi: 10.2175/193864714815938896 [13] 王治军, 王伟. 热水解预处理改善污泥的厌氧消化性能[J]. 环境科学, 2005, 26(1): 68-71. doi: 10.3321/j.issn:0250-3301.2005.01.015 [14] WANG Q D, XU Q Y, DU Z L, et al. Mechanistic insights into the effects of biopolymer conversion on macroscopic physical properties of waste activated sludge during hydrothermal treatment: Importance of the Maillard reaction[J]. Science of the Total Environment, 2021, 769: 144798. doi: 10.1016/j.scitotenv.2020.144798 [15] ZHANG Q, VLAEMINCK S E, DEBARBADILLO C, et al. Supernatant organics from anaerobic digestion after thermal hydrolysis cause direct and/or diffusional activity loss for nitritation and anammox[J]. Water Research, 2018, 143(1): 270-281. [16] LOOSDRECHT M C M V, NIELSEN P H, LOPEZ-VAZQUEZ C M, et al. Experimental methods in wastewater treatment[M]. IWA Publishing, 2016. [17] 国家环境保护总局. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社, 2002. [18] WANG W G, YAN Y, ZHAO Y H, et al. Characterization of stratified EPS and their role in the initial adhesion of anammox consortia[J]. Water Research, 2020, 169: 115223. doi: 10.1016/j.watres.2019.115223 [19] SIEDLECKA E M, KUMIRSKA J, OSSOWSKI T, et al. Determination of volatile fatty acids in environmental aqueous samples[J]. Polish Journal of Environmental Studies, 2008, 17(3): 351-356. [20] WEN C, PAUL W , LEENHEER J A , et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. [21] 徐秋子, 段娜, 林聪, 等. 不同温度水热预处理脱水污泥试验研究[J]. 中国沼气, 2019, 37(1): 31-35. doi: 10.3969/j.issn.1000-1166.2019.01.007 [22] CHEN S S, LI N, DONG B, et al. New insights into the enhanced performance of high solid anaerobic digestion with dewatered sludge by thermal hydrolysis: Organic matter degradation and methanogenic pathways[J]. Journal of Hazardous Materials, 2018, 342: 1-9. doi: 10.1016/j.jhazmat.2017.08.012 [23] ZHANG D, FENG Y M, HUANG H B, et al. Recalcitrant dissolved organic nitrogen formation in thermal hydrolysis pretreatment of municipal sludge[J]. Environment International, 2020, 138: 105629. doi: 10.1016/j.envint.2020.105629 [24] LI Y Y, HU Y Y, WANG G H, et al. Screening pretreatment methods for sludge disintegration to selectively reclaim carbon source from surplus activated sludge[J]. Chemical Engineering Journal, 2014, 255(1): 365-371. [25] STUCKEY D C, MCCARTY P L. The effect of thermal pretreatment on the anaerobic biodegradability and toxicity of waste activated sludge[J]. Water Research, 1986, 18(11): 1343-1353. [26] 孙洪伟, 王淑莹, 王希明, 等. 低温SBR反硝化过程亚硝态氮积累试验研究[J]. 环境科学, 2009, 30(19): 3619-3623. [27] ZHENG X, ZHOU W N, WAN R, et al. Increasing municipal wastewater BNR by using the preferred carbon source derived from kitchen wastewater to enhance phosphorus uptake and short-cut nitrification-denitrification[J]. Chemical Engineering Journal, 2018, 344(1): 556-564. [28] HU H D, MA S J, ZHANG X X, et al. Characteristics of dissolved organic nitrogen in effluent from a biological nitrogen removal process using sludge alkaline fermentation liquid as an external carbon source[J]. Water Research, 2020, 176: 115741. doi: 10.1016/j.watres.2020.115741 [29] SUN J, SUN M, GUO L, et al. The effects of denitrification with sludge alkaline fermentation liquid and thermal hydrolysis liquid as carbon sources[J]. Rsc Advances, 2016, 6(76): 72333-72341. doi: 10.1039/C6RA11982D [30] ZHANG Q, DE CLIPPELEIR H, SU C Y, et al. Deammonification for digester supernatant pretreated with thermal hydrolysis: overcoming inhibition through process optimization[J]. Applied Microbiology & Biotechnology, 2016, 100(12): 5595-5606. [31] ZHOU M Y, HAN Y, ZHUO Y, et al. Effect of thermal hydrolyzed sludge filtrate as an external carbon source on biological nutrient removal performance of A2/O system[J]. Journal of Environmental Management, 2023, 332: 117425. doi: 10.1016/j.jenvman.2023.117425 [32] WU N P, ZHANG Q, TAN B, et al. Integrated fixed-film activated sludge systems in continuous-flow and batch mode acclimated from low to high aniline concentrations: Performance, mechanism and metabolic pathways[J]. Bioresource Technology, 2023, 379: 129043. doi: 10.1016/j.biortech.2023.129043 [33] ZHANG L F, FU G K, Z ZHANG. Simultaneous nutrient and carbon removal and electricity generation in self-buffered biocathode microbial fuel cell for high-salinity mustard tuber wastewater treatment[J]. Bioresource Technology, 2019, 272: 105-113. doi: 10.1016/j.biortech.2018.10.012 [34] DING S Z, BAO P, WANG B, et al. Long-term stable simultaneous partial nitrification, anammox and denitrification (SNAD) process treating real domestic sewage using suspended activated sludge[J]. Chemical Engineering Journal, 2018, 339(2018): 180-188. [35] DOU Q H, ZHANG L, DONG T G, et al. Degradation properties of fulvic acid and its microbially driven mechanism from a partial nitritation bioreactor through multi-spectral and bioinformatic analysis[J]. Journal of Environmental Sciences, 2024, 135(1): 318-331. [36] ZHOU S L, SUN Y, LI Z X, et al. Characteristics and driving factors of the aerobic denitrifying microbial community in Baiyangdian Lake, Xiong’an New Area[J]. Microorganisms, 2020, 8(5): 714. doi: 10.3390/microorganisms8050714 [37] WANG J L, ZHOU J, WANG Y M, et al. Efficient nitrogen removal in a modified sequencing batch biofilm reactor treating hypersaline mustard tuber wastewater: The potential multiple pathways and key microorganisms[J]. Water Research, 2020, 177: 115734. doi: 10.1016/j.watres.2020.115734 [38] LAYTON A C, KARANTH P N, LAJOIE C A, et al. Quantification of Hyphomicrobium populations in activated sludge from an industrial wastewater treatment system as determined by 16S rRNA analysis[J]. Applied and Environmental Microbiology, 2000, 66(311): 1167-1174. [39] PARK H J, KWON J H, YUN J, et al. Characterization of nitrous oxide reduction by Azospira sp. HJ23 isolated from advanced wastewater treatment sludge[J]. Journal of Environmental Science and Health, Part A, 2020, 55(12): 1459-1467. doi: 10.1080/10934529.2020.1812321 [40] ZHAO W H, PENG Y Z, WANG M X, et al. Nutrient removal and microbial community structure variation in the two-sludge system treating low carbon/nitrogen domestic wastewater[J]. Bioresource Technology, 2019, 294: 122161. doi: 10.1016/j.biortech.2019.122161 [41] KIM J M, LEE H J, JEON C O, et al. Characterization of the denitrification-associated phosphorus uptake properties of “Candidatus Accumulibacter phosphatis” clades in sludge subjected to enhanced biological phosphorus removal[J]. Applied and Environmental Microbiology, 2013, 79(6): 1969-1979. doi: 10.1128/AEM.03464-12 -




 下载:
下载: