-
抗生素一直被广泛应用于治疗细菌感染性疾病[1]。然而,近年来抗生素的广泛使用导致了自然水体和土壤中抗生素含量逐渐累积升高。这主要是由于抗生素污染源的多样性,包括制药、医疗、畜牧水产养殖等行业产生的废水[2-4]。当抗生素在环境中长期存在时,不仅会影响动植物的生长[5-6],还会促使抗性基因和耐药菌群在环境中产生并传播[7]。
土霉素(oxytetracycline,OTC)常被用作畜牧水产养殖的饲料补充剂。作为一种发酵类抗生素,OTC在生产过程中伴随着大量的废水产生(每生产1 t土霉素约产生90~100 m3废水)[8]。其废水主要污染成分包括发酵残余营养液产生的COD(8 000~14 000 mg·L−1)、硫酸根离子(2 000~4 000 mg·L−1)、总氮(1 000~2 000 mg·L−1)以及以OTC(1 000~1 500 mg·L−1)为主的高生物毒性物质[9]。在通常情况下,OTC生产废水采用厌氧消化-好氧活性污泥法的组合工艺处理[10]。然而,经过常规厌氧生物工艺处理后,仍然存在相当高浓度的氨氮和残留约20%的OTC母体被排放进入到后续的好氧段[11]。传统好氧活性污泥法对抗生素的耐受性普遍较差,且存在运行成本高、能耗大等系列问题[12-13]。相比之下,菌藻共生体系中微生物和微藻之间的协同作用可高效转化和降解抗生素废水中的有机物质,提升系统稳定性[14-15]。通过特定的代谢途径,这些微生物和微藻甚至能够将残留的抗生素分子转化为无害的小分子物质[16-17]。菌藻共生体系中的藻类还能吸收利用废水中的营养物质,从而有助于废水的高效处理[18]。在此基础上,菌藻共生体系可以利用太阳能等自然能源进行光合作用,进一步减少废水处理过程中的能源消耗[19-20]。综上所述,菌藻共生体系在处理抗生素废水方面具有低耗高效、环境友好和稳定性强等优势,可以在一定程度上弥补活性污泥法的不足。
因此,本研究旨在探讨不同质量浓度(0、10、50、100和300 mg·L−1)的OTC对活性污泥体系和菌藻共生体系处理模拟OTC废水效果的影响。通过监测污染物(COD、氮素以及OTC)去除、OTC在污泥相的吸附量、微生物胞外聚合物含量、酶活性等指标的动态变化,深入了解两体系之间的性能差异。本研究可为抗生素生产废水生物处理提供新的解决思路,同时为抗生素生产废水生物处理工艺的运行维护和科学调控提供理论支持。
-
本实验所使用的废水为人工模拟OTC生产废水,其水质参数固定为(1 050±75) mg·L−1 COD、(200±10) mg·L−1 NH4+-N、(25±3) mg·L−1 TP[9],同时含有10 mg·L−1 MgCl2·6H2O、10 mg·L−1 CaCl2·6H2O、5 mg·L−1 ZnSO4、5 mg·L−1 FeSO4·7H2O、5 mg·L−1 CoCl2、5 mg·L−1 NiCl2。模拟废水的pH控制在7.0~7.5。所使用的小球藻藻种(Chlorella vulgaris,编号为FACHB-8)来源于中国科学院淡水藻种库,采用不同配比的模拟废水(未添加OTC)和BG11混合液驯化小球藻。活性污泥采用广东省深圳市某城市污水处理厂好氧池取得活性污泥,经过24 h闷曝处理后,加入模拟废水(未添加OTC),采用序批式的运行方式进行驯化。
-
本实验采用10个容积为1 L的圆柱形光反应器,其内部底面直径为55 mm,柱高为500 mm,分别编号为1~10。1~5号(传统活性污泥体系)以及6~10号(菌藻共生体系)反应器设定不同进水OTC质量浓度(0、10、50、100和300 mg·L−1),其中1号和6号为对照组(未添加OTC)。在1~5号反应器接种4.0 g活性污泥,6~10号反应器接种3.0 g活性污泥以及1.0 g小球藻。待6~10号反应器叶绿素a浓度稳定且所有反应器出水水质稳定后,进行后续实验。
每个反应器的运行周期为12 h,包含曝气6 h、静置5 h、出水0.5 h和进水0.5 h。每个周期的进水量和排水量均为500 mL,水力停留时间(hydraulic retention time,HRT)设定为24 h,每天固定在曝气阶段排泥20 mL,污泥停留时间设定为50 d。为减少水分蒸发对实验结果的影响,将所有反应装置放置于相同的实验平台上,并在反应装置开口处覆盖保鲜膜。1~5号反应器处于黑暗环境中,6~10号反应器在曝气期间提供光照(4 000~5 000 lux),而在非曝气时,处于黑暗环境,曝气量均设置为0.15~0.25 L·min−1。反应器运行期间,环境温度保持在(25±1) oC,以确保实验条件的稳定性。
-
OTC易于光解,其光解效率在不同初始浓度下存在差异[21]。水体中OTC的去除途径主要包括光降解、生物降解以及生物吸附[22]。
光降解实验采用4个1 L的光反应器,分别加入OTC质量浓度为10、50、100、300 mg·L−1的模拟废水。每个反应器(不接种活性污泥或小球藻)的运行条件与菌藻共生体系一致。运行1个HRT后,取出水样,测定出水中OTC的浓度,以计算不同OTC浓度下的光降解效率。
生物吸附(污泥相中OTC浓度测定):取实验1.2运行1个HRT后的5 mL污泥样品置于离心管,离心10 min(4oC,4 500 r·min−1),弃去上清液后以0.9%生理盐水洗涤沉淀物2~3次。将样品冷冻干燥后充分研磨,加入5 mL Na2EDTA-Mcllvaine萃取溶液(0.1 mol·L−1),超声萃取15 min,离心10 min(4oC,4 500 r·min−1),收集上清液并过滤(0.22 µm)。上述操作步骤重复5次以充分提取污泥相中所吸附的OTC。然后,采用HLB小柱(CNW Poly-Sery HLB Pro,200 mg,6 mL)进行固相萃取:使用2 mL甲醇和2 mL超纯水活化柱子(重复3次),待样品全部过柱后,用6 mL 5%甲醇水溶液和6 mL超纯水进行淋洗;真空干燥10 min后用6 mL甲醇洗脱至离心管中。样品经过滤(0.22 µm)后测定其OTC浓度[23]。OTC的生物降解量即为进水OTC总量减去未被去除含量(出水含量)、光降解量与生物吸附量之和。
-
对各体系进行定期检测分析[24]。NH4+-N采用纳氏试剂分光光度法测定;NO2−-N采用N-(1-萘基)-乙二胺光度法测定;NO3−-N采用紫外分光光度法测定;COD采用重铬酸钾分光光度法测定;叶绿素a采用丙酮分光光度法测定;胞外聚合物(extracellular polymeric substances,EPS)采用热提取法[25]测定,蛋白质(extracellular polymeric substances proteins,PN)采用南京建成生物工程研究所生产的BAC试剂盒测定,多糖(extracellular polymeric substances polysaccharides,PS)采用苯酚-硫酸法测定;OTC采用高效液相色谱法(Ultimate 3 000,Thermo Fisher Scientific) 测定;超氧化物歧化酶(superoxide dismutase,SOD)和活性氧(reactive oxygen species,ROS)均采用江苏酶免实业有限公司所生产的ELISA科研试剂盒测定。
-
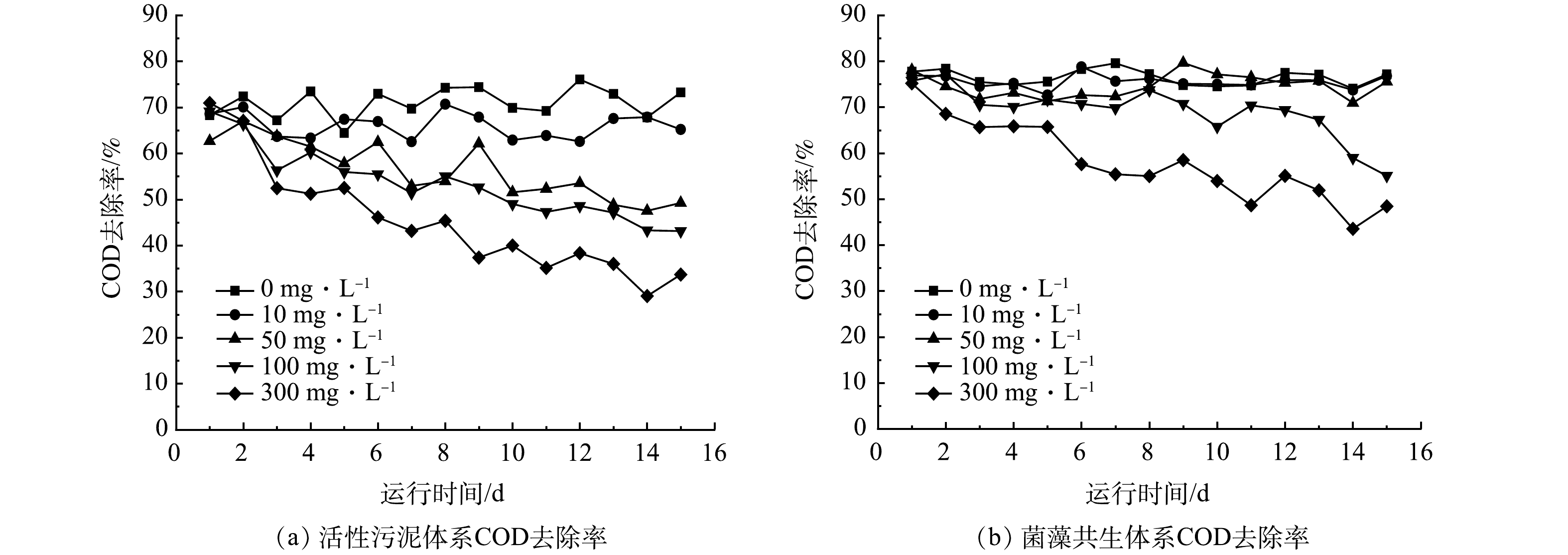
如图1(a)所示,10 mg·L−1 OTC对活性污泥体系去除COD的影响较小,其平均去除率达到(66.1±7.8)%,相比于1号对照组的去除率仅降低了5%;而实验结束时(第15天),其COD去除负荷则从对照组的184.8 mg·(g·d)−1下降至166.8 mg·(g·d)−1。50、100和300 mg·L−1 OTC对活性污泥体系的COD去除率影响较大,直至实验结束分别降至49.3%、43.1%、33.7%,尤其在300 mg·L−1 OTC影响下COD去除负荷降低了50.8%,从198.9 mg·(g·d)−1下降至98.06 mg·(g·d)−1。
相比之下,在不同浓度OTC的影响下,菌藻共生体系具有更高的COD去除率。如图1(b)所示,相比于对照组,10 mg·L−1和50 mg·L−1 OTC对COD去除的影响不明显,COD平均去除率分别为(75.6±2.1)%和(74.6±6.7)%,但其中的COD去除负荷均有所下降,在实验结束时,由对照组的169 mg·(g·d)−1分别降至125.5 mg·(g·d)−1和123.3 mg·(g·d)−1。这是由于藻类的快速繁殖导致菌藻共生体系的悬浮固体含量普遍高于活性污泥体系。然而,在高浓度OTC下,菌藻共生体系的微生态平衡和废水处理性能也受到了抑制,导致COD去除率明显降低。在100 mg·L−1 OTC的胁迫下,COD去除率由初始的75.7%下降至55.1%。在300 mg·L−1 OTC条件下,出水COD逐步提高,实验结束时最终达到588 mg·L−1,去除率为48.4%,同时其污泥负荷降至128.1 mg·(g·d)−1。
-
如图2(a)和图2(e)所示,相比对照组1号和对照组6号,10 mg·L−1 OTC对活性污泥体系和菌藻共生体系中NH4+-N转化的影响不明显,2个体系中NH4+-N平均去除率分别为(98.8±0.2)%和(99.1±0.1)%。50 mg·L−1 OTC对活性污泥体系的NH4+-N去除在前6 d影响较低,平均去除率达到(98.7±0.1)%,然而,随后出水NH4+-N浓度上升,至实验结束时,NH4+-N去除率下降至71.7%;但相同质量浓度OTC对菌藻共生体系的影响较小,其平均NH4+-N去除率可达(97.2±3.0)%。100 mg·L−1和300 mg·L−1 OTC对活性污泥体系NH4+-N去除的影响较大。从第1天开始,出水NH4+-N呈上升趋势,至实验结束时,去除率分别为25.1%和11.2%。在100 mg·L−1 OTC的条件下,菌藻共生体系中前6 d出水NH4+-N波动较小,去除率为(97.0±1.0)%;然而,从第7天开始,出水NH4+-N逐渐上升,到实验结束时,NH4+-N去除率下降至43.7%。在300 mg·L−1 OTC的条件下,从第1天起,出水NH4+-N呈上升趋势,至实验结束时去除率仅为28.3%。
由图2(b)、图2(c)、图2(f)和图2(g)可见,对照组1号和6号中出水NO2−-N和NO3−-N浓度无明显差异。在10 mg·L−1 OTC的影响下,活性污泥体系出水NO2−-N持续上升,出水NO3−-N持续下降,至实验结束时分别达到61.5 mg·L−1和27.7 mg·L−1;而菌藻共生体系与对照组6号无明显差异,显示出较高的氮素去除效率。在50 mg·L−1 OTC的条件下,活性污泥体系出水NO2−-N和NO3−-N与10 mg·L−1 OTC条件下相似,但每日变化幅度明显高于10 mg·L−1 OTC处理条件下的程度;而菌藻共生体系出水NO2−-N出现轻微波动,质量浓度达到21.4 mg·L−1,出水NO3−-N波动幅度较小。在100 mg·L−1 OTC条件下,活性污泥体系出水NO2−-N以及NO3−-N出现明显波动,出水NO2−-N在第7天达到最高值89.1 mg·L−1,随后逐步下降,同时出水NO3−-N也下降到0 mg·L−1;而菌藻共生体系出水NO2−-N在实验初期未受影响,但从第7天开始上升,至第12天达到最高值,为52.1 mg·L−1;同时,出水NO3−-N在第7天开始明显下降,到第13天降至约0。在300 mg·L−1 OTC条件下,活性污泥体系在短期内出现明显变化,出水NO2−-N出现大幅度上升,而出水NO3−-N则出现明显下降;相比之下,菌藻共生体系出水NO2−-N在实验初期上升,至第5天达到最高值88.7 mg·L−1后下降,而其出水从第4天起未检测到NO3−-N。两体系出水NO2−-N和NO3−-N出现波动的原因可能是因为亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)比氨氧化细菌(ammonia-oxidizing bacteria,AOB)对四环素类抗生素更敏感,因此,在OTC的影响下,NOB的活性受到抑制,导致NO2−-N的累积[26]。
图2(d)和图2(h)显示了总无机氮(total inorganic nitrogen,TIN)去除率的变化情况,在10 mg·L−1 OTC条件下,菌藻共生体系TIN去除率维持在(63.3±3.9)%,脱氮负荷为128.5 mg·(L·d)−1,而活性污泥体系的去除率维持在(54.9±15.7)%,脱氮负荷为111.4 mg·(L·d)−1。在50 mg·L−1 OTC的影响下,活性污泥体系的TIN去除率出现明显下降,而菌藻共生体系维持在(56.2%±19.8)%,这表明在面对外界环境恶化时,菌藻共生体系的稳定性优于活性污泥体系。在100 mg·L−1和300 mg·L−1 OTC的影响下,2个体系的中的TIN去除率均出现不同程度下降,特别是在300 mg·L−1 OTC的条件下,实验结束时活性污泥体系的TIN去除率为3.2%,脱氮负荷为6.5 mg·(L·d)−1;菌藻共生体系的TIN去除率为16.4%,脱氮负荷为32.8 mg·(L·d)−1。这表明高浓度OTC能直接破坏体系,导致TIN去除率明显下降。
总体而言,不同浓度的OTC均会影响活性污泥体系和菌藻共生体系对氮素的去除效率,较高质量浓度的OTC(100 mg·L−1和300 mg·L−1)对2种体系的氮素去除均有明显抑制作用,尤其是活性污泥体系可能会受到更明显的影响。相比之下,在OTC胁迫条件下,菌藻共生体系展现出优异的氮素去除效率。
-
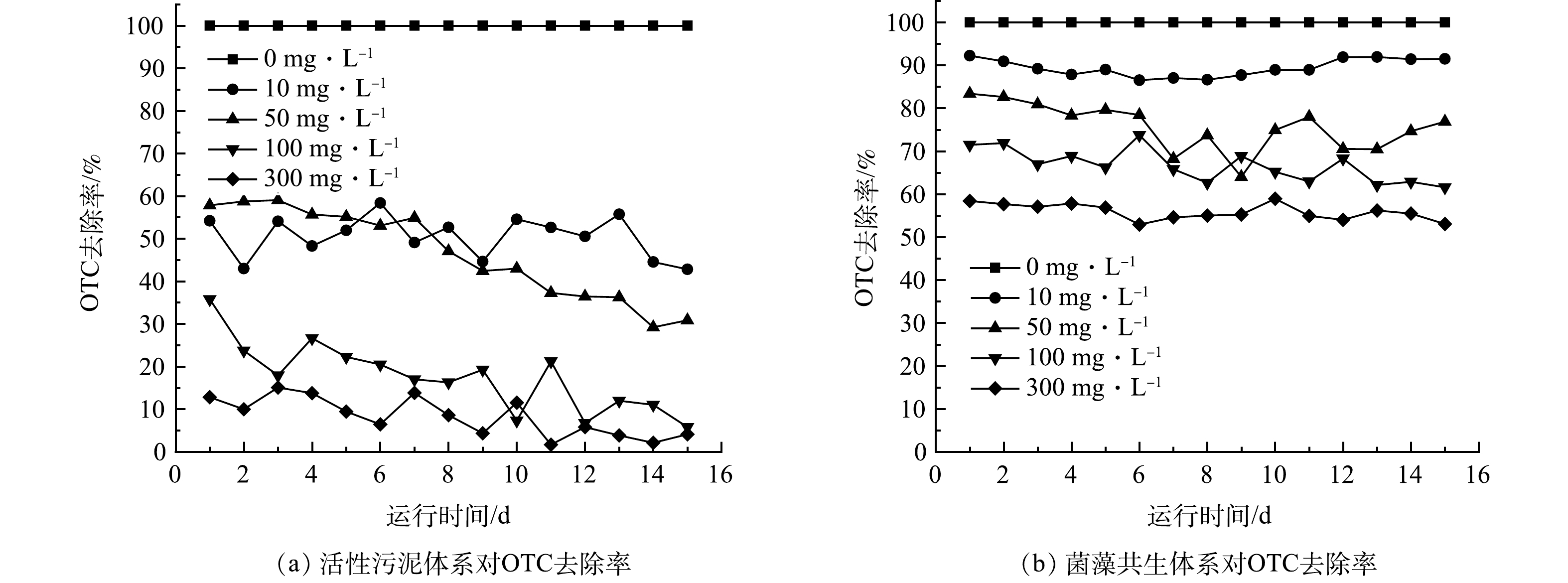
由图3可见,在进水OTC质量浓度为10 mg·L−1条件下,活性污泥体系对OTC去除率维持在40%~60%,而菌藻共生体系的OTC去除率维持在90%上下。当进水OTC质量浓度增至50 mg·L−1时,活性污泥体系的初始OTC去除率保持在58.0%,然后逐渐下降,至实验结束时降至30.9%;而在相同浓度的OTC下,菌藻共生体系对OTC去除率保持在70%~80%。在OTC进水质量浓度为100 mg·L−1的条件下,活性污泥体系对OTC去除率明显下降,而菌藻共生体系维持稳定。这表明活性污泥的吸附量在短时间内达到最大值,导致出水OTC浓度上升。当进水OTC质量浓度为300 mg·L−1时,2个体系的OTC去除率明显低于其他进水浓度条件下的去除率。总体而言,相较于传统活性污泥体系,菌藻共生体系在对OTC的去除方面表现出明显的优势。
-
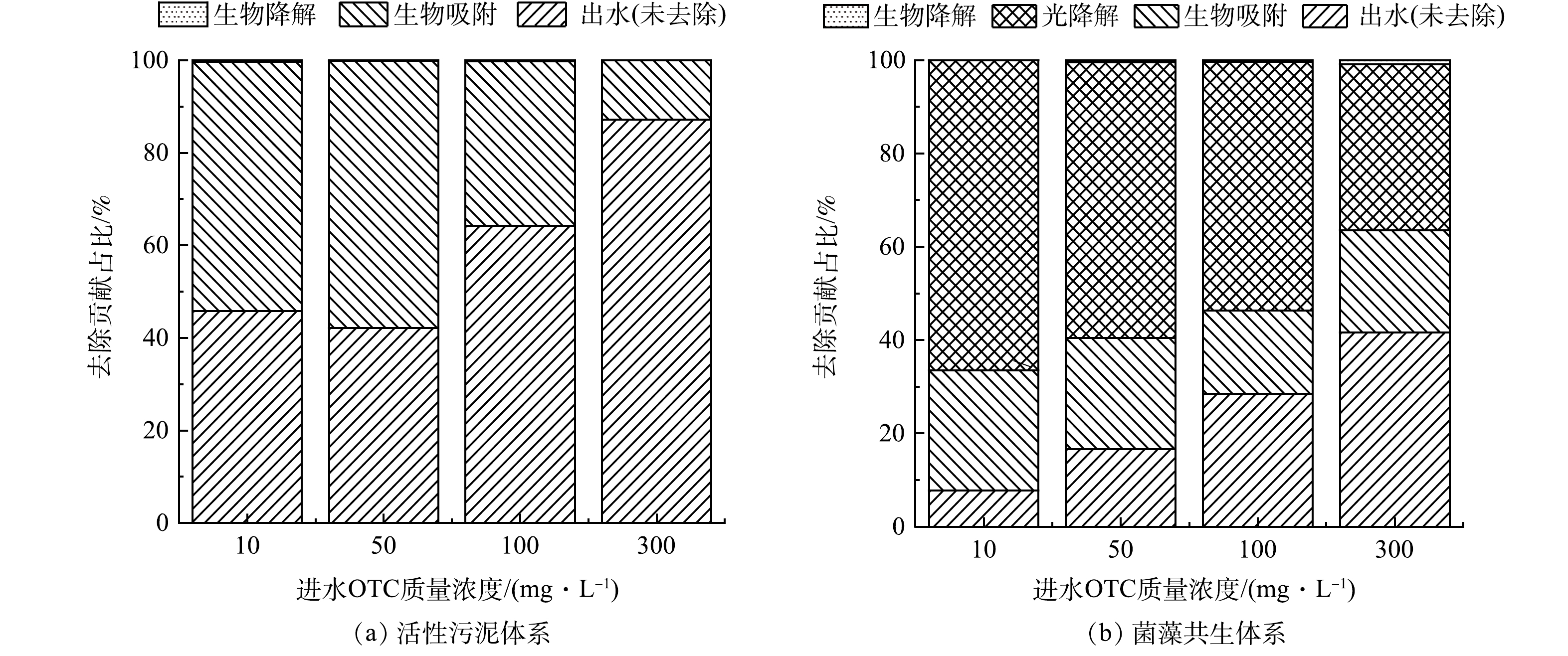
微生物通常需要较长的适应期来合成降解酶,以实现对抗生素的降解[27-28]。根据OTC的物料平衡(图4),在实验的第1天,2个实验体系中的微生物降解作用占比极低(均低于1%)。活性污泥体系对OTC的去除主要依赖于生物吸附作用,随着OTC浓度的上升,生物吸附量相应降低。在菌藻共生体系中,由于藻类生长繁殖需要光源,光解作用在OTC去除过程中占据一定比例。同时,随着进水OTC浓度的升高,光解占比逐步下降,而生物吸附量占比逐步增加。
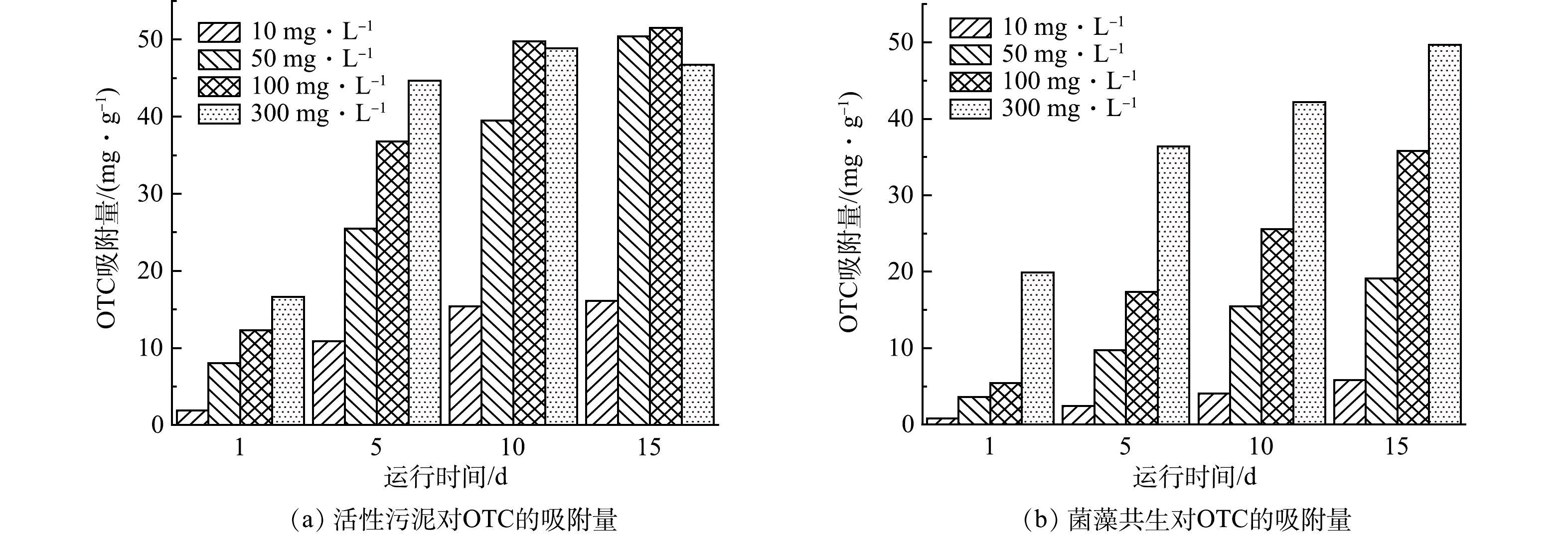
图5为OTC在污泥相中的累积情况。可见,随着反应器的运行,污泥相中的OTC含量逐渐增加。由图5(a)可以看出,在100 mg·L−1和300 mg·L−1 OTC的影响下,活性污泥体系中OTC迅速累积,吸附量达到最大值,为51.5 mg·g−1,且随着运行时间的增加,吸附速率下降,这是由于微生物絮体表面的吸附位点有限,当吸附位点趋于饱和时,吸附速率会出现下降趋势。由图5(b)可见,在光解作用下,水体中部分OTC被降解,导致菌藻共生体系在相同时间内对OTC的吸附量远低于传统活性污泥体系。
总体而言,2个体系中的OTC吸附量均随反应时间呈上升趋势,但值得注意的是,菌藻共生体系由于光照这一外部条件的存在,能够有效降解OTC。光解作用与微生物和微藻的协同作用可更好地提高处理效率。因此,相较于活性污泥法,菌藻共生体系在处理OTC废水时表现出更卓越的性能,通过充分利用光照条件,实现了对OTC的高效去除。
-
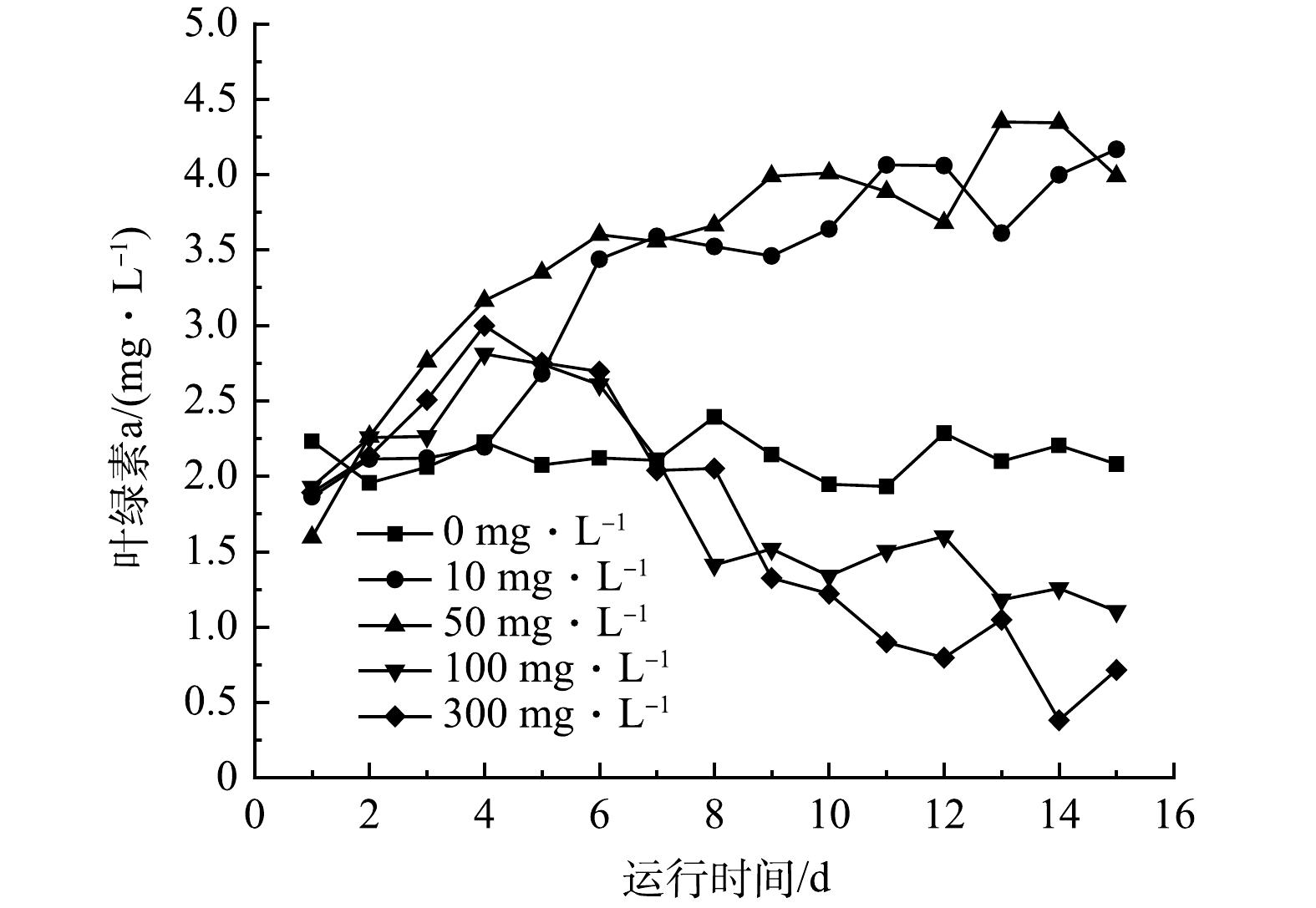
叶绿素a是评估水体中微藻生物量的关键指标,通过叶绿素a浓度可以评估微藻的生长情况[29]。如图6所示,与对照组相比,10 mg·L−1和50 mg·L−1 OTC对叶绿素a的生成影响较大,叶绿素a浓度呈上升趋势,至实验结束时2个实验组的叶绿素a浓度均增长了1倍,说明低浓度的OTC能促进小球藻的生长繁殖。然而,当进水中含有100 mg·L−1和300 mg·L−1 OTC时,叶绿素a浓度在第4天达到峰值,在第5天出现下降,表明微藻的光合作用受到最大程度的抑制;在第7天,叶绿素a浓度低于对照组,说明高浓度OTC的胁迫导致微藻生长受到抑制,甚至可能导致叶绿体结构破裂,伴随出水流失,从而使微藻生物量下降。这种低浓度促进生长、高浓度抑制生长的现象在微藻对抗生素的反应中普遍存在。武鹏鹏等[30]在研究OTC对斜生栅藻(Scenedesmus obliquus)的毒性作用时发现,在20 mg·L−1 OTC的暴露下,相比于0 mg·L−1 OTC,叶绿素a浓度在96 h内降低了28.9%,细胞发生氧化损伤,从而影响藻细胞活性。因此,为了建立稳定高效的菌藻共生处理体系,还需要进行更深入的研究。这包括研究不同条件下微生物种群的适应性和微生态系统的动态变化,以全面深入地了解菌藻共生体系,并优化其对含抗生素废水的处理效果。
-
EPS是微生物代谢产生的一种高分子物质,广泛存在于污泥絮体的内部和表面[31]。EPS主要由PN和PS组成,微生物EPS中PN和PS含量的动态变化可用于表征微生物的代谢状态及环境因素的影响情况。如图7所示,当OTC质量浓度为10 mg·L−1时,2个体系在第8天PN和PS总量增加,其中PN的增加量大于PS。这是因为微生物在受到四环素类抗生素干扰时,会分泌大量胞外蛋白以提高微生物抵御毒性污染物的能力[32-33]。这一点与张微等[34]的研究结果一致。在第15天,活性污泥体系PN总量显著上升,而菌藻共生体系出现小幅度下降,这表明菌藻体系在10 mg·L−1 OTC胁迫下能够快速适应OTC产生的短期冲击。当OTC质量浓度为50 mg·L−1时,菌藻共生体系在PN和PS变化上与10 mg·L−1时差别不大,但活性污泥体系中PN和PS总量在第8天和第15天显著下降,表明该体系未能有效适应50 mg·L−1 OTC,这与前述COD及氮类物质去除效果的结论一致。在OTC质量浓度达到100 mg·L−1和300 mg·L−1后,2个体系在第8天和第15天PN和PS总量逐渐降低,且OTC浓度越高,下降幅度越大。相关研究表明,在暴露于高浓度OTC的初始阶段,微生物受到刺激后会分泌大量EPS,在细胞表面形成网格状保护层,以对抗OTC的胁迫[35]。随后,OTC与EPS中的蛋白能够通过氢键和范德华力的方式结合在一起,导致EPS中的结合位点被OTC占据,影响EPS中的肽链结构[36]。此外,OTC进入细胞体内后能够结合到核糖体30S亚基中A的位置,抑制肽链的增长,从而影响EPS的合成,进而导致PN和PS的含量下降,使得体系受到负面影响[37]。
综上所述,EPS的变化规律与前述结论一致,高质量浓度的OTC(100 mg·L−1和300 mg·L−1)会严重影响2种体系的微生态平衡。相反,在中低质量浓度(10 mg·L−1和50 mg·L−1)下,菌藻共生体系具有更强的抗逆境稳定性。
-
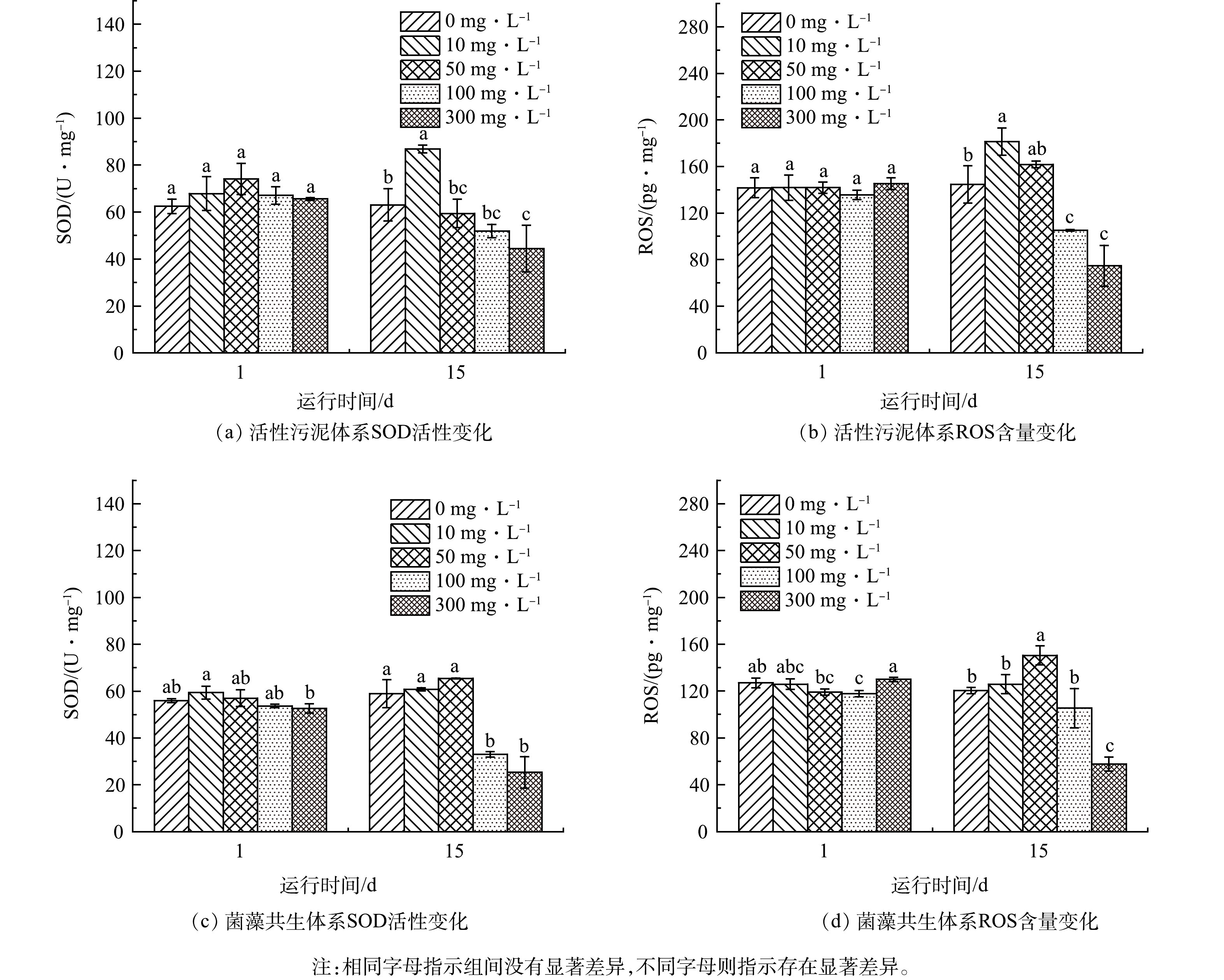
图8为在实验初始和结束时2种体系中SOD活性和ROS含量的变化情况。可见,在OTC的暴露下,微生物胞内会迅速产生大量ROS,进而发生SOS响应(即激活DNA修复系统)。细胞内低浓度的ROS有助于提升微生物的耐药性,但当ROS浓度过高时,可能会导致微生物的损伤甚至死亡[38]。SOD则负责清理细胞内过量的ROS,以维持细胞稳定。
在10 mg·L−1 OTC的影响下,2种体系的SOD活性和ROS含量至第15天均呈上升趋势,尤其是活性污泥体系的增长幅度明显高于菌藻共生体系。这说明在OTC胁迫下,活性污泥相较于菌藻共生体系表现出更为强烈的应激反应。生物体内产生大量的ROS,同时也使得SOD的活性上升,用于清理过量的ROS。在50 mg·L−1 OTC的条件下,活性污泥体系至实验结束阶段出现SOD活性下降而ROS含量上升的现象,表明细胞体内产生的ROS含量过高,超出了细胞自身的自我调节能力。而菌藻共生体系在进水为10 mg·L−1和50 mg·L−1 OTC的影响下SOD活性无显著差异,第15天ROS含量在50 mg·L−1 OTC下显著高于10 mg·L−1 OTC与对照组。在100 mg·L−1和300 mg·L−1 OTC的影响下,2种体系的SOD活性和ROS含量在第15天出现显著下降,且呈现浓度越高下降越快的趋势,这表明高浓度OTC对微生物具有较强的毒性效应,能在短时间内直接损伤细胞。
-
本研究系统考察了OTC浓度对活性污泥体系和菌藻共生体系处理废水效果的影响。菌藻共生体系的废水处理效能和系统稳定性均明显优于活性污泥体系,得出如下主要结论。
1) 10 mg·L−1和50 mg·L−1 OTC对菌藻共生体系的处理效果影响相对较小,未破坏原有的系统稳定性,COD去除率基本维持在75%左右,而NH4+-N去除率均保持在97%以上。
2)在10 mg·L−1 OTC的影响下,活性污泥体系中氮素的去除受到一定抑制,出水NO2−-N升至61.5 mg·L−1。而50 mg·L−1 OTC对活性污泥体系的影响较大,表现为EPS总量的下降以及ROS含量的上升。
3) 100 mg·L−1和300 mg·L−1的高质量浓度OTC对菌藻共生体系和活性污泥体系均产生了显著的负面影响,并随着OTC浓度的增加而影响加剧。
菌藻共生系统对土霉素生产废水的处理效能
Performance of the bacterial-algal symbiosis system on treating oxytetracycline production wastewater
-
摘要: 土霉素生产废水因其可生化性差、生物抑制性强,在利用传统活性污泥法处理过程中常面临能耗高、效能低等一系列问题。相比之下,作为一种新兴工艺,菌藻共生体系因其具有高效低耗的特点,有望在传统生物污水处理领域实现突破。然而,目前利用菌藻共生体系处理抗生素生产废水的研究仍处于起步阶段,相关应用尚未得到广泛开展。因此,该研究通过设置不同进水土霉素(OTC)浓度,对比研究了好氧活性污泥和菌藻共生体系在处理土霉素生产废水方面的性能差异。结果表明,在有无OTC胁迫的情况下,菌藻共生体系在废水处理效能与系统稳定性方面均优于活性污泥体系。当OTC质量浓度分别为10 mg·L−1和50 mg·L−1时,菌藻共生体系受到的影响相对有限,COD去除率维持在75%左右,而NH4+-N去除率均保持在97%以上;然而,活性污泥体系则表现出显著的负面影响,具体表现为COD、氮素和OTC的去除率下降以及胞外聚合物含量和超氧化物歧化酶活性的显著波动。当OTC质量浓度增加至100 mg·L−1和300 mg·L−1时,2种体系均表现出明显的抑制效应,不仅COD和NH4+-N的去除率大幅降低,而且污泥微生物胞外聚合物中的多糖、蛋白质含量以及超氧化物歧化酶活性显著减少,从而影响了系统的稳定性。Abstract: Due to its poor biodegradability and strong biological inhibition, the oxytetracycline (OTC) production wastewater poses challenges for conventional activated sludge processes facing high energy consumption and low efficiency. In contrast, as an emerging technology, the bacterial-algal symbiosis system are expected to achieve breakthroughs in the field of conventional biological wastewater treatment due to its high efficiency and low energy consumption. However, the research on using bacterial-algal symbiosis system to treat antibiotic production wastewater is still in its infancy, and related applications have not yet been widely developed. Therefore, in this study, the performance of aerobic activated sludge and bacterial-algal symbiosis systems was systematically investigated and compared on treating OTC production wastewater with different influent OTC concentrations. The results showed that the bacterial-algal symbiosis systems outperformed the activated sludge systems in terms of wastewater treatment efficiency and system stability with or without OTC stress. When the OTC concentration was 10 and 50 mg·L−1, the bacterial-algal symbiosis systems were relatively unaffected, COD and NH4+-N removal rates maintained around 75% and over 97%, respectively. However, the activated sludge system exhibited significant negative impacts, including reductions in the removal rates of COD, nitrogen, and OTC, as well as notable fluctuations in extracellular polymeric substance content and superoxide dismutase activity. When the OTC concentrations increased to 100 and 300 mg·L−1, both systems showed obvious inhibitory effects. Not only did the removal rates of COD and NH4+-N significantly decrease, but also the polysaccharide and protein content in the extracellular polymeric substances of the sludge microorganisms decreased significantly, as well as superoxide dismutase activity, thereby affecting the stability of the systems.
-

-
-
[1] ETEBU E, ARIKEKPAR I. Antibiotics: Classification and mechanisms of action with emphasis on molecular perspectives[J]. Applied Microbiology and Biotechnology, 2016, 4: 90-101. [2] KIM S C, CARLSON K. Temporal and spatial trends in the occurrence of human and veterinary antibiotics in aqueous and river sediment matrices[J]. Environmental Science & Technology, 2007, 41(1): 50-57. [3] WILLE K, NOPPE H, VERHEYDEN K, et al. Validation and application of an LC-MS/MS method for the simultaneous quantification of 13 pharmaceuticals in seawater[J]. Analytical and Bioanalytical Chemistry, 2010, 397: 1797-1808. doi: 10.1007/s00216-010-3702-z [4] MCARDELL C S, MOLNAR E, SUTER M J F, et al. Occurrence and fate of macrolide antibiotics in wastewater treatment plants and in the Glatt Valley Watershed, Switzerland[J]. Environmental Science & Technology, 2003, 37(24): 5479-5486. [5] CHENG D, LIU X, WANG L, et al. Seasonal variation and sediment–water exchange of antibiotics in a shallower large lake in North China[J]. Science of the Total Environment, 2014, 476: 266-275. [6] BARROS-BECKER F, ROMERO J, PULGAR A, et al. Persistent oxytetracycline exposure induces an inflammatory process that improves regenerative capacity in zebrafish larvae[J]. Plos One, 2012, 7(5): e36827. doi: 10.1371/journal.pone.0036827 [7] CZEKALSKI N, BERTHOLD T, CAUCCI S, et al. Increased levels of multiresistant bacteria and resistance genes after wastewater treatment and their dissemination into Lake Geneva, Switzerland[J]. Frontiers in Microbiology, 2012, 3: 18530. [8] MA W, YANG M, WANG J, et al. Treatment of antibiotics wastewater utilizing successive hydrolysis, denitrification and nitrification[J]. Environmental Technology, 2002, 23(6): 685-694. doi: 10.1080/09593330.2002.9619253 [9] 刘海英. 土霉素废水脱氮技术研究[D]. 石家庄: 河北科技大学, 2012. [10] 杨俊杰. 抗生素水体污染的处理方法研究[J]. 化工管理, 2018(33): 161-162. doi: 10.3969/j.issn.1008-4800.2018.33.110 [11] 李十中, 王淀佐, 胡永平等. 膜分离法回收土霉素结晶母液中的土霉素[J]. 中国抗生素杂志, 2002(1): 25-27. doi: 10.3969/j.issn.1001-8689.2002.01.007 [12] MCCARTY P L, BAE J, KIM J. Domestic wastewater treatment as a net energy producer–can this be achieved?[J]. Environmental Science & Technology, 2011, 45(17): 7100-710. [13] SCHERSON Y D, CRIDDLE C S. Recovery of freshwater from wastewater: upgrading process configurations to maximize energy recovery and minimize residuals[J]. Environmental Science & Technology, 2014, 48(15): 8420-8432. [14] REN L, WANG P, WANG C, et al. Algal growth and utilization of phosphorus studied by combined mono-culture and co-culture experiments[J]. Environmental Pollution, 2017, 220: 274-285. doi: 10.1016/j.envpol.2016.09.061 [15] UNNITHAN V V, UNC A, SMITH G B. Mini-review: a priori considerations for bacteria–algae interactions in algal biofuel systems receiving municipal wastewaters[J]. Algal Research, 2014, 4: 35-40. doi: 10.1016/j.algal.2013.11.009 [16] SHI X, YEAP T S, HUANG S, et al. Pretreatment of saline antibiotic wastewater using marine microalga[J]. Bioresource Technology, 2018, 258: 240-246. doi: 10.1016/j.biortech.2018.02.110 [17] WANG Y, HE Y, LI X, et al. Enhanced biodegradation of chlortetracycline via a microalgae-bacteria consortium[J]. Bioresource Technology, 2022, 343: 126149. doi: 10.1016/j.biortech.2021.126149 [18] ZHANG M, JI B, LIU Y. Microalgal-bacterial granular sludge process: a game changer of future municipal wastewater treatment?[J]. Science of the Total Environment, 2021, 752: 141957. doi: 10.1016/j.scitotenv.2020.141957 [19] ZENG X, GUO X, SU G, et al. Bioprocess considerations for microalgal-based wastewater treatment and biomass production[J]. Renewable and Sustainable Energy Reviews, 2015, 42: 1385-1392. doi: 10.1016/j.rser.2014.11.033 [20] 卢蕾, 马佳莹, 褚华强等. 基于菌藻共生的污水处理与资源化新技术研究进展[J]. 能源环境保护, 2023, 37(2): 156-167. [21] 张维玮, 孙贤波, 刘勇弟. 水中土霉素的紫外光解研究[J]. 水处理技术, 2018, 44(11): 33-37. [22] 张翠, 胡学锋, 骆永明. 模拟太阳光下水中土霉素的光化学降解[J]. 环境化学, 2016, 35(3): 430-438. doi: 10.7524/j.issn.0254-6108.2016.03.2015101303 [23] 廖芩. 好氧颗粒污泥系统处理四环素废水的效能与机理研究[D]. 重庆: 重庆大学, 2022. [24] 国家环境保护总局. 水和废水监测分析方法 (第四版)[M]. 北京: 中国环境科学出版社, 2002. [25] ZHANG H, SONG S, JIA Y, et al. Stress-responses of activated sludge and anaerobic sulfate-reducing bacteria sludge under long-term ciprofloxacin exposure[J]. Water Research, 2019, 164: 114964. doi: 10.1016/j.watres.2019.114964 [26] 史文燕. 四环素对SBR硝化系统脱氮性能及微生物群落结构的影响[D]. 兰州: 兰州交通大学, 2022. [27] SONG C, SUN X F, WANG Y K, et al. Fate of tetracycline at high concentrations in enriched mixed culture system: biodegradation and behavior[J]. Journal of Chemical Technology & Biotechnology, 2016, 91(5): 1562-1568. [28] XU X R, LI X Y. Sorption and desorption of antibiotic tetracycline on marine sediments[J]. Chemosphere, 2010, 78(4): 430-436. doi: 10.1016/j.chemosphere.2009.10.045 [29] 何嘉伟. 基于叶绿素a测定的监测方法研究与改进[J]. 工业微生物, 2023, 53(6): 1-3. doi: 10.3969/j.issn.1001-6678.2023.06.001 [30] 武鹏鹏, 王雅学, 沈洪艳. 土霉素对斜生栅藻的毒性效应研究[J]. 生态毒理学报, 2020, 15(4): 215-223. doi: 10.7524/AJE.1673-5897.20190703001 [31] DU B, YANG Q, LI X, et al. Impacts of long-term exposure to tetracycline and sulfamethoxazole on the sludge granules in an anoxic-aerobic wastewater treatment system[J]. Science of the Total Environment, 2019, 684: 67-77. doi: 10.1016/j.scitotenv.2019.05.313 [32] WANG X, ZHANG B, SHEN Z Q, et al. The EPS characteristics of sludge in an aerobic granule membrane bioreactor[J]. Bioresource Technology, 2010, 101(21): 8046-8050. doi: 10.1016/j.biortech.2010.05.074 [33] YANG S F, LIN C F, WU C J, et al. Fate of sulfonamide antibiotics in contact with activated sludge–sorption and biodegradation[J]. Water Research, 2012, 46(4): 1301-1308. doi: 10.1016/j.watres.2011.12.035 [34] 张微. 四环素与胞外聚合物的相互作用及其对污泥耐药性的影响[D]. 上海: 东华大学, 2014. [35] SUTHERLAND I W. Biofilm exopolysaccharides: a strong and sticky framework[J]. Microbiology, 2001, 147(1): 3-9. doi: 10.1099/00221287-147-1-3 [36] ZHUANG Y, YU F, MA J, et al. Enhanced adsorption removal of antibiotics from aqueous solutions by modified alginate/graphene double network porous hydrogel[J]. Journal of Colloid and Interface Science, 2017, 507: 250-259. doi: 10.1016/j.jcis.2017.07.033 [37] 邓万燕, 谢建平. 细菌核糖体靶向抗生素及耐药机制[J]. 国外医药(抗生素分册), 2017, 38(6): 20-30. [38] 应璐瑶, 王荣昌. 菌藻共生系统削减抗生素类污染物的去除途径及胁迫响应[J]. 化工进展, 2023, 42(1): 469-479. -



 下载:
下载: