-
随着药物、个人护理品、杀虫剂等各类有机化合物的广泛使用,大量有机微污染物在水源地水体中被检出[1-2]。这些有机微污染物浓度较低,且成分复杂,在使用传统的气相色谱-质谱联用技术(GC-MS)对其进行分析时,因样品成分较为复杂,会出现严重的峰重叠现象,且由于传统GC-MS峰容量与灵敏度较低,物质无法被充分检出[3]。
全二维气相色谱(GC×GC)通过将分离机理不同而又相互独立的2根色谱柱串联,分别根据物质的挥发性与极性对其进行正交分离,所得到的峰容量为2柱峰容量的乘积,因此,相比于传统的一维气相色谱,全二维气相色谱技术极大地提高了物质的分离度与峰容量[4-8]。此外,该技术还具有一维气相色谱所不具备的族分离效应与瓦片效应等优点,通过将全二维气相色谱与飞行时间质谱(TOFMS)联用,能够实现对复杂环境样本中大量有机物的充分检出[9-10]。通常所进行的污染物监测通过使用靶向筛查技术有针对性地对清单内污染物进行筛查,因此,可能会忽略未纳入清单但对人体或环境有潜在影响的化合物;而非靶向筛查技术能够克服这一缺陷,可对环境中广泛存在的各类未知化学物质进行监测[11-12]。将全二维气相色谱-飞行时间质谱联用技术(GC×GC-TOFMS)应用于化合物的非靶向筛查,能够充分体现其分离度好、峰容量大的巨大优势。GC×GC-TOFMS在环境领域的应用十分广泛, HOH等[13]利用GC×GC-TOFMS非靶向分析了大西洋海豚鲸脂中广泛的非极性、持久性和生物累积性污染物,共确定了24类271种化合物。其中86种为不经常用于靶向筛查的人为污染物,54种为卤化天然产物。GOMEZ等[14]建立了基于搅拌棒吸附萃取与GC×GC-TOFMS的新型分析方法,用于废水与河水中非极性或半极性污染物的自动搜索和评估,通过非靶向筛查检测出胆固醇及其降解产物、药物、工业品、农药与多氯联苯等靶向筛查未涵盖的新污染物。将GC×GC-TOFMS技术应用于水体环境中污染物的非靶向筛查已有部分研究,然而针对饮用水水源地水体污染物的研究还并不多见。GUO等[15]使用GC×GC-TOFMS对中国2个饮用水水源地水体中的嗅味物质进行筛查,建立了同时测定包括硫醚类、醛类、吡嗪类、苯系物和酚类在内54种常见化合物的测定方法。WANDA等[16]通过使用全二维气相色谱-高分辨飞行时间质谱联用技术对南非部分省份饮用水与污水中包括卡马西平、佳乐麝香、咖啡因、吐纳麝香、4-壬基酚和双酚A在内的新兴微污染物进行了定量研究。与以往研究相比,本研究对水源地水体中广泛存在的各类别未知有机物进行了全方位筛查与溯源工作。
本研究采用全二维气相色谱-飞行时间质谱(GC×GC-TOFMS)技术对我国长江下游地区3个饮用水水库中的有机物进行非靶向高通量筛查,通过建立有机物半定量识别方法进行物质种类与相对含量分析,同时对污染物来源进行推测,以期为GC×GC-TOFMS在重点流域的水质监测及饮用水水源地监测中的应用提供参考。
-
全二维气相色谱-飞行时间质谱(GC×GC-TOFMS)采用Agilent 7890气相色谱(美国Agilent公司)结合Pegasus 4D飞行时间质谱(美国Leco公司);采用Rtx-5色谱柱(30 m×0.25 mm×0.25 μm,美国Restek公司)为第1色谱柱,Rxi-17色谱柱(2.0 m×0.25 mm×0.25 μm,美国Restek公司)为第2色谱柱;正己烷(色谱纯,美国Fisher Scientific公司);无水硫酸钠、无水乙醇(分析纯,北京化学试剂厂);Milli-Q超纯水系统(美国Restek公司);0.45 μm玻璃纤维滤膜(美国Millipore公司)。
-
本研究选取的3个水库水源地位于长江流域下游,均属于县级水库水源地,样品采集于2021年1—2月,在1月与2月分别对3个水库各采样点进行一次采样分析。各点位整体化合物种类与水平差异性较小,故选取其中一次采样结果进行分析讨论,各采样水库信息见表1。LF、WH水库属小型水库;YX水库属中型水库,供水惠及40×104人,为所在地区主要水源地。3个水库总共设置9个采样点。YX水库设置5个采样点,分别位于水库东、南、西、北方向离岸垂直100 m的深水区与水库中心地带深水区;LF与WH水库各设置2个采样点,分别位于两水库东、西方向离岸垂直100 m的深水区。将各采样点所采集水样通过孔径0.45 μm玻璃纤维滤膜进行过滤去除悬浮颗粒物,之后进行液液萃取。将500 mL水样置于1 L分液漏斗中,加入萃取溶剂正己烷20 mL,在振荡器上进行15 min恒温(25 ℃)振荡;之后加入少许无水乙醇进行破乳,静置10 min,待有机相与水相分层后,取有机相于平底烧瓶中,加入少量无水硫酸钠除水,旋蒸浓缩至3 mL后,将样品置于KD浓缩瓶,氮吹并定容至0.1 mL,通过聚四氟乙烯膜将样品瓶封口,待进行仪器分析。
-
1) 气相色谱条件。载气为氦气,流速为1.4 mL·min−1;进样量为1 μL;进样温度为280 ℃;进样采用不分流模式;柱温程序:第1维气相色谱初始温度为60 ℃,保持1 min,之后以20 ℃·min−1的速度增加到100 ℃,保持1 min,以3 ℃·min−1的速度增加到310 ℃,保持5 min;第2维气相色谱各阶段柱温均比第1维高10 ℃;调制周期为10 s。
2) 质谱条件。离子化方式为电子轰击电离EI;离子源温度为240 ℃;扫描频率为200 Hz;扫描方式为m/z=40~900全扫描;分辨率为25 000;电离电压为70 eV。通过ChromaTOF软件对谱图数据进行分析处理,将谱图与NIST17标准谱库进行比对。分析空白样品,在实际样品中,对其信号进行扣除。在化合物鉴定过程中,筛选出信噪比大于10、与谱库匹配度大于750的化合物并计算其峰面积。
-
数据处理采用ChromaTOF软件完成,应用此软件进行基线校正、选峰和保留指数计算。通过在指定m/z范围内进行全扫,将所得质谱图与标准谱库进行比对,筛选出匹配化合物。记录化合物名称、CAS号、第1维保留时间、第2维保留时间、峰面积、相对分子质量等相关特征信息,以便进一步筛选。通过对比筛查出化合物的保留指数(RI)与谱库文献值中该物质保留指数(Lib. RI),进一步筛选出相对保留指数偏差在± 10%之内的匹配物质。所得化合物当中可能出现同一物质对应多个匹配结果的现象,此时将多个结果与保留指数进行对比,偏差度最小的结果视为正确,记录其相关信息,排除其余的错误匹配结果。记录此方法筛查出的全部化合物并进行下一步研究。
-
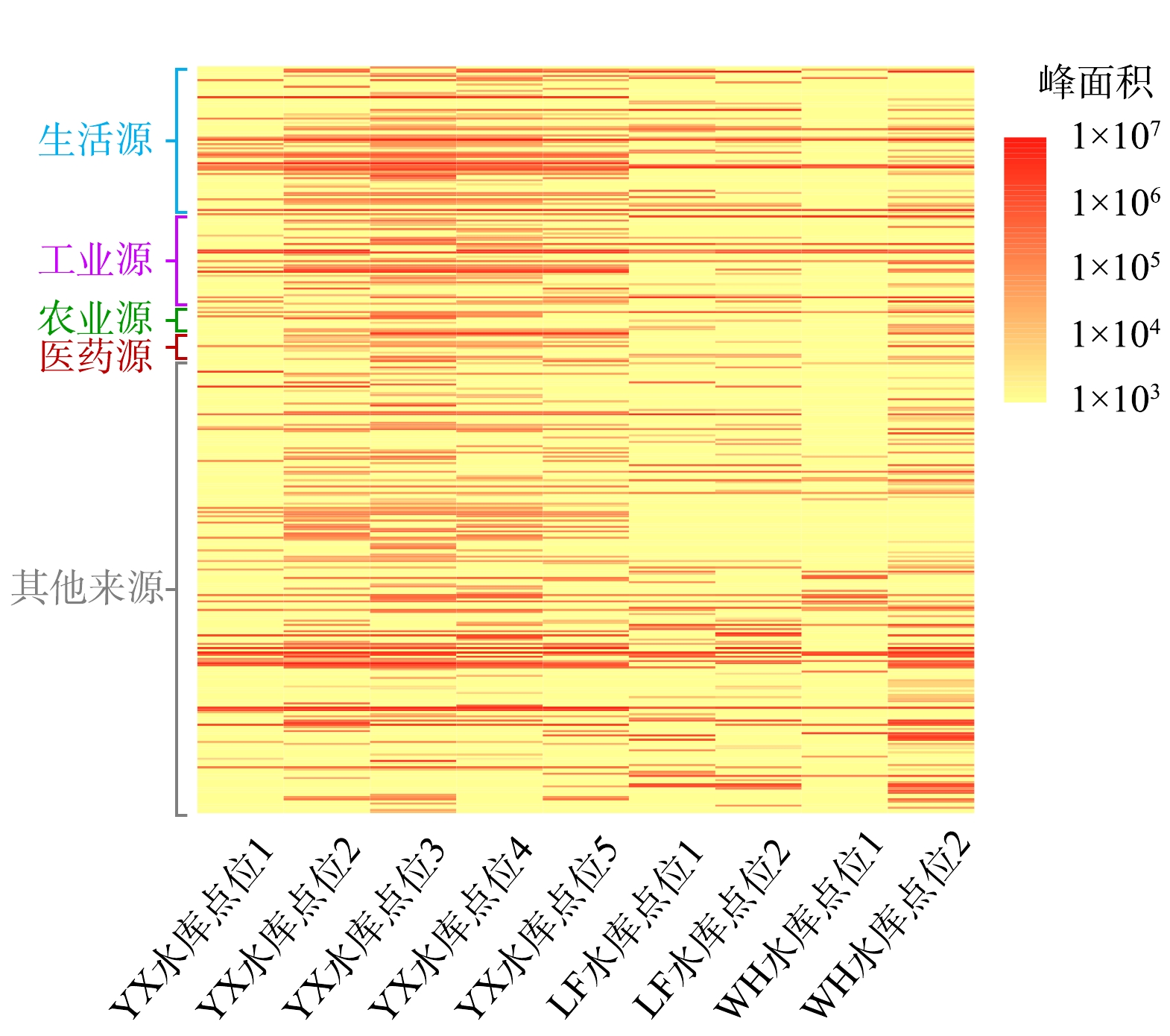
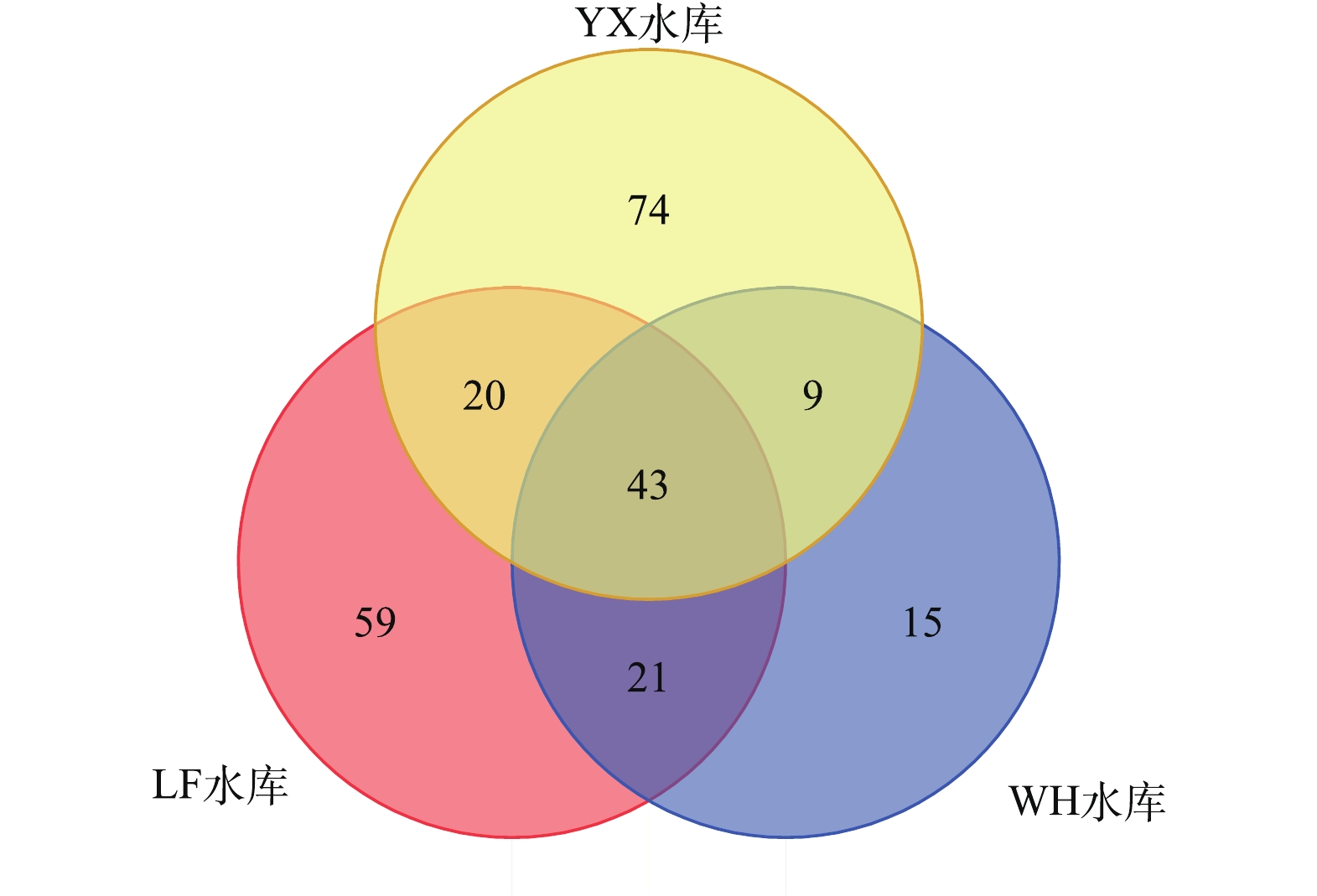
本研究在3个水库中总共设置9个采样点,其中YX水库设置5个采样点,LF水库设置2个采样点,WH水库设置2个采样点。对各水库所检出有机物的差异性进行分析研究,结果如图1所示。可以看出,不同水库水体所检出有机物具有一定差异性,YX水库与其余2水库相比差异性较为明显,可能由于此水库周围地区的工农业生产类型与地理环境与其余2水库地区存在一定差异,从而具有不同的特征污染物。WH水库与其他水库的物质类别差异较小,具有较大重叠。在3个水库中均被检出的共有43种物质,其详细信息如表2所示。在各水库均有检出的物质中,约50%为饱和烷烃(10种)与酯类(10种)物质,推测饱和烷烃类物质可能经由动植物残体或石油烃等途径进入水体中,而酯类物质在日常生活中被大量应用,从而在环境水体中普遍存在。
在各采样点中,峰面积普遍较高的几种物质包括棕榈酸、2,2,4-三甲基-1,3-戊二醇二异丁酸酯、植烷、正十九烷与正二十七烷。其中棕榈酸在自然界中广泛存在,几乎所有油脂中均有含量不等的棕榈酸组分,食用油与地沟油中的主要成分是甘油三酯,氧化时会产生大量的游离脂肪酸,其主要成分是棕榈酸[17]。2,2,4-三甲基-1,3-戊二醇二异丁酸酯(TXIB)是一种小分子多元醇结构的增塑剂,广泛应用于化妆品薄膜、塑料门窗、乳液黏合剂、油墨、皮革等方面[18]。棕榈酸与TXIB的大量检出可能与水库处于人口密集地区紧密相关。植烷是最为常见的规则类异戊二烯结构饱和烷烃之一,其来源丰富,可由陆地植物的叶绿素在一定条件下转化而成,也可由水生的浮游藻类生成,其在石油烃中也广泛存在[19]。正十九烷与正二十七烷是水体中常见的正构烷烃类物质。
-
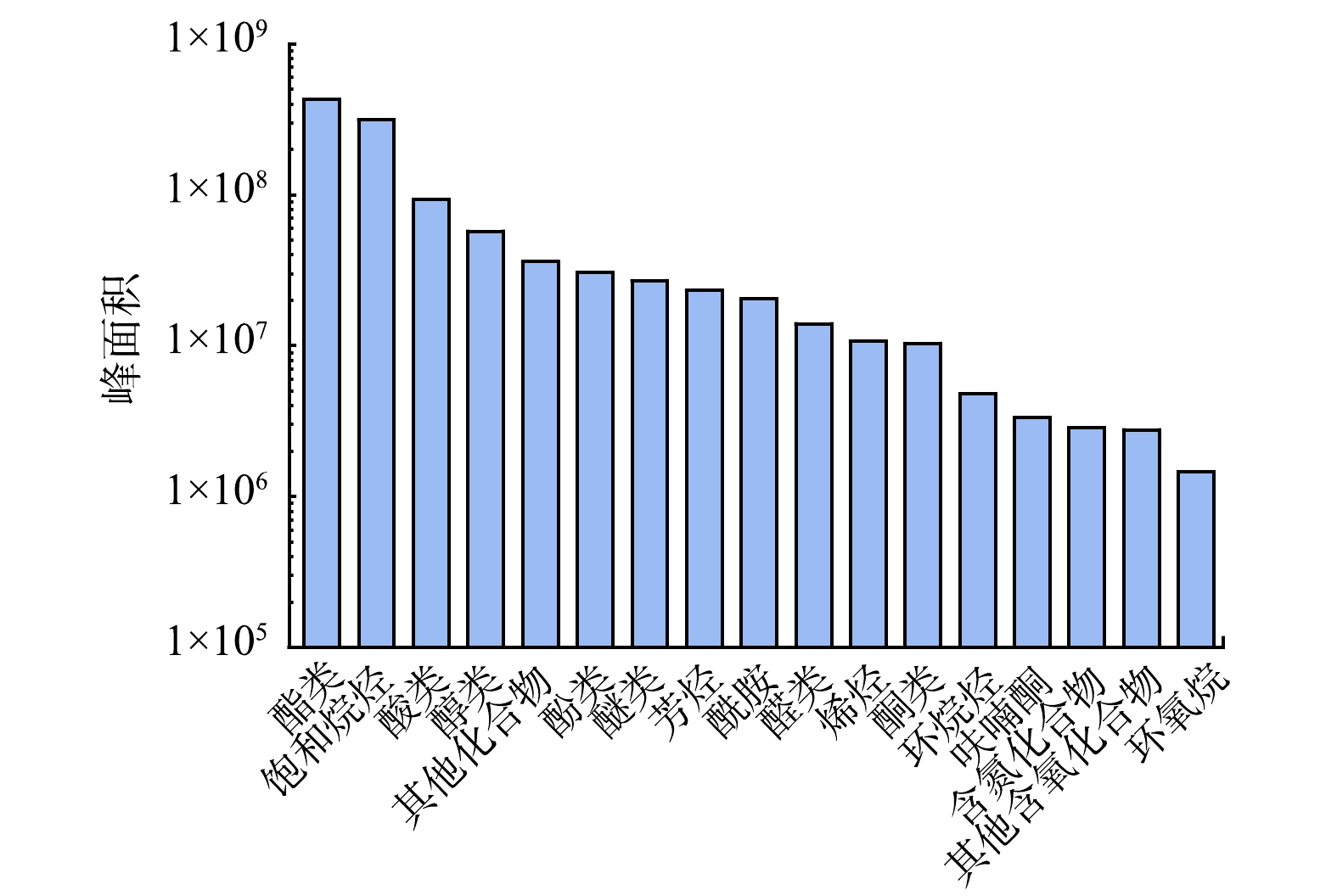
以YX水库为研究对象,因YX水库的5个采样点整体化合物种类与水平差异性不大,故选取其中一个采样点,对其化合物进行分析,此采样点各类别化合物峰面积如图2所示。可以看出,此采样点水样中各类化合物的检出峰面积整体差异不大,酯类、饱和烷烃、酸类化合物峰面积相对较高。饱和烷烃中检出量最高的为正二十七烷,约占饱和烷烃总峰面积的1/5。酯类化合物中检出量最高的为邻苯二甲酸二丁酯,约占酯类化合物总检出峰面积的1/3,邻苯二甲酸二丁酯是一种常用的增塑剂[20]。酸类化合物中检出量最高的为棕榈酸,约占酸类化合物总峰面积的50%,其主要作为化妆品的原料。因酯类化合物在生活中大量应用,酸类化合物在生活、工业与药物医药中大量应用,所以这些化合物的大量检出标志着水库周边地区人类活动与工业生产造成的排放对库区水体有很大的影响。
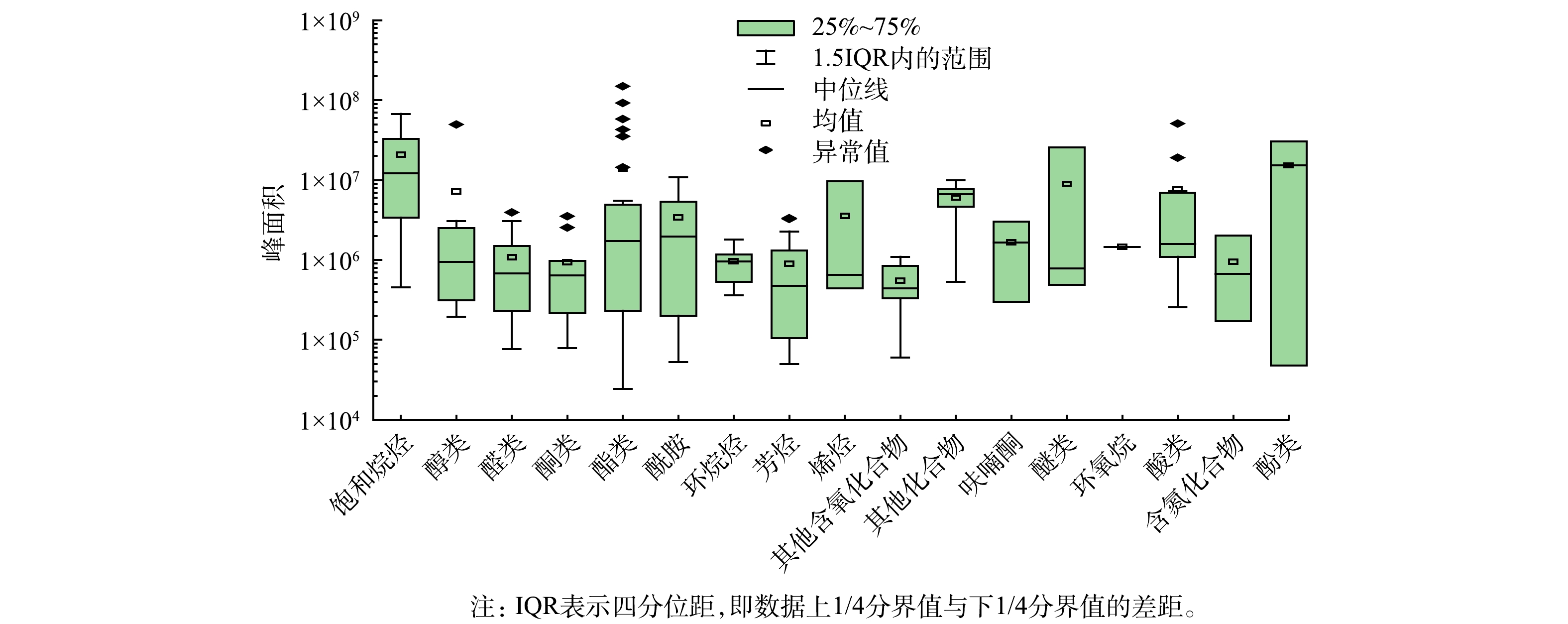
将上述采样点位各类化合物的峰面积差异性使用盒须图表示。如图3所示,此采样点所检测到的饱和烷烃类物质峰面积普遍较高,而醛类、酮类、环烷烃、芳烃、其他含氧化合物的检出量普遍较低,酚类物质的峰面积差异性较大,总体检出量较高。
-
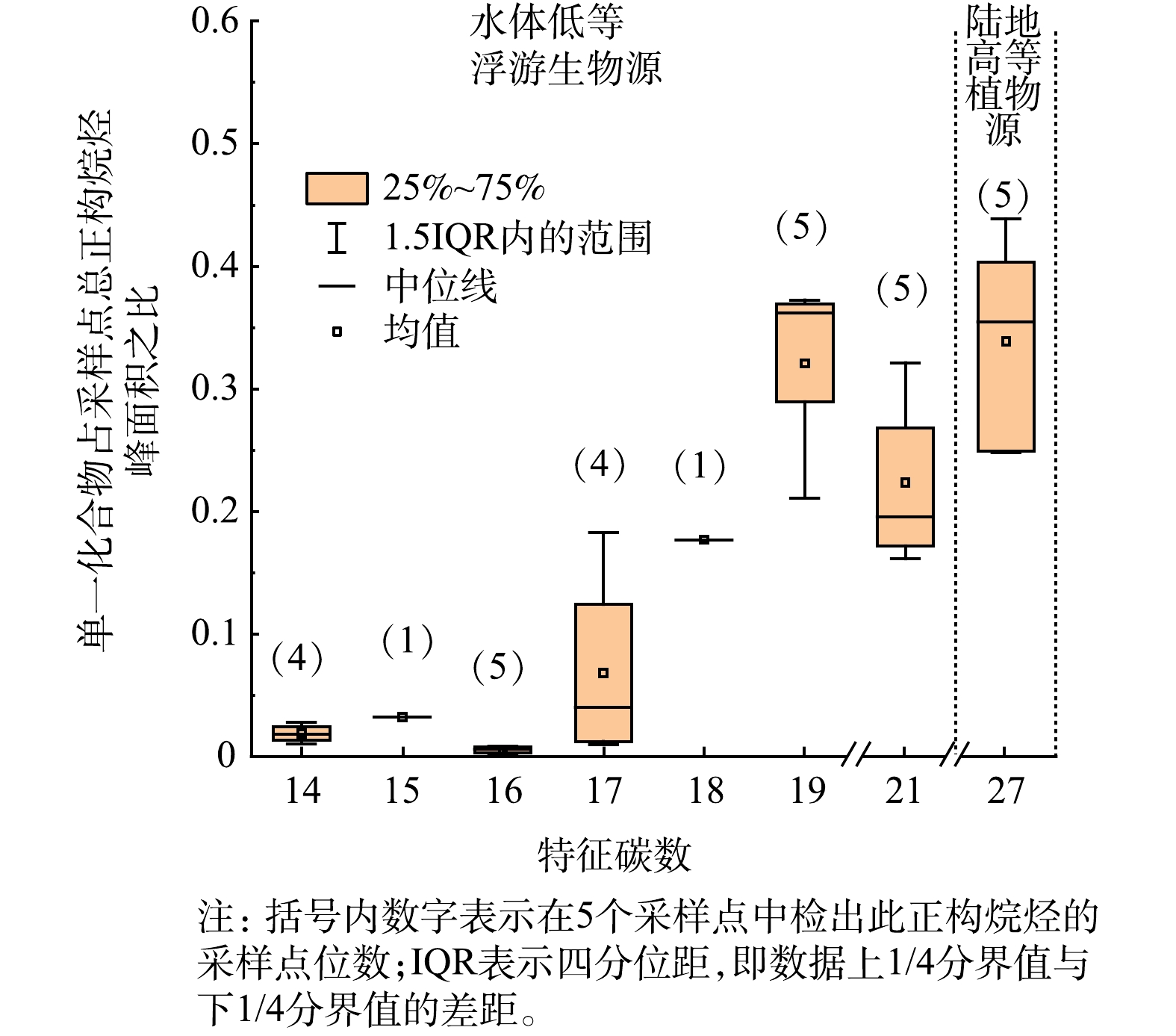
1)正构烷烃来源分析。正构烷烃是一类直链的饱和烃类,碳分子数分布具有自然的连续性,这些分子具有高键能的碳-碳键,这使其结构稳定,不易降解。本研究中各采样点检出的正构烷烃特征碳数为14~36 (采用C14~C36的形式来表示)。不同来源的正构烷烃通常具有不同的组成特征,低等浮游生物的正构烷烃主要为短链正构烷烃,碳数主要在C20以内;高等植物来源的正构烷烃分布在C27~C33,并且具有奇碳数优势,特征碳数为C27、C29、C31;以化石燃料燃烧或石油烃污染为来源的正构烷烃碳数分布广泛,没有奇偶性特征[21-22]。正构烷烃是一种重要的生物标志物,解析其在水体中的来源对防治水体污染具有重要意义。
选取YX水库作为研究对象,此水库各采样点的C14~C36正构烷烃分布特征如图4所示。水体中未检出的正构烷烃在图4中未显示,C15与C18分别只在一个采样点有检出。由图4可以看出,正构烷烃的分布呈现双峰型分布特征,短链主要以C17、C19、C21为组成部分,具有较大的奇碳数优势,长链只检测出C27。检出最多的正构烷烃为C19和C27,且2种物质的检出量差异不大。由此可以看出,水体中正构烷烃绝大部分来源为水体低等浮游生物源与陆地高等植物源,且2种来源对水体正构烷烃的贡献都较大。检出的正构烷烃有很大的奇碳数优势,且C22~C26这些中等碳链正构烷烃在全部样品中未检出,表明水体基本没有受化石燃料燃烧或石油烃污染,整体水质较好。
2)其他污染物来源分析。以YX水库为研究对象,对各点位污染物进行来源统计分析。通过污染物种类及含量,分析水体主要污染物,推测污染来源。将通过非靶向筛查与软件定性分析所检测出的有机污染物分为5类,分别为生活源、工业源、药物医药源、农业源、其他来源,结果如表3所示。对所检出化合物进行分析,除其他来源外,疑似污染源为生活源与工业源的污染物占所检测总污染物的绝大多数。生活源污染物检出量最大,峰面积占比为22.87%~32.80%,检出污染物16~43种;工业源污染物峰面积占比为11.93%~22.08%,检出污染物11~27种;药物医药源污染物峰面积占比为0.24%~5.49%,检出污染物1~11种;农业源污染物检出量最小,峰面积占比为0.14%~1.31%,检出污染物2~6种。这进一步表明,YX水库周边地区人口密集、工业产业发达对水库水体造成了一定影响。由李昆等[23]对水库水体有机物高通量筛查的研究可以看出,经过网箱清理后的2018年的数据与未进行清理的2017年的数据相比,共性有机物有44种,其中食品添加剂12种,工业生产中间体11种,增塑剂8种,杀虫剂4种,表明生活来源和工业来源的有机物占水体总有机物的绝大多数。这与本研究所关注水体的污染物来源相类似。
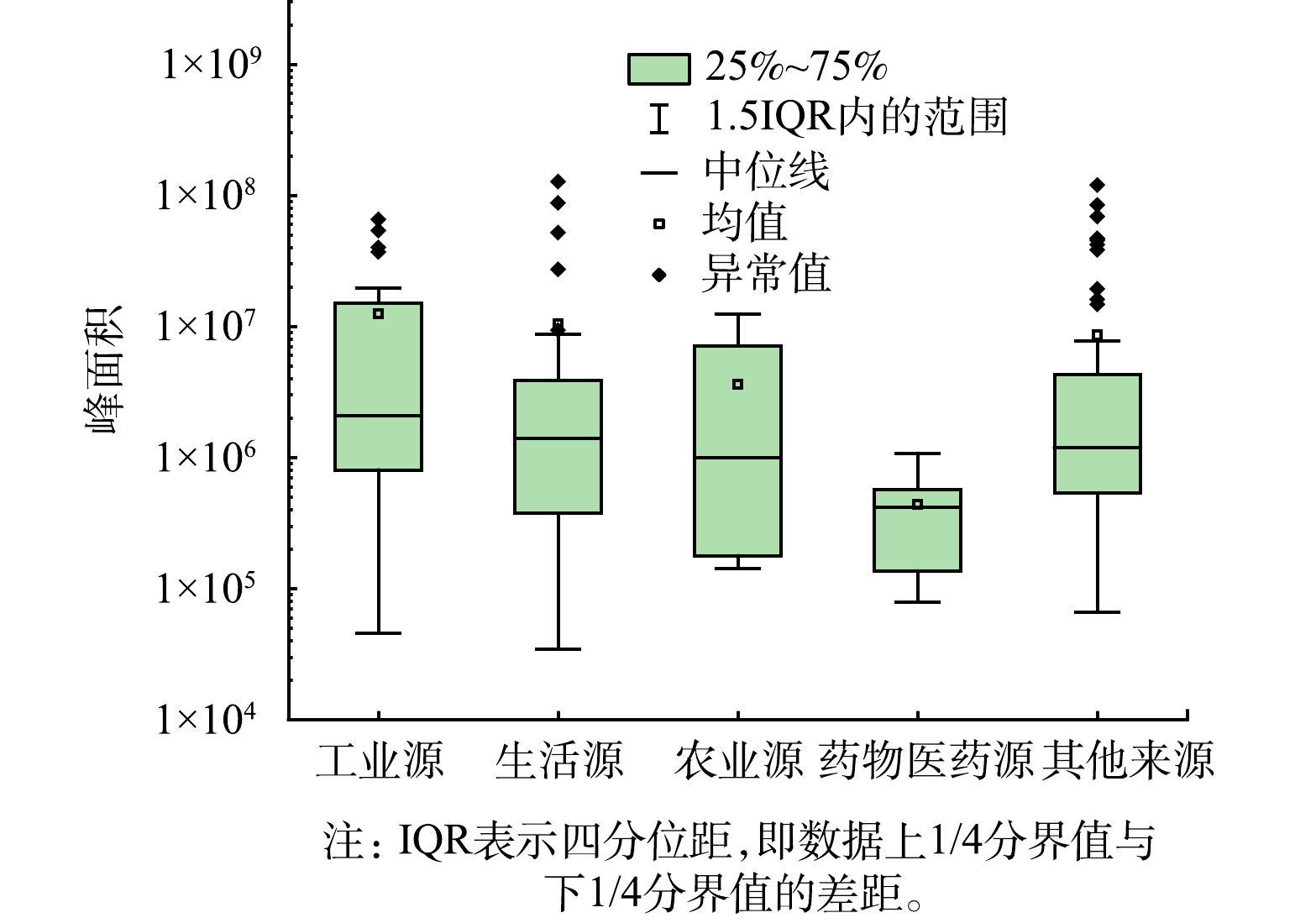
选取YX水库5个采样点中的一个样本,将此点位各来源污染物的峰面积差异性使用盒须图表示。如图5所示,此采样点位工业源与生活源污染物峰面积普遍较高,这与当地处于经济发达的城镇地区密切相关。农业源污染物的峰面积区间较大,虽然采样季节为冬季,但农业源污染物仍有一定量的检出,这可能由于此时当地仍存在一定的农业活动。药物医药源污染物的峰面积普遍较低,仅有少量检出,表明水库地区受药物的污染影响相对较小。生活源中有个别污染物的峰面积远高于其他污染物,峰面积最高的2种污染物分别为棕榈酸和2,2,4-三甲基-1,3-戊二醇二异丁酸酯。工业源中所检测出峰面积最高的2种污染物分别为邻苯二甲酸二丁酯(DBP)与邻苯二甲酸二(2-乙基己基)酯(DEHP)。这2种污染物都属于邻苯二甲酸酯类(phthalic acid esters, PAEs)物质,此类物质被广泛用作增塑剂与软化剂,同时也是一类常见的环境激素类持久性有机污染物,PAEs可导致免疫系统失调,对人类的生殖系统功能会产生较大影响[24-26]。DBP与DEHP对人体具有较大危害,是《地表水环境质量标准》(GB 3838-2002)的必检项目[27]。库区水体中PAEs的检出需引起管理部门的重视,应加强对相关排放源的监管力度,以避免潜在影响的发生。
对3个水库共9个采样点位所检出的有机物进行汇总,峰面积如图6所示。由图6可以看出,3个水库的污染物检出种类具有一定差异。这说明地区的差异性与工业、农业、医药等生产类别的不同,排放到水体当中的污染物种类也不尽相同。与LF、WH水库相比,YX水库各来源污染物峰面积均普遍较高,物质类别也存在着明显差异。在YX水库所检出的生活源与工业源污染物中,通常用作橡胶与化妆品生产的硬脂酸、食用油氧化产物棕榈酸、用作塑料制品增塑剂的2,2,4-三甲基-1,3-戊二醇二异丁酸酯以及用于涂料、油墨等行业的异辛酸、橡胶、塑料制品防老剂2,6-二叔丁基-4-甲基苯酚等物质峰面积较高。这可能与YX水库周边地区人口密集,塑料、橡胶等相关工业产业较为发达有关。YX水库中农业源与医药源污染物的大量检出也可能为此地区人口密度较高所致。LF水库与其余2水库相比,芥酸酰胺与油酸酰胺有较大检出量,这2种物质在油墨、染料等行业应用广泛。酰胺类物质的大量检出可能与此地区周边存在印刷与印染厂有关。本研究检出物质中的某些化合物用途尚不清楚,故将其列为其他来源化合物。其中的一些物质可能为进入至水体中污染物的降解产物,还需通过今后的工作对其进行进一步研究。
检出物质来源分析表明,全二维气相色谱-飞行时间质谱技术可用于水源地水体中大量挥发性、半挥发性未知有机污染物的非靶向筛查,并能够通过对所筛查出污染物的种类与峰面积进行对比进一步推测此地区的主要污染来源。
-
1)采用全二维气相色谱-飞行时间质谱对长江下游YX水库、LF水库和WH水库水源水中挥发性、半挥发性未知有机污染物进行了非靶向筛查。YX水库、LF水库和WH水库检出有机物分别为146、143、88种,其中有43种有机物在3个水库均被检出。
2)在YX水库、LF水库和WH水库各类检出物质中,饱和烷烃、酯类化合物峰面积普遍较高,检出丰度较高的物质包括棕榈酸、2,2,4-三甲基-1,3-戊二醇二异丁酸酯、植烷等。
3) YX水库、LF水库和WH水库的污染物检出种类具有一定差异性。在检出污染物中,绝大多数污染物来源于生活源与工业源,故应继续加强水库生活源、工业源点源污染控制。
基于全二维气相色谱-飞行时间质谱(GC×GC-TOF MS)技术对长江下游水源水中未知有机物的高通量筛查
High-throughput screening of unknown organics in water body of water sources in the lower reaches of the Yangtze River by GC×GC-TOFMS
-
摘要: 为全面了解长江下游水源水中未知有机物组成及其相对含量,判断水质特征、评估生态风险,采用全二维气相色谱-飞行时间质谱联用技术(GC×GC-TOFMS)对我国长江下游地区3个饮用水水库(YX水库、LF水库、WH水库)中的有机物进行非靶向半定量筛查,并进行污染物溯源分析。结果表明:YX、LF、WH水库分别检出有机物146、143、88种;3个水库均检出的有机物共43种,包括饱和烷烃10种、脂类物质10种;YX水库中正构烷烃呈现较多短链与长链的双峰型分布特征,其绝大部分来源为水体低等浮游生物源与陆地高等植物源,且2种来源对正构烷烃总量都有较大贡献;3个水库中有机微污染物主要来源于生活源与工业源,YX水库各采样点生活源污染物检出16~43种,峰面积占比为22.87%~32.80%,工业源污染物检出11~27种,峰面积占比为11.93%~22.08%;不同水库水体检出有机物的种类、来源均具一定差异性,根据地区的差异与工业、农业、医药等生产类别的不同,排放至水体中的污染物种类不尽相同。全二维气相色谱−飞行时间质谱联用技术对于水体未知污染物的识别具有巨大优势,在污染物筛查领域有着良好的应用前景。本研究成果可为长江下游水源地水体微污染物控制工作提供参考。
-
关键词:
- 全二维气相色谱-飞行时间质谱(GC×GC-TOFMS) /
- 有机组分 /
- 非靶向分析 /
- 水源
Abstract: In order to comprehensively understand the unknown organic composition and relative content of water sources in the lower Reaches of the Yangtze River, judge water quality characteristics and assess ecological risks, this study conducted non targeted semi quantitative screening of organic matter in three drinking water reservoirs (YX Reservoir, LF Reservoir, WH Reservoir) in the Lower Reaches of the Yangtze River in China by using comprehensive two-dimensional gas chromatography coupled to time-of-flight mass spectrometry (GC×GC-TOFMS), and speculated the source of pollutants. The results showed that 146, 143 and 88 organic compounds were detected in YX, LF and WH Reservoirs, respectively. There were 43 kinds of organic compounds detected in all three reservoirs, including 10 kinds of saturated alkanes and 10 kinds of lipids. The distribution characteristics of n-alkanes in the water body of YX Reservoir were bimodal with short chain and long chain, most of n-alkanes came from plankton and land plants, and both of them contributed greatly to n-alkanes in the water. The organic micropollutants in the three reservoirs mainly came from domestic and industrial sources, 16~43 kinds of domestic source pollutants were detected at each sampling point, and the peak area of them accounted for 22.87%~32.80%, 11~27 kinds of industrial source pollutants were detected at each sampling point, and the peak area of them accounted for 11.93%~22.08%. The types and sources of organic compounds detected in different reservoirs were different to some extent. According to the regional differences and the different production categories of industry, agriculture and medicine, the types of pollutants discharged into water bodies were different. Comprehensive two-dimensional gas chromatography coupled to time-of-flight mass spectrometry has great advantages in the identification of unknown pollutants in water, and it has a good application prospect in the field of pollutant screening. The results of this study can provide a reference for the control of micropollutants in water sources of the lower Reaches of the Yangtze River. -

-
表 1 各采样水库信息概述
Table 1. Overview of information of each sampling reservoir
水库名称 总库容/
(104 m3)水库深
度/m所在地区主要工业产业 YX水库 1.5 80 金属冶炼、化工、造纸、
橡胶和塑料制品LF水库 0.15 125 锁具、服装、造纸 WH水库 0.65 350 服装、纺织 注:YX水库属中型水库;LF、WH水库属小型水库。 表 2 3个水库共同检出的43种化合物信息
Table 2. Information of 43 compounds detected in all three reservoirs
化合物 CAS号 分子组成 化合物 CAS号 分子组成 2-甲基二十八烷 1560-98-1 C29H60 正二十一烷 629-94-7 C21H44 2-甲基十八烷 1560-88-9 C19H40 2-甲基二十烷 1560-84-5 C21H44 植烷 638-36-8 C20H42 苯甲酸乙基己酯 5444-75-7 C15H22O2 1,4-二甲基萘 571-58-4 C12H12 (±)-3-羟基-r-丁内酯 5469-16-9 C4H6O3 1,6-二甲基萘 575-43-9 C12H12 3,5-二叔丁基-4-羟基苯甲醛 1620-98-0 C15H22O2 正十六烷 544-76-3 C16H34 棕榈酸 57-10-3 C16H32O2 正十九烷 629-92-5 C19H40 二苯甲酮 119-61-9 C13H10O 3-甲基十七烷 6418-44-6 C18H38 正癸酸 334-48-5 C10H20O2 正二十七烷 593-49-7 C27H56 3-十三酮 1534-26-5 C13H26O 2,6,10-三甲基十二烷 3891-98-3 C15H32 正癸醛 112-31-2 C10H20O 7,9-二叔丁基-1-氧杂螺[4.5]
癸-6,9-二烯-2,8-二酮82304-66-3 C17H24O3 苯氧乙醇 122-99-6 C8H10O2 邻苯二甲酸二丁酯 84-74-2 C16H22O4 2,6-二(叔丁基)-4-羟基-4-甲基-
2,5-环己二烯-1-酮10396-80-2 C15H24O2 邻苯二甲酸二异丁酯 84-69-5 C16H22O4 3-(3,5-二叔丁基-4-羟
基苯基)丙酸十八酯2082-79-3 C35H62O3 邻苯二甲酸二甲酯 131-11-3 C10H10O4 十六酸乙酯 628-97-7 C18H36O2 2,6-二叔丁基-4-甲基苯酚 128-37-0 C15H24O 十一醛 112-44-7 C11H22O 十二醛 112-54-9 C12H24O (+)-雪松醇 77-53-2 C15H26O 邻苯二甲酸二乙酯 84-66-2 C12H14O4 邻苯二甲酸二
(2-乙基己基)酯117-81-7 C24H38O4 十七烷-3-酮 84534-29-2 C17H34O 壬醛 124-19-6 C9H18O 己内酰胺 105-60-2 C6H11NO N,N-二丁基甲酰胺 761-65-9 C9H19NO 芥酸酰胺 112-84-5 C22H43NO 十六甲基环八硅氧烷 556-68-3 C16H48O8Si8 十二甲基环六硅氧烷 540-97-6 C12H36O6Si6 苯并噻唑 95-16-9 C7H5NS 2,2,4-三甲基-1,3-戊
二醇二异丁酸酯6846-50-0 C16H30O4 表 3 YX水库各来源污染物峰面积占比与采样点污染物种类数
Table 3. Proportion of peak area of pollutants from each source and the number of pollutants in a single sampling point in YX Reservoir
来源 峰面积占比/% 采样点污染物种类数 生活源 22.87~32.80 16~43 工业源 11.93~22.08 11~27 药物医药源 0.24~5.49 1~11 农业源 0.14~1.31 2~6 其他来源 40.78~59.42 33~89 -
[1] TANG Y K, ZHONG Y X, LI H L, et al. Contaminants of emerging concern in aquatic environment: Occurrence, monitoring, fate, and risk assessment[J]. Water Environment Research, 2020, 92(10): 1811-1817. doi: 10.1002/wer.1438 [2] VASILACHI I C, ASIMINICESEI D M, FERTU D I, et al. Occurrence and fate of emerging pollutants in water environment and options for their removal[J]. Water, 2021, 13(2): 181. doi: 10.3390/w13020181 [3] MOSTAFA A, GORECKI T. Sensitivity of comprehensive two-dimensional gas chromatography (GC×GC) versus one-dimensional gas chromatography (1D GC)[J]. LC GC Europe, 2013, 26(12): 672-679. [4] KRUVE A, KIEFER K, HOLLENDER J. Benchmarking of the quantification approaches for the non-targeted screening of micropollutants and their transformation products in groundwater[J]. Analytical and Bioanalytical Chemistry, 2021, 413(6): 1549-1559. doi: 10.1007/s00216-020-03109-2 [5] SGORBINI B, CAGLIERO C, BOGGIA L, et al. Parallel dual secondary-column-dual detection comprehensive two‐dimensional gas chromatography: A flexible and reliable analytical tool for essential oils quantitative profiling[J]. Flavour and Fragrance Journal, 2015, 30(5): 366-380. doi: 10.1002/ffj.3255 [6] STILO F, LIBERTO E, REICHENBACH S E, et al. Exploring the extra-virgin olive oil volatilome by adding extra dimensions to comprehensive two-dimensional gas chromatography and time-of-flight mass spectrometry featuring tandem ionization: Validation of ripening markers in headspace linearity conditions[J]. Journal of AOAC International, 2021, 104(2): 274-287. doi: 10.1093/jaoacint/qsaa095 [7] EISERBECK C, NELSON R K, GRICE K, et al. Comparison of GC-MS, GC-MRM-MS, and GC×GC to characterise higher plant biomarkers in Tertiary oils and rock extracts[J]. Geochimica et Cosmochimica Acta, 2012, 87: 299-322. doi: 10.1016/j.gca.2012.03.033 [8] MURRAY J A. Qualitative and quantitative approaches in comprehensive two-dimensional gas chromatography[J]. Journal of Chromatography A, 2012, 1261: 58-68. doi: 10.1016/j.chroma.2012.05.012 [9] MUSCALU A M, GORECKI T. Comprehensive two-dimensional gas chromatography in environmental analysis[J]. TrAC Trends in Analytical Chemistry, 2018, 106: 225-245. doi: 10.1016/j.trac.2018.07.001 [10] MAZUR D M, ZENKEVICH I G, ARTAEV V B, et al. Regression algorithm for calculating second-dimension retention indices in comprehensive two-dimensional gas chromatography[J]. Journal of Chromatography A, 2018, 1569: 178-185. doi: 10.1016/j.chroma.2018.07.038 [11] CCANCCAPA-CARTAGENA A, PICO Y, ORTIZ X, et al. Suspect, non-target and target screening of emerging pollutants using data independent acquisition: Assessment of a Mediterranean River basin[J]. Science of the Total Environment, 2019, 687: 355-368. doi: 10.1016/j.scitotenv.2019.06.057 [12] GAGO-FERRERO P, SCHYMANSKI E L, BLETSOU A A, et al. Extended suspect and non-target strategies to characterize emerging polar organic contaminants in raw wastewater with LC-HRMS/MS[J]. Environmental Science & Technology, 2015, 49(20): 12333-12341. [13] HOH E, DODDER N G, LEHOTAY S J, et al. Nontargeted comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry method and software for inventorying persistent and bioaccumulative contaminants in marine environments[J]. Environmental Science & Technology, 2012, 46(15): 8001-8008. [14] GOMEZ M J, HERRERA S, SOLE D, et al. Automatic searching and evaluation of priority and emerging contaminants in wastewater and river water by stir bar sorptive extraction followed by comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry[J]. Analytical Chemistry, 2011, 83(7): 2638-2647. doi: 10.1021/ac102909g [15] GUO Q Y, LI X, YU J W, et al. Comprehensive two-dimensional gas chromatography with time-of-flight mass spectrometry for the screening of potent swampy/septic odor-causing compounds in two drinking water sources in China[J]. Analytical Methods, 2015, 7(6): 2458-2468. doi: 10.1039/C4AY03026E [16] WANDA E M M, NYONI H, MAMBA B B, et al. Occurrence of emerging micropollutants in water systems in Gauteng, Mpumalanga, and North West Provinces, South Africa[J]. International Journal of Environmental Research and Public Health, 2017, 14(1): 79. doi: 10.3390/ijerph14010079 [17] 徐伊静, 颜诗婷, 李佳敏, 等. 硅胶固载磺酸功能化离子液体催化棕榈酸制备生物柴油的工艺研究[J]. 中国粮油学报, 2019, 34(10): 42-48. doi: 10.3969/j.issn.1003-0174.2019.10.008 [18] 魏斌, 杜虎, 鲁墨弘, 等. 环保增塑剂 2, 2, 4-三甲基-1, 3-戊二醇二异丁酸酯的合成[J]. 精细石油化工, 2017, 34(6): 54-58. doi: 10.3969/j.issn.1003-9384.2017.06.012 [19] 郭威. 珠江口水体和沉积物有机碳的来源及其生物地球化学特征[D]. 北京: 中国科学院研究生院(广州地球化学研究所), 2016. [20] 曹龙, 张朝升, 陈秋丽, 等. 邻苯二甲酸酯的环境污染和生态行为及毒理效应研究进展[J]. 生态毒理学报, 2018, 13(2): 34-46. doi: 10.7524/AJE.1673-5897.20170829001 [21] PRAHL F G, ERTEL J R, GONI M A, et al. Terrestrial organic carbon contributions to sediments on the Washington margin[J]. Geochimica et Cosmochimica Acta, 1994, 58(14): 3035-3048. doi: 10.1016/0016-7037(94)90177-5 [22] 冯精兰, 席楠楠, 张飞, 等. 黄河河南段水体中正构烷烃的分布特征与来源解析[J]. 环境科学, 2016, 37(3): 893-899. doi: 10.13227/j.hjkx.2016.03.013 [23] 李昆, 赵晓辉, 李科林, 等. 潘家口水库水体中有机物分布特征及变化趋势分析[J]. 人民珠江, 2020, 41(8): 98-102. doi: 10.3969/j.issn.1001-9235.2020.08.015 [24] 高静静, 陈丽玮, 王宜青, 等. 一株邻苯二甲酸二 (2-乙基己基) 酯 (DEHP) 高效降解菌的筛选及其降解特性[J]. 环境化学, 2016, 35(11): 2362-2369. doi: 10.7524/j.issn.0254-6108.2016.11.2016040103 [25] 王笑妍, 薛燕波, 者东梅, 等. 邻苯二甲酸酯类增塑剂概况及法规标准现状[J]. 中国塑料, 2019, 33(6): 95-105. doi: 10.19491/j.issn.1001-9278.2019.06.016 [26] 张悦, 袁骐, 蒋玫, 等. 邻苯二甲酸酯类毒性及检测方法研究进展[J]. 环境化学, 2019, 38(5): 1035-1046. [27] 国家环境保护总局, 国家质量监督检验检疫总局. 地表水环境质量标准: GB 3838-2002[S]. 北京: 中国环境科学出版社, 2002. -



 下载:
下载: