-
随着我国的畜禽养殖业不断向规模化、集约化方向发展,养猪废水的治理与资源化利用备受关注[1]。其中,诸多研究(包括课题组前期研究)均指出,当养猪废水依次经过预处理和生化处理后,其中的污染物虽可被大幅削减,但污水中仍含有较高浓度的氮素(以NH4+-N和NO3−-N为主),且其碳氮比(C/N)通常低于6∶1[2-4]。为此,需对猪场废水进行深度处理,以降低其对水环境的威胁。人工湿地(CW)目前被广泛用于养猪废水深度处理[5],然而,鉴于上述污水水质特点,且考虑到CW工艺常因复氧能力不足和有机碳源匮乏而导致其脱氮效果欠佳[6-7],如将该技术用于深度处理猪场废水,须对其脱氮性能进行优化。
近年来,强化CW中的厌氧氨氧化(ANAMMOX)作用成为改善该工艺脱氮效能的新途径[8]。一些研究[9-11]均表明,ANAMMOX反应的发生及其与硝化/反硝化作用的耦合可显著提升CW的TN去除率。为使CW达到理想的猪场废水深度处理效果,作者在前期研究中利用已构建的复合潜流人工湿地(HCW),采取浸润线调控和分段进水措施优化了湿地填料层中溶解氧(DO)及有机碳源的浓度及分布,从而使ANAMMOX作用在系统中得以发生,并在一定程度上实现了其与反硝化的协同作用。然而,研究结果同时表明,该HCW的复氧能力仍显不足,其NH4+-N氧化能力偏低。众所周知,NOx−-N的稳定获取是确保反硝化过程和ANAMMOX反应顺利进行的前提[12],如NH4+-N氧化过程受阻,HCW的脱氮性能存在恶化风险。鉴于此,有必要采取一定措施提高HCW的复氧性能,以便尽可能地维持该系统高水平的硝化性能及TN去除率。
为了强化CW工艺的复氧性能,有研究尝试通过改进系统运行方式、优化系统构型以及布设曝气管等措施调控填料层中的DO[13]。然而,上述手段的采用均会不同程度地引起CW系统建设运行费用的增加及其操作难度的提高。拔风管作为一种被动增氧设施,近年来常被布设于CW中用于改善其复氧性能[14]。鉴于该设备较理想的复氧效率[15],如能在HCW中布设适宜数量的拔风管,应可优化装置填料层中的氧环境,缓解该工艺在深度处理猪场废水时存在的硝化性能不佳的困境,并最终实现废水中氮素的高效脱除。此外,拔风管的制作成本及布设难度均较低,不会显著提高HCW的建设运行费用及操作难度[16],亦有助于该技术的推广。
本研究以前期构建的分流式HCW为实验装置,重点考察了拔风管布设下HCW在深度处理猪场废水时的脱氮效果,分析了对应条件下系统中的微生物群落结构特征,建立了HCW脱氮性能及其微生物学特性的定量响应关系,并定量解析了系统中每种形态氮素的转化途径。本研究结果以期为分流式HCW高效脱氮性能的维持提供一种简单有效的控制模式,进而为新型CW工艺的设计及工程化应用提供参考。
-
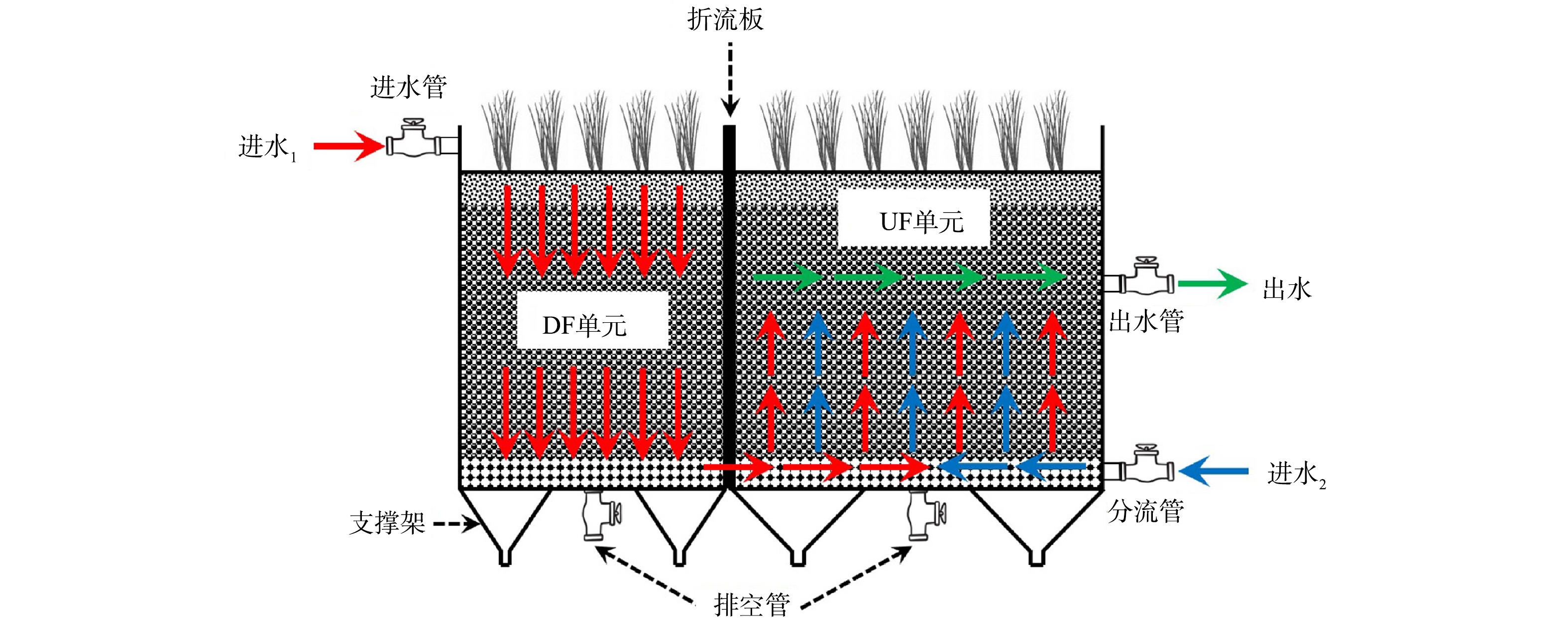
分流式HCW为PVC材质,构型如图1所示。由图1可知,HCW由2个子单元串联而成,按照污水流向的不同将其分别标记为下向流(DF)单元和上向流(UF)单元。其中,DF单元的长、宽和高分别为1.0、1.0和1.2 m;UF单元的长、宽和高分别为1.4、1.0和1.2 m。HCW的进水管安装在DF单元顶部,出水管位于距UF单元填料层表面以下45 cm处,此外,UF单元底部另设有分流管。2个单元中均填充有100 cm厚的填料层(孔隙率≈37%),包括底部为20 cm厚的砾石承托层(粒径为5~10 cm)、中部为70 cm厚的沸石-废砖块混合层(两者体积比为1:1,粒径为1~3 cm)及上部为10 cm厚的瓜片石层(粒径为5~10 mm),其填料层表面均种植芦苇,种植密度为16株·m−2,填料层中的水位高度稳定在55 cm。
在HCW的DF单元中均匀布设拔风管,该拔风管(PVC材质)的长度和内径分别为120 cm和5 cm,其四周侧壁沿纵向等距(≈5 cm)设置有5 mm的小孔。根据拔风管布设数量的不同将HCW划分为3组,每组设置3个平行实验装置,3组HCW分别标记为H1(布设数量为0)、H2(布设数量为2)和H3(布设数量为4)。
-
分流式HCW的进水分为2个部分,一部分进水为经过预处理和生化处理的猪场废水(标记为进水1),其中COD、TP、TN、NH4+-N、NO3−-N和NO2−-N的质量浓度分别为(56.43±22.55)、(2.22±0.61)、(47.16±18.48)、(30.58±13.67)、(15.57±9.73)和(1.15±0.94) mg·L−1;另一部分是作为外加碳源的生活污水(标记为进水2),其中COD、TP、TN、NH4+-N、NO3−-N和NO2−-N的质量浓度分别为(215.72±8.60)、(5.66±0.28)、(51.99±9.27)、(40.79±8.90)、(0.77±0.14)和(0.72±0.08) mg·L−1。
-
各组HCW均以连续模式运行了120 d。期间,以生活污水为外加碳源,对其施加分段进水措施。具体操作方法为:将进水1由进水管泵入系统的DF单元,而后进水1以下向流模式流经DF单元填料层;同时,将进水2由分流管泵入HCW的UF单元,该部分进水与来自DF单元的进水1混合后以上向流模式流经UF单元填料层。其中,进水2体积与进水1体积之比被定义为分流比。在实验过程中,将各HCW的水力负荷(HLR)与分流比分别设定为0.15 m3·(m2·d)−1和1:3,此条件下实验装置的日进水量为360 L (即进水1和进水2体积分别为270和90 L) ,其进水COD、TP、TN、NH4+-N、NO3−-N和NO2−-N负荷分别为(13.92±1.86)、(0.48±0.04)、(6.45±2.20)、(4.55±1.52)、(1.67±1.04)和(0.12±0.06) g·(m2·d)−1。另外,实验期间各HCW中污水水温为(14~23) ℃。
-
1)水样采集及分析方法。每2 d采集各装置进出水水样进行分析,样品设置3平行。水样中COD、NH4+-N、NO2−-N、NO3−-N、TN和TP浓度的测定均参照《水和废水监测分析方法》(第4版)[17]。填料层中的水温及氧化还原电位(ORP)值均利用便携式水质分析仪进行原位测定。
2)填料样品采集。对于各组HCW,每隔15 d在其不同单元的不同深度(即DF单元填料层以下5、25、50、72和95 cm处,UF单元填料层以下20、45、65、85和95 cm处)采集填料样品,而后将其进行后续相关分析,每次采集完成后均会对损失填料进行补充。
3)填料样品氮素转化性能。用NH4+-N去除速率(v(NH4+-N))、NO3−-N去除速率(v(NO3−-N))和NO2−-N去除速率(v(NO2−-N))衡量填料样品脱氮性能,3项指标分别参照文献[18-19]进行测定。对于取自DF单元的填料样本,上述指标测定时的实验用水采用进水1;而对于取自UF单元的填料样本,各项指标测定时的实验用水采用DF单元排空管出水和进水2的混合物,混合时两者体积比设为3∶1。
4)功能基因定量分析。使用DNA试剂盒(D5625-01,Omega,USA)对填料样品中的DNA进行提取纯化,并对所得产物的核酸浓度和纯度进行测定,而后对DNA样品中参与生物脱氮过程的关键功能基因(即amoA、hzsA、nxrA、narG、napA、nirS和nirK)进行荧光定量PCR测定。分析所用仪器为Applied Biosystems StepOneTM,采用SYBR Green I荧光染料法进行测试,各功能基因的扩增体系、引物种类及反应条件均参照文献[20]。
5)基于16S rDNA的Illumina平台高通量测序。对填料样品进行超声处理后采用漩涡混匀仪(Scilogex MX-F)对其进行涡旋处理(t=5 min)。收集脱落的生物膜存放于-20 ℃冰箱保存,待试验全部完成后将所有生物膜样品送至北京百迈客生物科技有限公司进行高通量分析测序。测序分析后,根据Barcode序列区分各样本的数据,进行嵌合体过滤,得到可用于后续分析的有效数据,即Clean reads。为了研究样品的物种组成多样性,对所有样品的Clean reads进行聚类,以97%的一致性将序列聚类成OTUs,然后对OTUs的代表序列进行物种注释及分类学分析。
-
采用SPSS 28.0对数据进行统计分析;采用one-way ANOVA进行方差分析(P<0.01);采用逐步线性回归模型构建氮素转化速率(因变量)与脱氮功能基因组合(自变量)之间的定量响应关系,而后利用通径系数评价各自变量对因变量的相对重要性;采用Origin 2021作图,图中相关数据为平均值±标准差;文中污染物去除负荷等指标的计算方法均参照文献[21]。
-
如表1和表2所示,H1、H2和H3均可高效降解进水中的有机物,3组装置出水中的COD值分别稳定在(23.12±7.53)、(23.38±5.46)和(23.87±7.44) mg·L−1,其COD去除负荷分别对应为(10.45±0.92)、(10.41±0.99)和(10.34±1.20) g·(m2·d)−1。CW通常具备高效的有机物去除性能[22],本实验结果与该研究结论一致。与有机物去除性能类似,3组装置均可获得理想的TP去除效果,其出水中的TP浓度均低于0.20 mg·L−1。由HCW构型特点判断,3组系统高效的除磷能力应主要源自填料层中废砖块的填充[23]。另基于两表可知,拔风管的布设未造成3组系统在有机物和TP去除方面的差异。
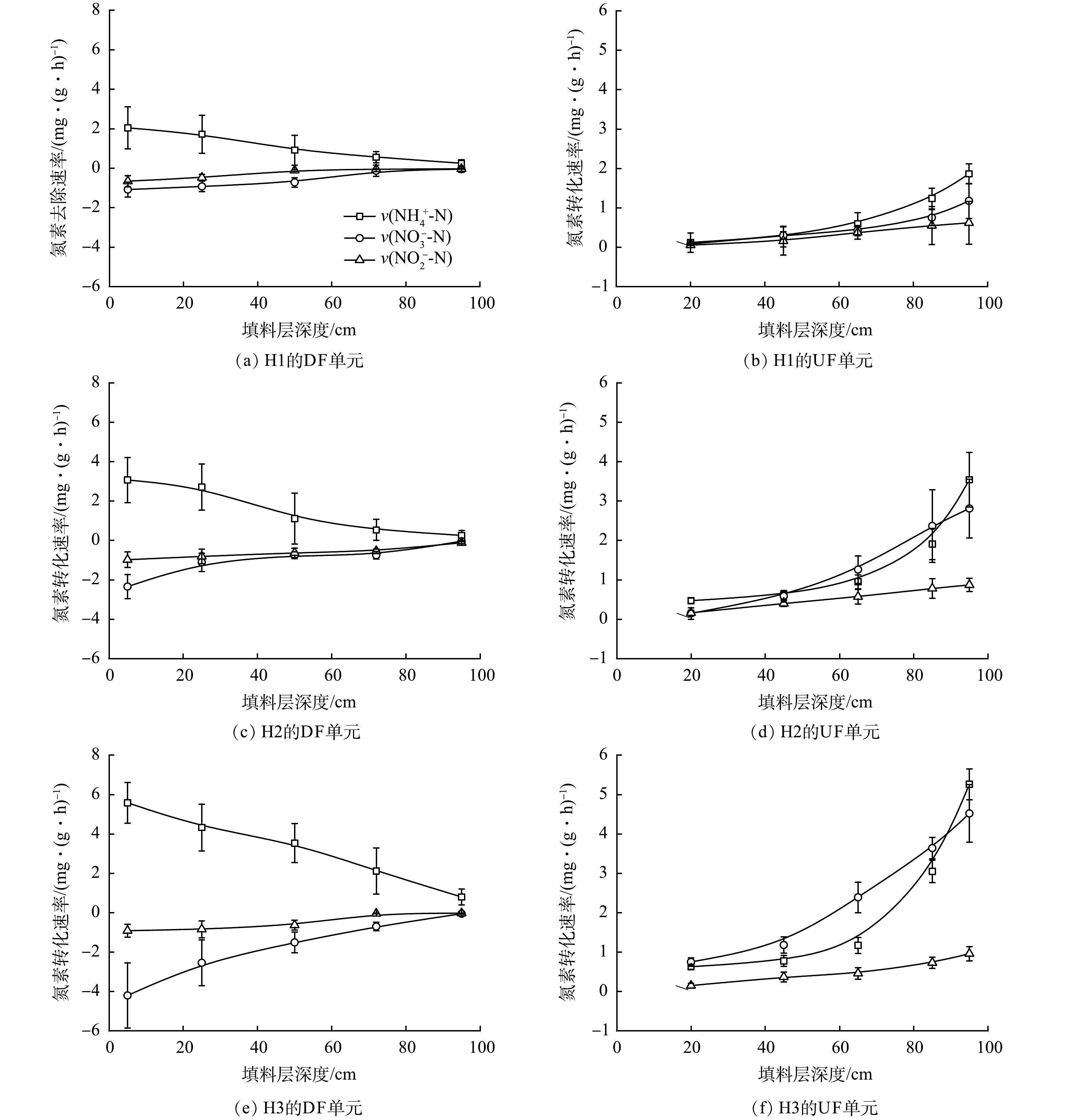
由表1和表2也可知,3组HCW的脱氮性能差异显著。H1对进水中的TN与NH4+-N去除负荷分别仅为(2.42±0.65) g·(m2·d)−1和(1.03±0.29) g·(m2·d)−1,此时系统出水TN浓度达(26.84±6.39) mg·L−1且主要以NH4+-N(≈(23.44±5.79) mg·L−1)形式存在。布设拔风管后,HCW的氮素转化性能得到改善。其中,当拔风管布设数量为4时,H3的TN和NH4+-N去除负荷分别增至(4.92±1.55) g·(m2·d)−1和(3.86±1.19) g·(m2·d)−1,装置出水中TN、NH4+-N、NO3−-N和NO2−-N质量浓度分别为(10.22±2.62)、(4.58±1.35)、(5.31±1.28)和(0.40±0.26) mg·L−1。由图2可知,对于各组HCW,其DF单元和UF单元中填料样本的氮素转化效能均随污水流向沿程降低。其中,对于取自DF单元的填料样品,其v(NO3−-N)和v(NO2−-N)均<0,表明DF单元在氧化NH4+-N的同时,其中发生了一定程度的NOx−-N积累;而对于取自UF单元的填料样品,其v(NH4+-N)、v(NO3−-N)和v(NO2−-N)均>0,推测UF单元可实现其中NOx−-N与NH4+-N的同步去除。值得注意的是,拔风管的布设提高了HCW中两子单元的氮素转化性能。在H3的DF单元中布设4根拔风管后,取自该单元填料层深度为5 cm处的样本的v(NH4+-N)、v(NO3−-N)和v(NO2−-N)分别达(5.58±1.04)、−(4.20±1.66)和−(0.91±0.32) mg·(g·h)−1;此时UF单元分流管处填料样本的v(NH4+-N)、v(NO3−-N)和v(NO2−-N)则分别为(5.26±0.39)、(4.52±0.73)和(0.96±0.18) mg·(g·h)−1。
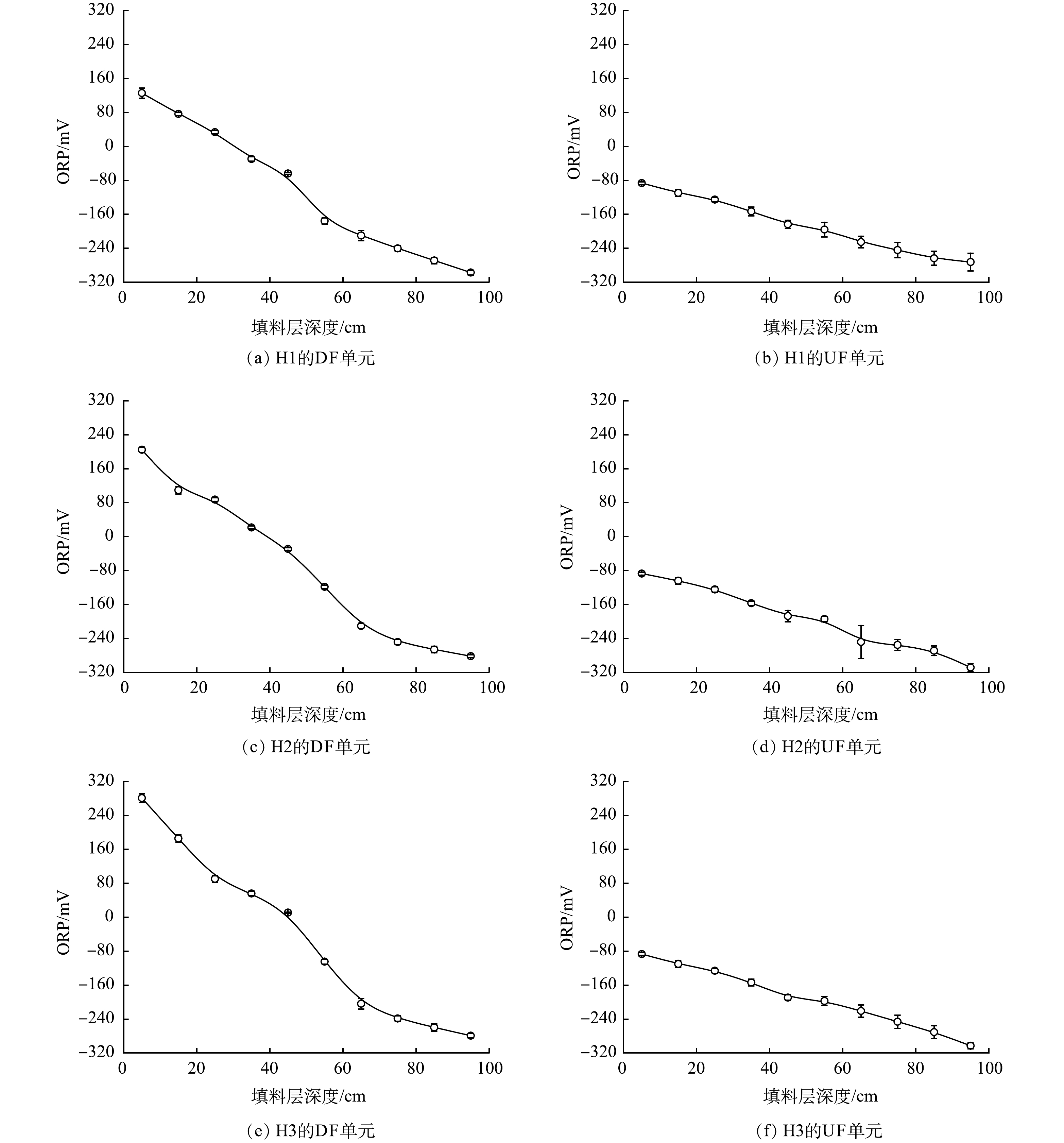
为探究3组HCW中的氧环境差异,考察了各系统中的ORP值变化(图3)。CW中的氧环境可通过其填料层中的ORP值来表征[24]。LI等[25]指出,当填料层中的ORP值>400 mV时,CW处于好氧状态;当ORP值降至−200 mV以下后,系统处于厌氧状态;而当该值处于−200~400 mV时,系统则处于兼氧状态。对于H1,当其DF单元的填料层深度为0~45 cm时,对应的ORP值为−67.6~159.4 mV;随着填料层深度的增加,ORP值不断下降,还原环境逐渐增强;在填料层深度为95 cm处,该区域的ORP值已降至−(297.2±5.5) mV。布设拔风管后,DF单元中的氧环境可得到一定程度的改善。当拔风管布设数量为4时,在DF单元填料层深度为0~45 cm的区域,对应ORP值为8.3~297.8 mV。然而,当填料层深度超过65 cm后,各DF单元对应区域的ORP值均低于−200 mV,仍为厌氧环境。另一方面,拔风管的布设并未引起UF单元中氧环境的改变,且3组UF单元中的氧化还原环境在实验期间无明显差别,对应的ORP值为−308.7~−82.3 mV,由此应有助于该单元中反硝化及ANAMMOX反应的维持。
由上述结果推断,当HCW深度处理猪场废水时,复氧能力不足是限制其高效脱氮的“瓶颈”,并导致系统脱氮效能不甚理想。拔风管的布设有助于分流式HCW摆脱此“困境”,在拔风管的增氧作用下,DF单元填料层中的好氧环境得到强化,系统随之获得理想的TN和NH4+-N去除效果。其中,当拔风管布设数量为4时,H3运行效能最佳,其出水水质满足《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A标准。
-
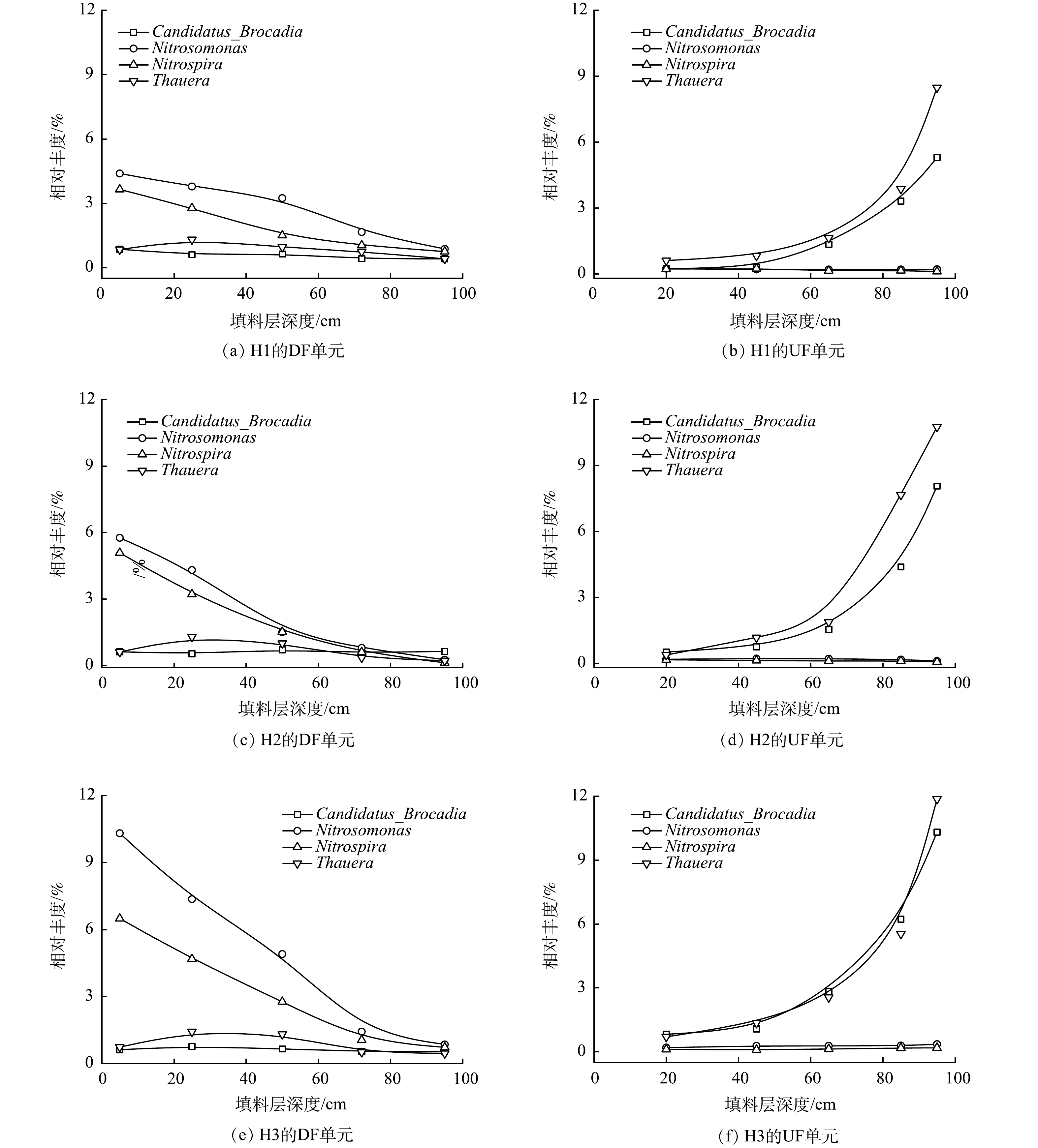
图4所示为各HCW中的微生物群落结构。由图4可知,取自H1的各填料样本中的优势菌属包括Nitrosomonas、Nitrospira、Thauera和Candidatus_Brocadia。Nitrosomonas和Nitrospira分别隶属好氧氨氧化菌(AOB)与亚硝酸盐氧化菌(NOB),是参与硝化反应(NH4+-N→NO2−-N→NO3−-N)的2种功能菌属[26]。在DF单元填料层深度为5 cm处,Nitrosomonas和Nitrospira的相对含量分别为4.39%和3.64%;而后两菌属的丰度随污水流向沿程下降。在HCW出水管处,其在对应填料样本中的相对含量分别降至0.20%和0.24%。Thauera中包含部分反硝化菌,此类微生物可在缺氧或好氧条件下将NOx−-N还原[27]。该菌属在H1中的空间变化特征异于上述2菌属:在DF单元中,Thauera在填料层中的占比呈现先增加后降低的特点,在填料层深度约25 cm处,该菌属的相对丰度为1.31%;在UF单元的分流管附近区域,Thauera在填料样本中的相对含量因进水2的添加骤增至8.48%,此结果应归因于进水2中挟带的易生物降解有机物。之后随着污水流至出水管处,该菌属在对应区域中的丰度水平降至0.82%。隶属于浮霉菌门(Planctomycetota)的Candidatus_Brocadia是一类AnAOB[26]。在DF单元的填料层中,此菌属的相对含量处于较低水平[≈(0.58±0.18)%]。然而,与Thauera的丰度变化特征类似,UF单元中进水2的泵入也提高了Candidatus_ Brocadia的丰度,该菌属在分流管处的相对丰度提升至5.29%,表明该区域中的ANAMMOX作用得以强化。拔风管的布设可提高HCW特定区域内部分脱氮功能菌属的丰度(图4)。尤其将4套拔风管布设于H3中后,在其DF单元填料层深度为5 cm处,所采集样本中Nitrosomonas和Nitrospira的相对含量分别增至10.31%和6.49%,较H1分别增加了2.35和1.78倍;同时,在分流管安装处,附近区域填料中Thauera和Candidatus_Brocadia的占比亦分别较H1增至11.87%和10.31%。该结果应归因于:(1)拔风管的增氧作用改善了DF单元中的氧环境,尤其提高了其上层填料层中的DO浓度,促进了硝化细菌的增殖;(2)DF单元中的NOx−-N产量因其硝化性能得以强化而提高,待该部分NOx−-N进入UF单元后,分流管处反硝化菌与AnAOB的丰度因电子受体浓度的升高而增加。
-
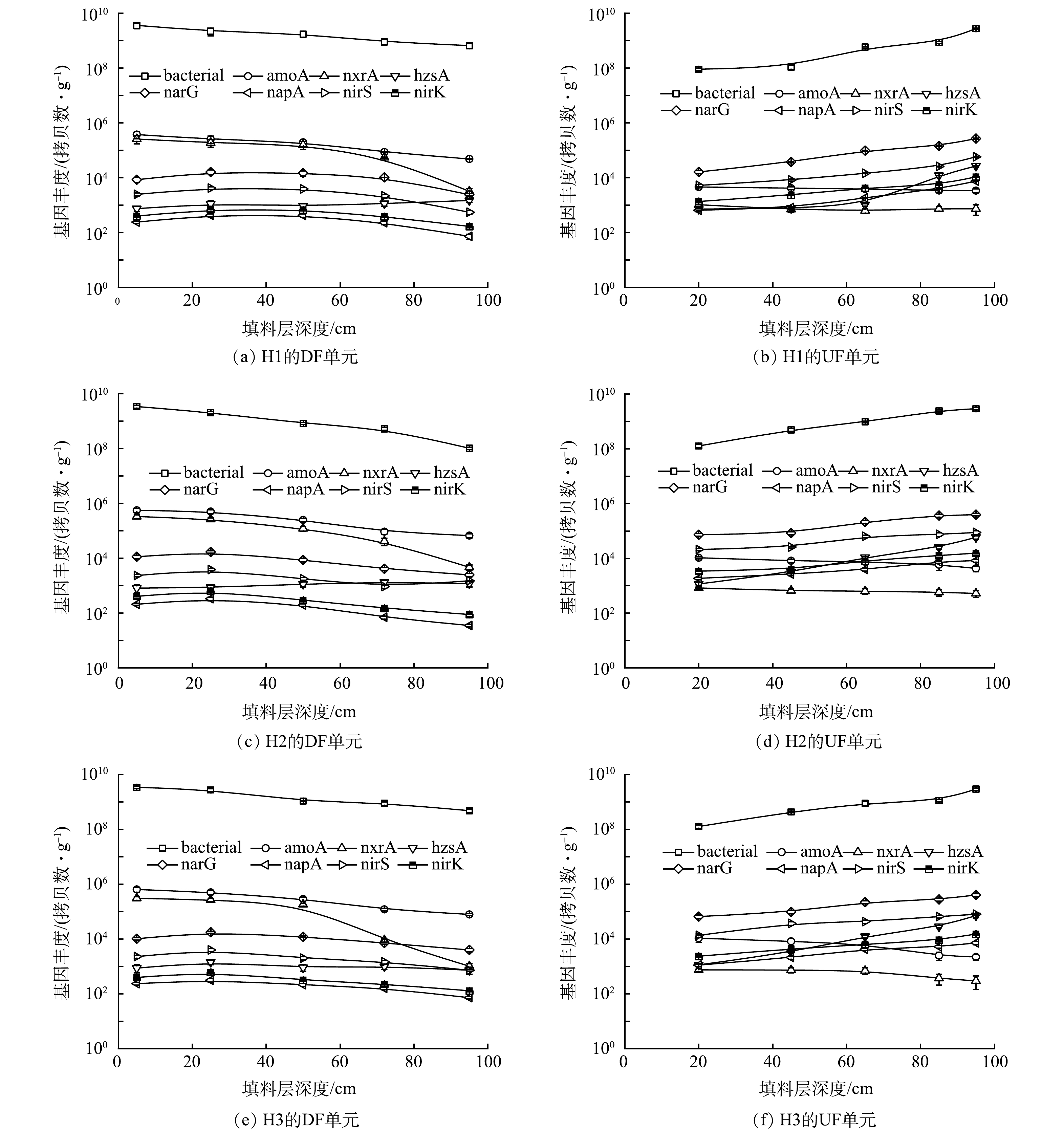
图5所示为各组HCW中脱氮功能基因的空间分布特征。对于H1,其填料样本中参与硝化过程的相关功能基因的丰度均随污水流向沿程降低。其中,在DF单元填料层深度为5 cm处,所采集填料样本中参与NH4+-N和NO2−-N氧化的amoA和nxrA[20]的基因拷贝数分别为(3.70×105±5.50×104)和(2.56×105±8.30×104) 拷贝数·g−1,amoA和nxrA的基因丰度沿污水流向不断下降,在HCW出水管处,填料样本中amoA和nxrA的丰度分别降至(4.13×103±4.88×102)和(6.95×102±1.42×102) 拷贝数·g−1。narG、napA、nirK和nirS分别是参与反硝化过程的4种关键基因,其丰度可反映出系统中反硝化菌的数量。其中,narG和napA是参与反硝化过程第1步还原反应的2种关键基因;nirS和nirK是参与该过程第2步还原反应的2种关键基因[28]。在H1的DF单元内,反硝化菌的丰度随其填料层深度的增加呈现先升高后下降的空间特征。其中,上述4种功能基因在填料层深度为25 cm处的丰度分别为(1.59×104±3.24×103)、(4.22×102±0.58×102)、(4.16×103±4.70×102)和(6.78×102±0.75×102) 拷贝数·g−1。在UF单元内,分流管中进水2的泵入显著提高了反硝化菌的数量,narG、napA、nirK和nirS的基因拷贝数在分流管安装处分别为(2.66×105±9.33×103)、(7.41×103±1.82×102)、(5.75×104±9.20×102)和(1.07×104±2.04×102) 拷贝数·g−1。同时,该区域填料样本中的AnAOB丰度亦得到了一定程度的提高。hzsA的丰度可反映出AnAOB的数量[20],此基因的拷贝数在样本中可达(2.64×104±1.84×102) copies·g−1。结合图4推断:(1)由于DF单元的上层填料层(尤其是表层)以氧化环境为主且NH4+-N浓度较高,致使硝化菌群在此处富集,强化了该区域的硝化性能,而后随着填料层中还原环境的增强,硝化菌群的丰度随污水流向沿程下降;(2)进水2为UF单元中的有机碳源进行了有效补充,致使分流管处的反硝化菌群数量大幅提高。同时,由于DF单元中产生的NOx−-N、进水2中挟带的NH4+-N与有机物均汇集于分流管附近,推测短程反硝化-ANAMMOX(DMOA)耦合作用在该区域中得以发生,导致AnAOB亦在该处富集。图5进一步证实,拔风管的布设可提高HCW特定区域内部分脱氮功能微生物的丰度,尤其在DF单元填料层深度为5 cm处及UF单元的分流管处,所采集样本中脱氮功能基因的丰度均能得到不同程度的提升。当拔风管布设数量为4时,对于取自前者的填料样本,其中amoA和nxrA的基因丰度分别为(6.44×105±1.27×105)和(3.07×105±4.70×104) 拷贝数·g−1;而对于取自后者的填料样本,其中参与反硝化的4种功能基因及hzsA的基因拷贝数分别为(4.10×105±4.58×104)、(7.25×103±1.08×103)、(1.53×104±1.10×103)、(8.01×104±8.55×103)和(7.16×104±1.12×104) 拷贝数·g−1。
-
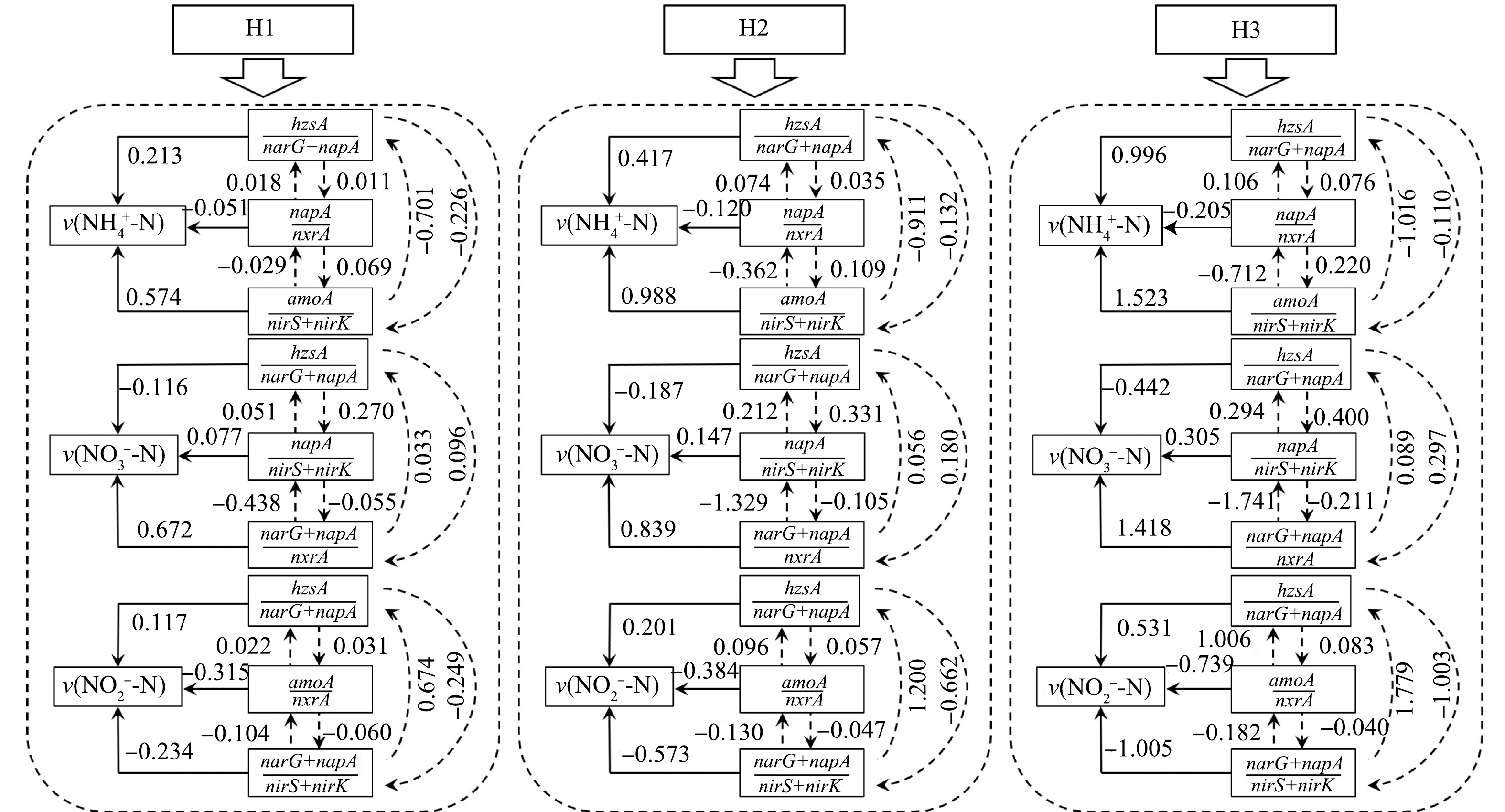
基于各填料样品氮素转化性能及其中脱氮功能基因丰度的测定结果,利用逐步线性回归模型(表3)和通径系数(图6)解析了各组HCW中3种形态氮素的转化途径。由表3和图6可知,H1的v(NH4+-N)受amoA/(nirS+nirK)、(napA/nxrA)和hzsA/(narG+napA)的显著影响。其中,amoA/(nirS+nirK)和hzsA/(narG+napA)均正相关于v(NH4+-N),通径系数分别为0.574和0.213;而(napA/nxrA)与v(NH4+-N)呈负相关,通径系数为-0.051。amoA/(nirS+nirK)预示着H1中的部分NH4+-N可通过硝化/反硝化途径被转化,且短程硝化反应与反硝化反应的第2步(NO2−-N→NO)应是该过程的限速步骤。hzsA/(narG+napA)则表明,H1中的部分NH4+-N可通过DMOA作用去除,此结论与2.3节的推断相符。不同于CANON作用,在DMOA耦合反应中,AnAOB所需的NO2−-N源于NO3−-N的还原,由此避免了NOB过量增殖的干扰,且可缓解有机碳源对AnAOB的抑制[29]。已有研究[30]表明,DMOA耦合新技术为低C/N污水高效脱氮开辟了新途径,已成为污水脱氮领域的研究热点。由另一变量(napA/nxrA)得出,napA会导致H1中NH4+-N的积累。有研究[31]表明,具备napA基因的脱氮微生物可主导异化还原硝酸盐为铵(DNRA)过程,即可将NO3−-N还原为可被生物再利用的铵盐,则H1中可能存在DNRA作用。然而,考虑到进水中偏低的C/N[32],napA基因主导的DNRA作用对H1中氨氮转化的影响应较小。另一方面,此变量还预示着填料层中的NOB会与AOB竞争DO,影响系统中NH4+-N的转化。H1的v(NO3−-N)与(narG+napA)/nxrA、napA/(nirS+nirK)和hzsA/(narG+napA)显著相关。其中,前2个变量均正相关于v(NO3−-N),通径系数分别为0.672和0.077。(narG+napA)/nxrA表明H1中NO3−-N的去除途径之一为反硝化作用,而NOB主导的NO2−-N氧化过程是造成装置中NO3−-N累积的原因之一。另断定,H1的NO3−-N去除率在一定程度上依赖于进水中的有机碳源含量。napA/(nirS+nirK)表明,napA主导的DNRA作用有助于H1中NO3−-N的转化,而当NO3−-N通过反硝化作用进行转化时,该作用的第2步为其限速步骤。此外,反硝化过程中累积的较高浓度的NO2−-N会对脱氮功能微生物产生毒害。基于ANAMMOX反应特点可知,AnAOB在将NH4+-N和NO2−-N转化为N2时,会产生一部分的副产物—NO3−-N,故hzsA/(narG+napA)与v(NO3−-N)呈负相关,通径系数为-0.116。(amoA/nxrA)和(narG+napA)/(nirS+nirK)与H1的v(NO2−-N)均呈负相关,通径系数分别为−0.315和−0.234。前者表明,短程硝化作用是H1中NO2−-N生成的主要途径,而NOB的过量增殖会对该作用的强度及稳定性形成冲击;后者表明,反硝化过程不充分也是造成系统中NO2−-N累积的主因,且在有机碳源相对不足时,此现象会加重。不同于上述2个变量,hzsA/(narG+napA)正相关于v(NO2−-N)且通径系数为0.117,表明系统中的NO2−-N应参与了DMOA过程。上述结果表明,H1中的氮素的转化途径以硝化/反硝化作用和DMOA作用为主。此外,装置中的少量NO3−-N可通过DNRA作用转化为NH4+-N。然而,结合2.1中结果推测,由于H1的复氧能力不足,NH4+-N氧化作用受到抑制,NOx−-N无法被稳定且足量的获取,致使系统的脱氮性能不理想。对于H2和H3而言,影响2组装置中各形态氮素转化的变量均与H1相同,且随着拔风管的布设,相应的通径系数值较H1有所增加,表明各组变量对每种氮素去除速率的相对重要性逐步增加。换言之,H2和H3中氮素转化的主要途径虽与H1相同,但其中的硝化/反硝化作用、DMOA作用甚至DNRA作用均因拔风管的引入而得到了不同程度的强化。尤其对于H3,由于适宜数量拔风管的布设,该系统中硝化/反硝化作用与DMOA作用的强度均优于H2和H1,其脱氮性能亦较理想。
综上所述,当分流式HCW以生活污水作为外加碳源深度处理猪场废水时,系统可通过以硝化/反硝化作用和DMOA作用为主的多路径耦合脱氮反应脱除氮素,而拔风管的布设则可在此基础上进一步强化其脱氮效果。究其原因,应归因于以下3点:1)拔风管通过增氧作用改善了DF单元填料层中的氧环境,进而提高了该单元的硝化性能,确保了NOx−-N的稳定足量产生;2) DF单元中拔风管的布设并未影响后续UF单元填料层中的氧化还原环境;3)分段进水措施的实施以及DF单元中NOx−-N产量的增加提高了UF单元中DMOA作用的强度。在本研究中,DF单元中布设的拔风管数量宜设置为4个,由此才能较大限度地提高HCW的脱氮效果,从而实现其对猪场废水的高效处理。
-
1)拔风管的布设会显著影响分流式HCW的运行性能。当拔风管布设数量为4时,H3的COD、TP、TN和NH4+-N去除负荷分别可达(10.34±1.20)、(0.46±0.02)、(4.92±1.55)和(3.86±1.19) g·(m2·d)−1,其出水水质满足《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A标准。
2)拔风管的布设并未改变分流式HCW中的氮素转化模式,但该措施分别在不同程度上提升了2个单元中硝化菌群、反硝化菌群及AnAOB的丰度,实现了系统中各脱氮途径强度的提高及其脱氮性能的优化。
3)在DF单元中布设4套拔风管后,H3中参与脱氮的优势菌属包括Nitrosomonas、Nitrospira、Thauera和Candidatus_Brocadia,系统中氮素的转化主要依赖硝化/反硝化作用和DMOA作用。
拔风管对分流式复合潜流人工湿地脱氮性能的影响
Effect of air duct on nitrogen removal performance of a hybrid subsurface flow constructed wetland with step-feeding
-
摘要: 当分流式复合潜流人工湿地(HCW)以生活污水为外加碳源深度处理猪场废水时,系统因复氧能力不佳而面临NOx−-N难以稳定获取的难题。为了确保HCW高水平的硝化性能及TN去除率,以拔风管为增氧设施并探究了其对系统氮素转化性能及微生物特性的影响。结果表明,对于由下向流(DF)单元和上向流(UF)单元串联而成的分流式HCW,其中可形成以硝化/反硝化作用和短程反硝化/厌氧氨氧化(DMOA)作用为主的多路径耦合脱氮反应体系;拔风管的布设不会明显改变HCW中的氮素转化模式,但该设施的增氧作用可强化DF单元的硝化性能,并可提升后续UF单元中反硝化菌群及厌氧氨氧化菌(AnAOB)的丰度,进而可实现系统中各脱氮途径强度的提高及其脱氮性能的优化;当DF单元中拔风管的布设数量为4时,HCW中参与脱氮的优势菌属包括Nitrosomonas、Nitrospira、Thauera和Candidatus_Brocadia,此时系统的COD、TP、TN和NH4+-N去除负荷分别可达(10.34±1.20)、(0.46±0.02)、(4.92±1.55)和(3.86±1.19) g·(m2·d)−1,出水水质满足《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A标准。该研究为HCW高效脱氮性能的维持提供了一种简单有效的控制模式,也有助于新型CW工艺的研发与设计。Abstract: For advanced treatment of swine wastewater by a hybrid subsurface flow constructed wetland (HCW) with step-feeding and the external carbon source of domestic sewage, it is difficult to stably produce NOx−-N in the system owing to the poor reaeration performance. In order to ensure ideal nitrification performance and high-level TN removal rate of the HCW, the air duct was used as a kind of aerobic facility to explore its effects on nitrogen transformation mechanisms and the associated microbiological characteristics in the system. The results showed that the reaction system of multipath nitrogen removal mainly relied on the nitrification/denitrification process and the partial denitrification/ANAMMOX (DMOA) process could be established in the HCW with step-feeding, which was consisted of a down-flow (DF) unit and an up-flow (UF) unit in series. Noticeably, no significant changes occurred with respect to nitrogen transformation in the HCW equipped with air duct, while nitrification of the DF unit could be enhanced owing to the increased aeration caused by the air duct, and the abundances of denitrifying bacteria and anaerobic ammonium oxidation bacteria (AnAOB) in the subsequent UF unit increased accordingly, resulting the strength improvement of each nitrogen transformation pathway in the HCW, as well as its nitrogen removal performance optimization. Regarding to HCW equipped four air ducts in its DF unit, Nitrosomonas, Nitrospira, Thauera and Candidatus_Brocadia were the four dominant bacterial genera involved in nitrogen removal of this system. Correspondingly, the COD, TP, TN and NH4+-N removal loads of the HCW were (10.34±1.20), (0.46±0.02), (4.92±1.55), and (3.86±1.19) g·(m2·d)−1, respectively, resulting that effluent quality could meet class A standard of the Discharge Standard of Pollutants for Municipal Wastewater Treatment Plant (GB 18918-2002). In conclusion, this study not only provides a simple and effective approach to maintain high-performance nitrogen removal of the HCW, but also is conducive to research, development, and design of the new type of constructed wetland.
-

-
表 1 HCW出水水质
Table 1. Effluent quality of each HCW
湿地类型 污染物出水指标/(mg·L−1) COD TP TN NH4+-N NO3−-N NO2−-N H1 23.12±7.53 0.19±0.07 26.84±6.39 23.44±5.79 2.43±1.46 0.99±0.23 H2 23.38±5.46 0.10±0.05 22.36±5.32 14.34±3.94 7.30±2.82 0.81±0.13 H3 23.87±7.44 0.13±0.04 10.22±2.62 4.58±1.35 5.31±1.28 0.40±0.26 表 2 HCW污染物去除负荷
Table 2. Contaminants removal loads of each HCW
湿地类型 污染物去除负荷/(g·(m2·d)−1) COD TP TN NH4+-N NO3−-N NO2−-N H1 10.45±0.92 0.45±0.03 2.42±0.65 1.03±0.29 1.30±0.50 -(0.03±0.01) H2 10.41±0.99 0.46±0.04 3.09±0.71 2.39±0.48 0.58±0.23 -(0.02±0.01) H3 10.34±1.20 0.46±0.02 4.92±1.55 3.86±1.19 0.87±0.32 0.06±0.02 表 3 HCW中氮素转化速率与脱氮功能基因的定量响应关系
Table 3. Quantitative response relationships between nitrogen transformation rates and functional genes in each HCW
湿地类型 逐步线性回归方程 R2 P值 H1 v(NH4+-N)=1.03[amoA/(nirS+nirK)]-0.04(napA/nxrA)+0.57[hzsA/(narG+napA)]+0.07 0.993 0.012 v(NO3−-N)=1.25[(narG+napA)/nxrA]+0.27[napA/(nirS+nirK)]-0.33[hzsA/(narG+napA)]−2.97 0.908 0.024 v(NO2−-N)=−0.65(amoA/nxrA)-0.77[(narG+napA)/(nirS+nirK)]+0.42[hzsA/(narG+napA)]+4.29 0.937 0.017 H2 v(NH4+-N)=1.86[amoA/(nirS+nirK)]-0.11(napA/nxrA)+0.92[hzsA/(narG+napA)]−1.57 0.976 0.021 v(NO3−-N)=1.57[(narG+napA)/nxrA]+0.52[napA/(nirS+nirK)]-0.73[hzsA/(narG+napA)]−4.27 0.932 0.019 v(NO2−-N)=−0.51(amoA/nxrA)-1.14[(narG+napA)/(nirS+nirK)]+1.13[hzsA/(narG+napA)]+5.26 0.970 0.025 H3 v(NH4+-N)=2.15[amoA/(nirS+nirK)]-0.36(napA/nxrA)+0.78[hzsA/(narG+napA)]−2.95 0.899 0.022 v(NO3−-N)=2.18[(narG+napA)/nxrA]+0.76[napA/(nirS+nirK)]-0.58[hzsA/(narG+napA)]−4.43 0.959 0.014 v(NO2−-N)=−0.32(amoA/nxrA)-1.92[(narG+napA)/(nirS+nirK)]+0.87[hzsA/(narG+napA)]+7.01 0.970 0.018 -
[1] SHIM S, REZA A, KIM S, et al. Nutrient recovery from swine wastewater at full-scale: An integrated technical, economic and environmental feasibility assessment[J]. Chemosphere, 2021, 277: 130309. doi: 10.1016/j.chemosphere.2021.130309 [2] 宋晓智. 一段式厌氧氨氧化技术处理养猪废水[J]. 净水技术, 2021, 40(S1): 95-98. doi: 10.15890/j.cnki.jsjs.2021.s1.021 [3] 郑效旭, 李慧莉, 徐圣君, 等. SBR串联生物强化稳定塘处理养猪废水工艺优化[J]. 环境工程学报, 2020, 14(6): 1503-1511. doi: 10.12030/j.cjee.201902016 [4] LIANG C, WEI D, ZHANG S, et al. Removal of antibiotic resistance genes from swine wastewater by membrane filtration treatment[J]. Ecotoxicology and Environmental Safety, 2021, 210: 111885. doi: 10.1016/j.ecoenv.2020.111885 [5] LI X, WU S, YANG C, et al. Microalgal and duckweed based constructed wetlands for swine wastewater treatment: A review[J]. Bioresource Technology, 2020, 318: 123858. doi: 10.1016/j.biortech.2020.123858 [6] VYMAZAL J. Constructed wetlands for wastewater treatment: Five decades of experience[J]. Environmental Science & Technology, 2010, 45: 61-69. [7] ZHENG Y, WANG Z, CAO T, et al. Enhancement effects and pathways of nitrogen removal by plant-based carbon source in integrated vertical flow constructed wetlands[J]. Journal of Water Process Engineering, 2022, 47: 102734. doi: 10.1016/j.jwpe.2022.102734 [8] NEGI D, VERMA S, SINGH S, et al. Nitrogen removal via anammox process in constructed wetland: A comprehensive review[J]. Chemical Engineering Journal, 2022, 437: 135434. doi: 10.1016/j.cej.2022.135434 [9] WANG Z, HUANG M, QI R, et al. Enhanced nitrogen removal and associated microbial characteristics in a modified single-stage tidal flow constructed wetland with step-feeding[J]. Chemical Engineering Journal, 2017, 314: 291-300. doi: 10.1016/j.cej.2016.11.060 [10] RAMPURIA A, GUPTA A B, BRIGHU U. Nitrogen transformation processes and mass balance in deep constructed wetlands treating sewage, exploring the anammox contribution[J]. Bioresource Technology, 2020, 314: 123737. doi: 10.1016/j.biortech.2020.123737 [11] SUN Z, DZAKPASU M, ZHAO L, et al. Enhancement of partial denitrification-anammox pathways in constructed wetlands by plant-based external carbon sources[J]. Journal of Cleaner Production, 2022, 370: 133581. doi: 10.1016/j.jclepro.2022.133581 [12] 林兴, 方文烨, 金润, 等. 低基质CANON中短程硝化稳定性控制研究[J]. 环境科学研究, 2018, 31(8): 1423-1430. doi: 10.13198/j.issn.1001-6929.2018.05.21 [13] LIU H, HU Z, ZHANG J, et al. Optimizations on supply and distribution of dissolved oxygen in constructed wetlands: A review[J]. Bioresource Technology, 2016, 214: 797-805. doi: 10.1016/j.biortech.2016.05.003 [14] 赵子健, 程瑞, 何凯雯, 等. 拔风管对CANON型人工湿地脱氮性能的影响[J]. 中国环境科学, 2022, 42(3): 1191-1201. doi: 10.3969/j.issn.1000-6923.2022.03.024 [15] 冯欣. 跌水拔风充氧装置处理生活污水[J]. 水处理技术, 2018, 44(4): 92-94. doi: 10.16796/j.cnki.1000-3770.2018.04.019 [16] PARDE D, PATWA A, SHUKLA A, et al. A review of constructed wetland on type, treatment and technology of wastewater[J]. Environmental Technology & Innovation, 2021, 21: 101261. [17] 国家环境保护总局. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2002. [18] WANG H, JI G, BAI X, et al. Assessing nitrogen transformation processes in a trickling filter under hydraulic loading rate constraints using nitrogen functional gene abundances[J]. Bioresource Technology, 2015, 177: 217-223. doi: 10.1016/j.biortech.2014.11.094 [19] ZHANG Y, JI G, WANG R. Quantitative responses of nitrous oxide accumulation to genetic associations across a temperature gradient within denitrification biofilters[J]. Ecological Engineering, 2017, 102: 145-151. doi: 10.1016/j.ecoleng.2017.02.008 [20] JI G, ZHI W, TAN Y. Association of nitrogen micro-cycle functional genes in subsurface wastewater infiltration systems[J]. Ecological Engineering, 2012, 44: 269-277. doi: 10.1016/j.ecoleng.2012.04.007 [21] ZHI W, YUAN L, JI G, et al. Enhanced long-term nitrogen removal and its quantitative molecular mechanism in tidal flow constructed wetlands[J]. Environmental Science & Technology, 2015, 49: 4575-4583. [22] 张馨文, 冯成业, 张文智, 等. 人工湿地碳调控研究进展[J]. 湿地科学, 2022, 20(3): 413-420. doi: 10.13248/j.cnki.wetlandsci.2022.03.015 [23] 王振, 刘超翔, 李鹏宇, 等. 废砖块作为人工湿地填料的除磷能力研究[J]. 环境科学, 2012, 33(12): 4373-4379. doi: 10.13227/j.hjkx.2012.12.046 [24] LI Y H, LI H B, YANG L, et al. Study on the contribution of different depth layers to N2O emission in subsurface wastewater infiltration system[J]. Ecological Engineering, 2019, 133: 69-75. doi: 10.1016/j.ecoleng.2019.04.030 [25] LI Y H, LI H B, XU X Y, et al. Correlations between the oxidation-reduction potential characteristics and microorganism activities in the subsurface waste water in filtration system[J]. Desalination and Water Treatment, 2016, 57: 5350-5357. doi: 10.1080/19443994.2014.1003606 [26] 韩文杰, 吴迪, 周家中, 等. CANON生物膜载体储存及活性恢复研究[J]. 中国环境科学, 2020, 40(5): 2062-2072. doi: 10.3969/j.issn.1000-6923.2020.05.024 [27] DU R, PENG Y Z, CAO S B, et al. Mechanisms and microbial structure of partial denitrification with high nitrite accumulation[J]. Applied Microbiology and Biotechnology, 2016, 100(4): 2011-2021. doi: 10.1007/s00253-015-7052-9 [28] ZHU X, CHEN Y. Reduction of N2O and NO generation in anaerobic-aerobic (low dissolved oxygen) biological wastewater treatment process by using sludge alkaline fermentation liquid[J]. Environmental Science & Technology, 2011, 45(6): 2137-2143. [29] 马瑞婕, 刘永红, 梁继东, 等. 短程反硝化(PDN)-Anammox生物脱氮工艺研究进展[J]. 应用化工, 2022, 51(6): 1775-1780. doi: 10.3969/j.issn.1671-3206.2022.06.047 [30] 杜睿, 彭永臻. 城市污水生物脱氮技术变革: 厌氧氨氧化的研究与实践新进展[J]. 中国科学:技术科学, 2022, 52(3): 389-402. [31] PANG Y, ZHANG Y, YAN X, et al. Cold temperature effects on long-term nitrogen transformation pathway in a tidal flow constructed wetland[J]. Environmental Science & Technology, 2015, 49: 13550-13557. [32] PANG Y, JI G. Biotic factors drive distinct DNRA potential rates and contributions in typical Chinese shallow lake sediments[J]. Environmental Pollution, 2019, 254: 1-10. -



 下载:
下载: