-
新污染物是指排放到环境中的,具有生物毒性、环境持久性、生物积累性等特征,且对生态环境或人体健康存在较大风险,但尚未纳入管理或管理措施不足的有毒有害化学物质。新污染物包括四大类:持久性有机污染物、内分泌干扰物、抗生素和微塑料[1]。
卡马西平(CMZ,carbamazepine)作为持久性有机污染物,是一种广泛用来治疗抑郁症和癫痫的抗惊厥药物[2],在环境中检出率非常高,医药废水中的检出质量浓度达到μg·L–1的级别[3]。CMZ是含氮的芳香族杂环化合物,具有结构对称性,因此,难以通过常规处理工艺实现有效去除[4-5]。而且CMZ会损坏水生生态系统,对水生生物 (包括细菌、无脊椎动物、藻类、鱼类和水生植物等) 造成蛋白损伤、功能损伤和生长抑制等不良影响[6-8]。活性炭吸附、臭氧氧化和氯化等工艺已被证明可有效去除CMZ,但这些工艺需要较高的成本,并可能导致未知和潜在的有害副产物[9]。生物处理技术具有代谢物对环境威胁较小和运营成本低等优势,已经成为有效处理CMZ的手段[10]。
滤池作为一种运维简单的绿色水处理工艺被广泛应用,它能通过生物降解作用有效去除新污染物[11-12]。其中不仅生长着可通过微生物降解作用对源水进行处理的细菌,而且普遍存在着各种藻类[13]。滤池中的藻类和细菌构成了一种复杂的生态系统,通过吸附、积累和胞内外酶促机制共同参与对水中新污染物的去除过程[14]。在去除过程中,新污染物的存在同样会影响藻菌体系的生长和功能。同为芳香族化合物的土霉素可以被藻和细菌当作碳源和氮源利用,从而增加藻菌体系的生物量和生物活性,为污染物降解提供更有利条件[15]。藻类对芳香族化合物通常比细菌更敏感,在菌藻体系中细菌对芳香族化合物的降解能够降低其对藻类的毒害作用[16]。
锰氧化菌是饮用水滤池中普遍存在的微生物,而且滤池中的主要锰氧化微生物属于土微菌属和假单胞菌属[17]。蓝藻是饮用水滤池中的常见藻种[18]。因此,蓝藻与锰氧化菌在滤池中是一种共存的状态。另外,锰氧化菌能够通过酶介导和非酶介导的过程将Mn(Ⅱ)氧化成生物源MnOx [19],MnOx在氧化和吸附作用下能有效地去除新污染物[20-22]。已有研究发现,作为蓝藻主要藻种之一的铜绿微囊藻可以提升锰氧化菌QJX-1的锰氧化功能,实现重金属和有机物的高效去除[23]。因此,本研究拟在此基础上探究CMZ是否会影响铜绿微囊藻和锰氧化菌QJX-1组成的藻菌体系并深入分析其影响机制,为新污染物如何影响藻菌互作体系以及后续优化藻菌体系在滤池中的净水效能提供了较好的理论依据。
-
本研究中使用的锰氧化菌是假单胞菌QJX-1(GenBank登录号KM242057) ,分离自湖南湘潭锰矿堆放锰矿的土壤中,之前的研究中描述了QJX-1详细的生理和锰氧化特征,其可以催化Mn(II) 转化为MnOx [24]。该菌株已保藏在中国微生物菌种保藏管理委员会普通微生物中心 (CGMCC登录号
6630 ) 。本实验中使用活化的QJX-1在PYG培养基中富集,并在30 °C和170 r·min–1下在恒温振荡培养箱(ZWYC-2933 ,上海智城分析仪器制造有限公司) 中孵育后在指数生长期收集使用。实验所用藻种为铜绿微囊藻(Microcystis aeruginosa),购买自中国科学院武汉水生生物研究所(FACHB-905),并于BG-11培养基中培养至对数生长期收集使用[25]。铜绿微囊藻属于微囊藻属,是引起蓝藻水华的主要藻种之一,其细胞呈球形或近球形,直径为3~5 μm[26]。实验用的CMZ(分析纯)购自天津阿尔塔科技有限公司。 -
为了明晰该藻菌体系所生成的MnOx的物相特征,收集该藻菌体系产生的MnOx经沉淀后冷冻干燥48 h,通过扫描电子显微镜(SEM) (Quattro,美国FEI公司)进行表征。为了确定MnOx对CMZ的去除作用,将冷冻干燥后的MnOx研磨称重后加入到含50 μg·L–1的CMZ水溶液中进行反应(170 r·min–1,30 ℃),120 h后测定体系中CMZ的浓度。为了确定MnOx的吸附和氧化作用在去除CMZ的相对贡献,在反应后的体系中加入抗坏血酸并振荡,待MnOx完全溶解之后,再次测定体系中CMZ的浓度。
将50 μg·L–1的CMZ与铜绿微囊藻和QJX-1(不含Mn2+)混合培养(170 r·min–1,30 ℃)120 h,然后测定CMZ的浓度以确定微生物对CMZ的去除作用。为了确定生物吸附对CMZ去除的贡献,离心收集铜绿微囊藻和QJX-1进行冷冻干燥,加入到50 μg·L–1 CMZ的水溶液 (不含Mn2+) 中,在170 r·min–1和30 ℃条件下吸附120 h,随后测定CMZ浓度。CMZ的浓度通过配备有色谱柱(Shim-pack GIST C18,日本Shimadzu公司)的液相色谱质谱联用仪 (LCMS-
8050 ,日本Shimadzu公司)检测。 -
本研究使用的水质背景为模拟Ⅲ类地表水的人工配水,配置方法如下:将隔夜放置的自来水在高压灭菌锅中121 °C灭菌30 min。然后以过滤灭菌的方式加入葡萄糖、氯化铵、磷酸二氢钾和50 μL无机离子混合液。使得配水的CODMn值为6 mg·L–1,NH3-N浓度为1 mg·L–1,TP浓度为0.15 mg·L–1。无机离子混合液配制如下:在1 L水中加入1 g FeSO4·7H2O、0.12 g ZnSO4·7H2O、0.18 g KI、0.03 g CuSO4·5H2O、0.15 g NaB4O7·10H2O、0.06 g NaMoO4·2H2O、0.12 g MnSO4·H2O、2.5 g EDTA。
将培养24 h的锰氧化菌QJX-1在7 000 min–1转速下离心10 min,培养至稳定期的铜绿微囊藻在4 000 r·min–1下离心10 min,用模拟地表水的配水重悬,使QJX-1的密度约为3×107 个·mL–1,铜绿微囊藻的密度约为1×106 个·mL–1,并加入终浓度为5.5 mg·L–1的Mn2+,设置CMZ的终浓度分别为0、5、50、500、5 000 μg·L–1,体系总体积为100 mL。将该藻菌体系振荡培养120 h (170 r·min–1,30 °C) 。在0、12、24、36、48、72、96、120 h取样,利用电感耦合等离子体光谱仪(ICP-OES 710,美国Agilent公司)测定余锰浓度。
选择与空白组(不添加CMZ)锰氧化进程差异最大的实验组,研究CMZ的加入对不同体系(藻菌体系、纯菌体系、纯藻体系)锰氧化进程的影响。使用配水重悬铜绿微囊藻和QJX-1,加入5.5 mg·L–1的Mn2+,加入50 μg·L–1的CMZ。然后振荡培养120 h (170 r·min–1,30 °C) 。在0、12、24、36、48、72、96、120 h取样测定余锰浓度。选择与空白组相比锰氧化进程差异最大的实验组,研究CMZ的加入对铜绿微囊藻和QJX-1生长的影响。使用人工配水重悬铜绿微囊藻和QJX-1 (不加入Mn2+)。然后振荡培养120 h (170 r·min–1,30 °C) 。在0、12、24、36、48、72、96、120 h取样。取1 mL样品,通过流式细胞仪 (Novocyte
1040 ,美国Agilent公司) 测定铜绿微囊藻和QJX-1的密度;取190 μL样品于96孔板中,用酶标仪 (Spark 10M,瑞士TECAN公司) 测定超氧自由基发光强度;取15 μL样品于96孔透明酶标板中,用POD检测试剂盒 (Sangon Biotech) 和酶标仪测定过氧化物酶吸光度。在培养120 h后,离心藻菌细胞,通过SEM观察藻菌细胞形貌特征。本论文采用批次实验进行,所有实验设置3个平行反应,在每个取样时间点平行取样并测定。
-
使用人工配水重悬铜绿微囊藻和QJX-1,加入Mn2+, (不) 加入CMZ,每组3个平行。然后振荡培养120 h (170 r·min–1,30 °C) 。在60、72、84 h取样。每次取样后将样品离心 (6 000 r·min–1,8 min) ,然后将离心后的藻和菌放入−80 °C冰箱保存,送样测定CumA基因。CumA基因的引物名称分别为CumAIdg2B和CumAIdgR,所对应的引物序列 (5-3) 分别为GAYGCCGGYAGCTACTGGTAYCACCC和ACYTTGAARSYCATGCCRTGCARRTG,产物大小设定为800 bp。
-
微生物能够有效促进Mn(Ⅱ)的氧化,其氧化速率比化学氧化高出4~5个数量级,因此,天然锰氧化物主要是生物源的[27]。对该藻菌体系生成的MnOx进行SEM表征,结果如图1所示。由图1可见,MnOx具有不规则的多孔结构。与结晶锰氧化物相比,MnOx具有更弱的结晶度、较小的粒径和较大的比表面积,更能促进痕量有机物的氧化降解,在水处理领域展现出较好的应用潜力[28]。
-
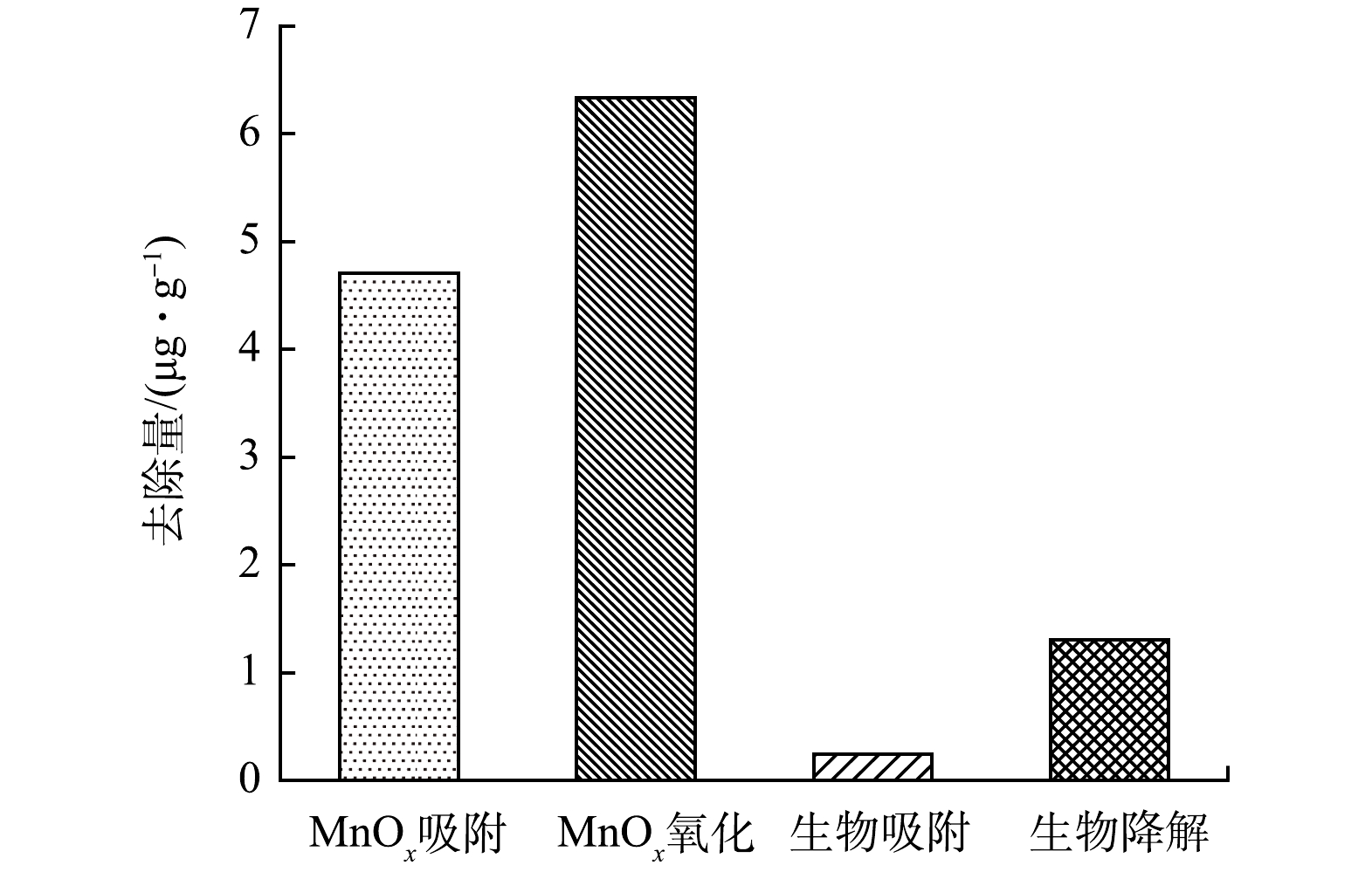
MnOx由于其高比表面积和高氧化反应性已被广泛应用于去除新污染物,关于有机物吸附到其表面及随后的电子转移机制也开始被提及[29-31]。本研究分析了MnOx的氧化和吸附,藻和细菌的生物吸附和生物降解在去除CMZ中发挥的作用。如图2所示,初始浓度为50 μg·L–1的CMZ与1.0 g MnOx在反应120 h后,经计算得到MnOx对CMZ的吸附去除量为4.71 μg·g–1,氧化去除量为6.334 μg·g–1;铜绿微囊藻和QJX-1对CMZ的细胞吸附量为0.245 μg·g–1,生物降解量为1.307 μg·g–1。以上结果表明MnOx和微生物在CMZ去除中均发挥了作用[2]。
-
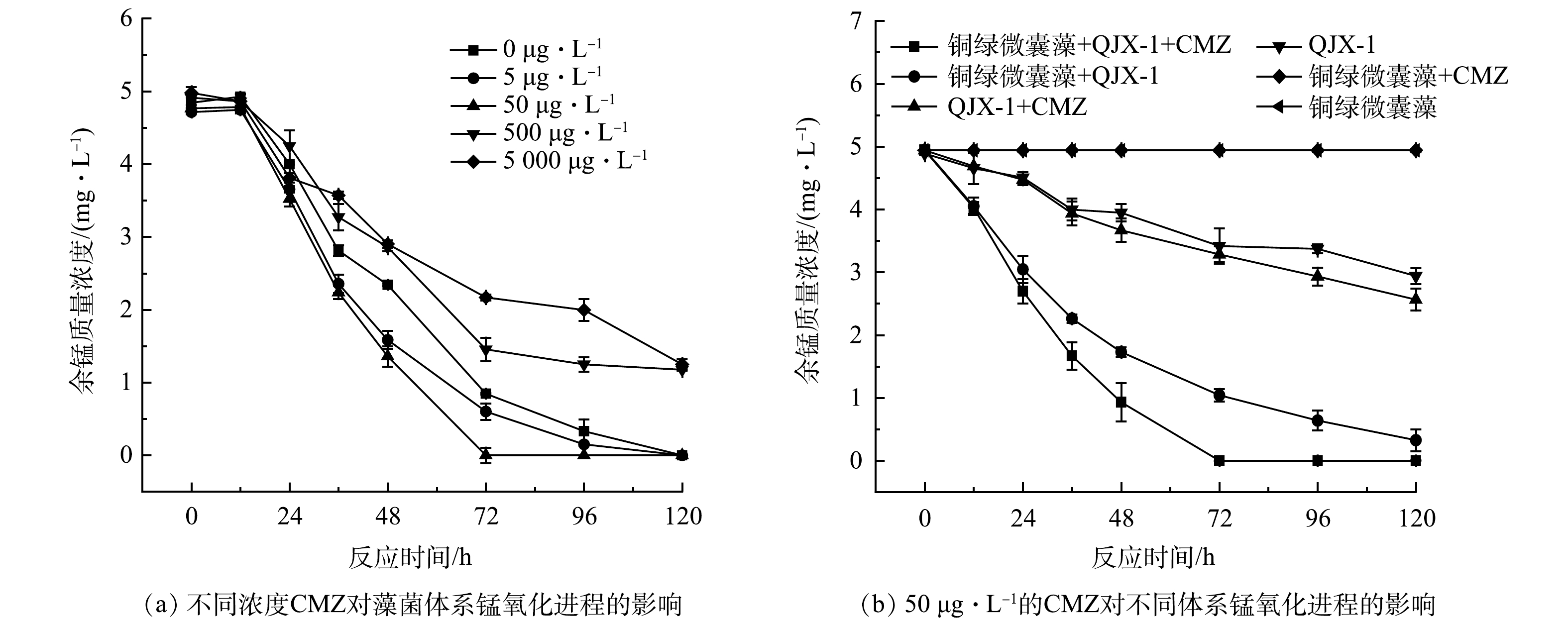
在含不同质量浓度CMZ的藻菌体系余锰质量浓度变化的如图3(a)所示。可见,在36 h之前,含有不同质量浓度CMZ藻菌体系的锰氧化程度差异不明显,在36 h之后,5 μg·L–1和50 μg·L–1的CMZ均使锰氧化进程加快。其中,CMZ浓度为50 ppb的实验组与空白组的锰氧化程度差异最大, 50 μg·L–1的 CMZ组的锰离子在72 h已经全部被氧化,空白组的锰离子在120 h才全部被氧化。而500 μg·L–1和5 000 μg·L–1的CMZ减缓了锰氧化进程,在120 h时,这2个组的余锰质量浓度为1.17 mg·L–1。
在高浓度的污染物暴露条件下,藻和细菌的相互作用会受到抑制。25 μg·L–1的乙草胺加剧了藻菌体系中藻类的代谢应激、细胞凋亡和细胞裂解,使得藻类生长繁殖受到抑制,藻菌体系被破坏[32]。微藻对于头孢拉定的耐受性较好,但高浓度的头孢拉定会影响细菌的代谢活性,进而影响藻和细菌生物共代谢作用[33]。本研究中,500 μg·L–1和5 000 μg·L–1的CMZ质量浓度过高,无法使得藻和细菌进行正常的生命活动,进而难以通过相互作用将Mn2+氧化。
选择50 μg·L–1 的CMZ为实验浓度,研究了CMZ对藻菌体系、纯菌体系和纯藻体系锰氧化进程的影响情况。如图3(b)所示,在没有CMZ的情况下,纯藻体系不会发生锰氧化,而铜绿微囊藻的引入促进了QJX-1锰氧化,在120 h时,藻菌体系余锰质量浓度为0.3 mg·L–1,纯菌体系余锰质量浓度为3.3 mg·L–1。在加入CMZ的情况下,纯藻体系仍不发生锰氧化,而CMZ对藻菌体系锰氧化的促进效果要好于纯菌组。在72 h时,加入CMZ的藻菌体系余锰质量浓度为0 mg·L–1,不加入CMZ的藻菌体系余锰质量浓度为1.2 mg·L–1。在96 h时,加入CMZ的纯菌体系中余锰质量浓度为3.2 mg·L–1,不加入CMZ的纯菌体系中余锰质量浓度为3.6 mg·L–1。
污染物可以刺激藻类和细菌分泌胞外聚合物(EPS)保护自身和互相保护,而藻类的EPS还可以作为营养物质被细菌利用,细菌又可以分泌维生素B12等生长因子帮助藻类生长繁殖。此外,污染胁迫导致的藻类和细菌的跨物种信号传导以及耐药、抗氧化基因的水平转移都会对藻菌互作体系产生显著影响[16]。因此CMZ对于该藻菌体系造成了更加复杂的影响,藻菌体系中锰氧化进程改变程度更加明显。
-
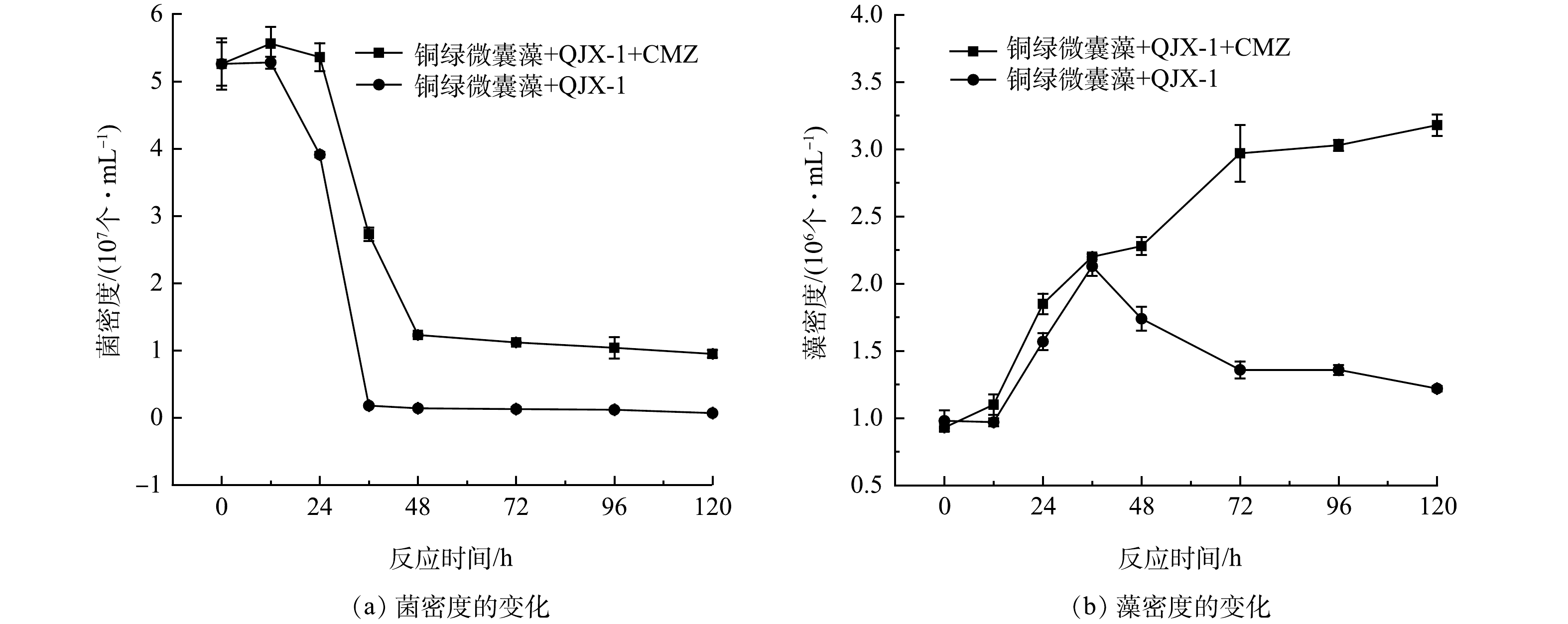
菌密度变化规律如图4(a)所示,反应12 h时实验组与对照组的菌密度均达到最大值,约为5×107 个·mL–1,然后菌密度逐渐下降。这是由于碳源在12 h时被消耗完。从48 h开始,2组的菌密度基本保持不变,但同时刻的实验组菌密度比对照组菌密度高1个数量级。如图4 (b) 所示,实验组的藻密度从1×106 个·mL–1持续上升至3.3×106 个·mL–1。对照组的藻密度在0~36 h上升,由1×106 个·mL–1上升到2.3×106 个·mL–1;在36~120 h下降,由2.3×106 个·mL–1下降到1.2×106 个·mL–1。
碳、氮、磷可以被藻类和细菌作为营养物质利用,而最近研究表明,新污染物同样可以促进藻类和细菌的生长。有研究表明,相对低浓度的抗生素(0.1 mg·L–1土霉素、0.02 mg·L–1和0.05 mg·L–1恩诺沙星)可促进小球藻生长,这可能是低浓度的抗生素刺激了小球藻生长过程中相关酶的分泌[34]。0.5、1.0和2.0 mg·L–1的氟苯尼考可刺激海洋硅藻中肋骨条藻的生长[35]。此外,细菌的生长也会受到新污染物的影响,10、20和50 mg·L–1的双酚A均可以被细菌当做碳源利用而促进自身繁殖[36]。在藻菌体系中,新污染物会带来其他影响,藻类会出现细胞裂解和细胞内物质释放,被细菌作为营养源利用[37]。吲哚乙酸(IAA)是藻类和细菌之间的跨界传导信号分子之一,其会促进藻类和细菌在环境胁迫下建立互利关系[38]。本研究设计的铜绿微囊藻和QJX-1的藻菌体系受到了CMZ的影响,在体系中加入50 μg·L–1 的CMZ后,对铜绿微囊藻和QJX-1的生长均有促进作用。
培养120 h后的铜绿微囊藻和QJX-1的形貌如图5所示,图5(a)为体系中加入了50 μg·L–1 CMZ的菌藻细胞形貌,图5(b)为体系中不加入CMZ的菌藻细胞形貌。2组实验中铜绿微囊藻和QJX-1细胞均很饱满。50 μg·L–1 CMZ对铜绿微囊藻和QJX-1的细胞表面没有迫害作用,细胞保持完整饱满。
由于藻类和细菌聚集体含有丰富的EPS,聚集体中生物体通常比个体表现出更强的污染物耐受性。与单一物种的系统相比,菌藻群落中多个物种的联合可以增强EPS的异质性,这将为新污染物吸附提供更多的结合位点,从而降低其生物利用度和毒性[39]。物理接触是藻类和细菌建立共存关系的前提,新污染物对于藻类和细菌的互作关系可以部分归因于细胞间粘附和细胞外EPS产生的变化[16]。由SEM表征结果可以看到,细菌是附着在藻类表面的,藻菌聚集体的建立降低了环境给藻细胞和细菌细胞带来的不利影响。
-
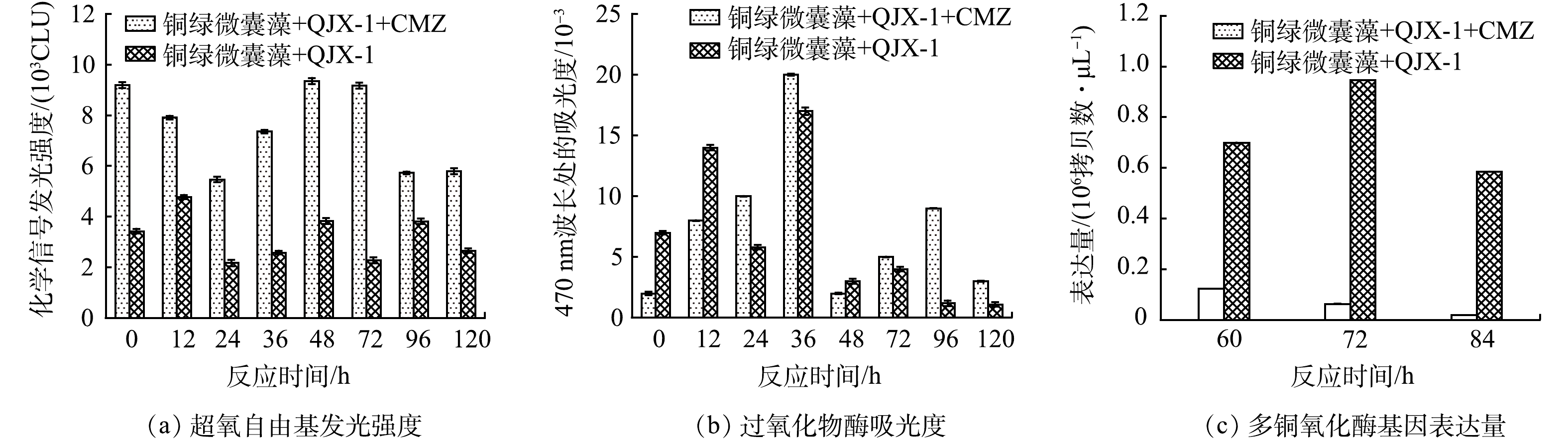
多铜氧化酶、过氧化物酶和超氧自由基被认为是锰氧化菌进行锰氧化的几种途径。超氧自由基的化学信号发光强度结果如图6(a) 所示,在每个取样的时间点,实验组的发光强度都高于对照组,差值为2 000~6 000 CLU。过氧化物酶吸光度结果如图6(b) 所示,实验组与对照组过氧化物酶的吸光度没有显著差异。多铜氧化酶表达量的结果如图6(c) 所示,实验组多铜氧化酶基因的表达量要低于对照组,差值为5.7×105~8.8×105 拷贝数·μL–1。
锰氧化菌氧化Mn2+是一个复杂的过程,包括多铜氧化酶、过氧化物酶等酶介导和PH、光驱动厌氧、超氧自由基等非酶介导的氧化作用。常洋洋等在BP-4促进QJX-1锰氧化机理研究中表明,BP-4加速了QJX-1对碳源 (酪氨酸) 的消耗而提前进入饥饿状态,超氧化物的提前产生可能是BP-4促进QJX-1锰氧化的原因[40]。张星星等在QJX-1对氧四环素的去除作用与机制中研究发现,氧四环素促进了QJX-1多铜氧化酶基因CumA的表达,提升了MnOx的生成速率[41]。以上研究说明,新污染物可以通过多种途径影响锰氧化进程。
在分析不同培养时间添加50 μg·L–1 CMZ的超氧信号发光强度时,发现在0~72 h实验组比对照组超氧信号发光强度高出4 000~6 000 CLU,且实验组的发光强度达到10 000 CLU左右;96~120 h实验组比对照组超氧信号发光强度高2 000 CLU左右,且实验组的强度降低 (6 000 CLU左右) 。而72 h之后体系中的锰离子已经被全部氧化,说明超氧自由基产生量与锰氧化进程呈现出相关性:发生锰氧化时,体系中持续产生大量的超氧自由基;锰氧化结束后,超氧自由基产生量大幅下降,信号强度下降了约50%。进而证明低浓度CMZ的添加提升了体系中超氧自由基的产生量,进而加速锰氧化进程。
-
1)生物源MnOx能通过氧化和吸附作用去除CMZ,铜绿微囊藻和QJX-1能通过生物降解和细胞吸附去除CMZ,两者均表现出对CMZ的去除能力。
2) CMZ对铜绿微囊藻和QJX-1组成的藻菌体系锰氧化进程的影响表现出低浓度促进 (5 μg·L–1和50 μg·L–1促进) ,高浓度抑制 (500 μg·L–1和
5000 μg·L–1抑制) 的现象。3)低浓度的CMZ促进了藻菌体系中铜绿微囊藻和QJX-1的生长,同条件下藻和细菌的密度更高;且不会对藻菌细胞的生理状态产生影响,细胞保持完整饱满。
4)低浓度的CMZ可提升藻菌体系中超氧自由基的产生量,进一步证明了低浓度CMZ能够促进藻菌体系对Mn2+的氧化,相同时刻体系中有更多的生物源MnOx生成。
卡马西平对藻菌体系锰氧化进程的影响及机制
Effects and mechanisms of carbamazepine on manganese oxidation process in algae-bacteria system
-
摘要: 随着工农业的发展,新污染物在水体中的检出率越来越高,严重威胁到饮用水安全。滤池作为一种运维简单的绿色水处理工艺被广泛应用,它能够依靠滤料吸附和藻菌协同作用有效去除新污染物。为了明晰新污染物对滤池中的藻菌体系的影响从而充分发挥藻菌体系对新污染物的去除作用,本研究选取铜绿微囊藻和锰氧化菌QJX-1组成的藻菌体系作为研究对象,卡马西平 (CMZ,carbamazepine) 作为新污染物代表,以对新污染物有去除能力的生物锰氧化物为切入点,全面研究了CMZ的去除效果和CMZ对该藻菌体系锰氧化的影响。研究发现:在铜绿微囊藻和QJX-1组成的藻菌体系中,生物锰氧化物对CMZ的氧化能力为6.334 μg·g–1,吸附能力为4.170 μg·g–1;藻和细菌细胞对CMZ的生物降解能力为1.307 μg·g–1,细胞吸附能力为0.245 μg·g–1,两者均表现出对CMZ的去除能力。CMZ对藻菌体系锰氧化的影响表现出低浓度促进 (5 μg·L–1、50 μg·L–1) ,高浓度抑制 (500 μg·L–1、5 000 μg·L–1) 的现象。进一步从锰氧化机制入手深入研究,发现低浓度的CMZ可以促进藻菌体系产生超氧自由基,对比不加入CMZ的藻菌体系,超氧自由基发光强度提升了4 000~6 000 CLU,进而加快了该藻菌体系的锰氧化进程。本研究从CMZ对藻菌体系锰氧化进程的影响以及影响机制进行了一系列探究,为明晰新污染物对藻菌体系的影响以及充分利用藻菌体系提高滤池的净水效能提供了较好的理论依据。Abstract: With the development of industry and agriculture, the detection rate of emerging contaminants in water is increasing, which seriously threatens the safety of drinking water. As an environmentally friendly water treatment process with simple operation and maintenance, the filters are widely used, which can effectively remove emerging contaminants by adsorption of filter media and synergistic effect of algae and bacteria. In order to clarify the effect of emerging contaminants on the algae-bacteria system in the filters and to give full play to the removal of emerging contaminants by the algae-bacteria system, this study selected the algae-bacteria system composed of Microcystis aeruginosa and manganese oxidizing bacterium QJX-1 as the object of the study, and carbamazepine (CMZ) as the representative of emerging contaminants, and the biological manganese oxide, which has the ability of removing emerging contaminants, were used as the starting point, comprehensively explored the removal of the CMZ and the effect of CMZ on manganese oxidation in the algae-bacteria system. It was found that in the algae-bacteria system composed of Microcystis aeruginosa and QJX-1, the oxidizing capacity of biological manganese oxide on CMZ was 6.334 μg·g–1 and its adsorption capacity was 4.170 μg·g–1; the biodegradation capacity of algae and bacteria cells on CMZ was 1.307 μg·g–1, and the adsorption capacity of the cells was 0.245 μg·g–1, both of them showed the removal capacity on CMZ. The effect of CMZ on the process of manganese oxidation of the system showed the phenomenon of promotion at low concentrations (5 μg·L–1, 50 μg·L–1) and inhibition at high concentrations (500 μg·L–1, 5 000 μg·L–1) . Further study from the manganese oxidation mechanism found that the low concentration of CMZ could promote the generation of superoxide radicals in the system, and compared with the system without CMZ, the luminescence intensity of superoxide radicals increased by 4 000~6 000 CLU, which then accelerated the process of manganese oxidation in the system. This study investigated the effect of CMZ on the process of manganese oxidation in the algae-bacteria system and its mechanism, which provided a better theoretical basis for clarifying the effect of the emerging contaminants on the algae-bacteria system and making full use of the algae-bacteria system to improve the water purification efficiency of the filters.
-
Key words:
- carbamazepine /
- manganese oxidation /
- algae-bacteria system /
- superoxide radicals
-

-
-
[1] ZHAO L, DENG J H, SUN P Z, et al. Nanomaterials for treating emerging contaminants in water by adsorption and photocatalysis: Systematic review and bibliometric analysis[J]. Science of the Total Environment, 2018, 627: 1253-1263. doi: 10.1016/j.scitotenv.2018.02.006 [2] WANG S Z, WANG J L. Carbamazepine degradation by gamma irradiation coupled to biological treatment[J]. Journal of Hazardous Materials, 2017, 321: 639-646. doi: 10.1016/j.jhazmat.2016.09.053 [3] HAI F I, LI X, PRICE W E, et al. Removal of carbamazepine and sulfamethoxazole by MBR under anoxic and aerobic conditions[J]. Bioresource Technology, 2011, 102(22): 10386-10390. doi: 10.1016/j.biortech.2011.09.019 [4] AKPINAR I, YAZAYDIN A O. Rapid and efficient removal of carbamazepine from water by UiO-67[J]. Industrial & Engineering Chemistry Research, 2017, 56(51): 15122-15130. [5] KHAREL S, STAPF M, MIEHE U, et al. Removal of pharmaceutical metabolites in wastewater ozonation including their fate in different post-treatments[J]. Science of the Total Environment, 2021, 759: 143989. doi: 10.1016/j.scitotenv.2020.143989 [6] WANG Z, CHU Y, CHANG H, et al. Advanced insights on removal of antibiotics by microalgae-bacteria consortia: A state-of-the-art review and emerging prospects[J]. Chemosphere, 2022, 307(Pt 4): 136117. [7] FU W, LI X, YANG Y, et al. Enhanced degradation of bisphenol A: Influence of optimization of removal, kinetic model studies, application of machine learning and microalgae-bacteria consortia[J]. Science of the Total Environment, 2023, 858(Pt 2): 159876. [8] MASUD N, DAVIES-JONES A, GRIFFIN B, et al. Differential effects of two prevalent environmental pollutants on host-pathogen dynamics[J]. Chemosphere, 2022, 295: 133879. doi: 10.1016/j.chemosphere.2022.133879 [9] LIANG L, BAI X, HUA Z L. Enhancement of the immobilization on microalgae protective effects and carbamazepine removal by Chlorella vulgaris[J]. Environmental Science and Pollution Research, 2022, 29(52): 79567-79578. doi: 10.1007/s11356-022-21418-0 [10] LI X Q, DE TOLEDO R A, WANG S P, et al. Removal of carbamazepine and naproxen by immobilized Phanerochaete chrysosporium under non-sterile condition[J]. New Biotechnology, 2015, 32(2): 282-289. doi: 10.1016/j.nbt.2015.01.003 [11] CHENG Z W, LU L C, KENNES C, et al. Treatment of gaseous toluene in three biofilters inoculated with fungi/bacteria: Microbial analysis, performance and starvation response[J]. Journal of Hazardous Materials, 2016, 303: 83-93. doi: 10.1016/j.jhazmat.2015.10.017 [12] ERBA C M, TANGERINO E P, De CARVALHO S L, et al. Removal of diclofenac, ibuprofen, naproxen, and paracetamol in ecological filter followed by granular carbon filter biologically active[J]. Engenharia Sanitaria e Ambiental, 2013, 17(2): 137-142. [13] SEYMOUR J R, AMIN S A, RAINA J B, et al. Zooming in on the phycosphere: the ecological interface for phytoplankton-bacteria relationships[J]. Nature Microbiology, 2017, 2(7): 17065. doi: 10.1038/nmicrobiol.2017.65 [14] WANG Z Y, CHU Y H, CHANG H X, et al. Advanced insights on removal of antibiotics by microalgae-bacteria consortia: A state-of-the-art review and emerging prospects[J]. Chemosphere, 2022, 307: 136117. doi: 10.1016/j.chemosphere.2022.136117 [15] ZHANG J, XIA A, YAO D, et al. Removal of oxytetracycline and ofloxacin in wastewater by microalgae-bacteria symbiosis for bioenergy production[J]. Bioresource Technology, 2022, 363: 127891. doi: 10.1016/j.biortech.2022.127891 [16] YOU X Q, XU N, YANG X, et al. Pollutants affect algae-bacteria interactions: A critical review[J]. Environmental Pollution, 2021, 276: 116723. doi: 10.1016/j.envpol.2021.116723 [17] HU W, LIANG J, JU F, et al. Metagenomics unravels differential microbiome composition and metabolic potential in rapid sand filters purifying surface water versus groundwater[J]. Environmental Science & Technology, 2020, 54(8): 5197-5206. [18] JOH G, CHOI Y S, SHIN J K, et al. Problematic algae in the sedimentation and filtration process of water treatment plants[J]. Journal of Water Supply Research and Technology-Aqua, 2011, 60(5): 319. doi: 10.2166/aqua.2011.000 [19] ZHOU H, FU C. Manganese-oxidizing microbes and biogenic manganese oxides: Characterization, Mn(II) oxidation mechanism and environmental relevance[J]. Reviews in Environmental Science and Bio-technology, 2020, 19(3): 489-507. doi: 10.1007/s11157-020-09541-1 [20] FURGAL K M, MEYER R L, BESTER K. Removing selected steroid hormones, biocides and pharmaceuticals from water by means of biogenic manganese oxide nanoparticles in situ at ppb levels[J]. Chemosphere, 2015, 136: 321-326. doi: 10.1016/j.chemosphere.2014.11.059 [21] CHEN R, ZHANG H, WANG J, et al. Insight into the role of biogenic manganese oxides-assisted gravity-driven membrane filtration systems toward emerging contaminants removal[J]. Water Research, 2022, 224: 119111. doi: 10.1016/j.watres.2022.119111 [22] REN C Y, XU Q J, ALVAREZ P J J, et al. Simultaneous antibiotic removal and mitigation of resistance induction by manganese bio-oxidation process[J]. Water Research, 2023, 244: 120442. doi: 10.1016/j.watres.2023.120442 [23] 戚菁, 林泽淼, 赵济金, 等. 一种藻类提升细菌锰氧化功能的方法: CN202111084994 [P]. 2021-12-07. [24] BAI Y, CHANG Y, LIANG J, et al. Treatment of groundwater containing Mn(II), Fe(II), As(III) and Sb(III) by bioaugmented quartz-sand filters[J]. Water Research, 2016, 106: 126-134. doi: 10.1016/j.watres.2016.09.040 [25] QI J, SONG Y, LIANG J, et al. Growth inhibition of Microcystis aeruginosa by sand-filter prevalent manganese-oxidizing bacterium[J]. Separation and Purification Technology, 2021, 256: 117808. doi: 10.1016/j.seppur.2020.117808 [26] SHEN H, SONG L. Comparative studies on physiological responses to phosphorus in two phenotypes of bloom-forming Microcystis[J]. Hydrobiologia, 2007, 592(1): 475-486. doi: 10.1007/s10750-007-0794-3 [27] GESZVAIN K, BUTTERFIELD C, DAVIS R E, et al. The molecular biogeochemistry of manganese(II) oxidation[J]. Biochemical Society Transactions, 2012, 40: 1244-1248. doi: 10.1042/BST20120229 [28] WANG R, WANG S, TAI Y P, et al. Biogenic manganese oxides generated by green algae Desmodesmus sp WR1 to improve bisphenol A removal[J]. Journal of Hazardous Materials, 2017, 339: 310-319. doi: 10.1016/j.jhazmat.2017.06.026 [29] VILLALOBOS M, LANSON B, MANCEAU A, et al. Structural model for the biogenic Mn oxide produced by Pseudomonas putida[J]. American Mineralogist, 2006, 91(4): 489-502. doi: 10.2138/am.2006.1925 [30] ZHANG H C, HUANG C H. Oxidative transformation of fluoroquinolone antibacterial agents and structurally related amines by manganese oxide[J]. Environmental Science & Technology, 2005, 39(12): 4474-4483. [31] ZHOU N Q, LIU D F, MIN D, et al. Continuous degradation of ciprofloxacin in a manganese redox cycling system driven by Pseudomonas putida MnB-1[J]. Chemosphere, 2018, 211: 345-351. doi: 10.1016/j.chemosphere.2018.07.117 [32] WANG Z K, YU S M, NIE Y F, et al. Effect of acetochlor on the symbiotic relationship between microalgae and bacteria[J]. Journal of Hazardous Materials, 2024, 463: 132848. doi: 10.1016/j.jhazmat.2023.132848 [33] WANG Y Q, CHEN P P, YU X F, et al. Algae-bacteria symbiotic constructed wetlands for antibiotic wastewater purification and biological response[J]. Frontiers in Microbiology, 2022, 13: 1044009. doi: 10.3389/fmicb.2022.1044009 [34] WANG Y, GONG X, HUANG D, et al. Increasing oxytetracycline and enrofloxacin concentrations on the algal growth and sewage purification performance of an algal-bacterial consortia system[J]. Chemosphere, 2022, 286(Pt 3): 131917. [35] LIU W, MING Y, HUANG Z, et al. Impacts of florfenicol on marine diatom Skeletonema costatum through photosynthesis inhibition and oxidative damages[J]. Plant Physiology and Biochemistry, 2012, 60: 165-170. doi: 10.1016/j.plaphy.2012.08.009 [36] EIO E J, KAWAI M, NIWA C, et al. Biodegradation of bisphenol A by an algal-bacterial system[J]. Environmental Science and Pollution Research, 2015, 22(19): 15145-15153. doi: 10.1007/s11356-015-4693-2 [37] STOCKER R, SEYMOUR J R, SAMADANI A, et al. Rapid chemotactic response enables marine bacteria to exploit ephemeral microscale nutrient patches[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(11): 4209-4214. [38] MENG F, HUANG W, LIU D, et al. Application of aerobic granules-continuous flow reactor for saline wastewater treatment: Granular stability, lipid production and symbiotic relationship between bacteria and algae[J]. Bioresource Technology, 2020, 295: 122291. doi: 10.1016/j.biortech.2019.122291 [39] TANG J, WU Y H, Esquivel-Elizondo S, et al. How Microbial Aggregates Protect against Nanoparticle Toxicity[J]. Trends in Biotechnology, 2018, 36(11): 1171-1182. doi: 10.1016/j.tibtech.2018.06.009 [40] CHANG Y, BAI Y, HUO Y, et al. Benzophenone-4 Promotes the Growth of a Pseudomonas sp. and Biogenic Oxidation of Mn(II)[J]. Environmental Science & Technology, 2018, 52(3): 1262-1269. [41] ZHANG X, LI S, QI W, et al. Mechanism of oxytetracycline removal by a manganese-oxidizing bacteria Pseudomonas sp. QJX-1[J]. Acta Scientiae Circumstantiae, 2021, 41(11): 4494-4500. -




 下载:
下载: