-
随着城市化的快速发展,污废水的排放量也在逐渐增加。但污废水处理后存在总氮和氨氮指标仍无法满足《污水综合排放标准:GB 20426—2006》排放标准的现象,导致湖泊呈现水体富营养化[1-3]。因此传统的脱氮技术已经不能满足当前人们生产生活的需要。20世纪70年代,BRODA[4]根据化学热力学理论预言了厌氧氨氧化(anaerobic ammonia oxidation, Anammox)存在的可能。1995年MULDER et al[5]在流化床生物脱氮反应器中首次发现了厌氧氨氧化现象的存在。厌氧氨氧化细菌(anaerobic ammonia-oxidizing bacteria, AnAOB)的发现及其技术的发展,促进了短程硝化技术的发展并对污水中氨氮和总氮的处理提供了另一种可能[6]。
AnAOB最适生长的温度为30~35 ℃[7-8],然而国内大部分北方地区的冬季气温远低于该温度范围。因此研究低温条件下厌氧氨氧化技术具有重要意义。本研究就近年来国内外报道的低温条件下厌氧氨氧化技术的研究展开系统性的论述。
-
全世界的海洋、湖泊和河流中有50%的氮素循环是由厌氧氨氧化完成的[9]。20世纪末,STROUS et al[10]从分子水平上揭示了AnAOB的细胞结构及生理特性。随后,DAMSTE et al[11]发现AnAOB的细胞内含有独特的梯形磷酯类化合物,该化合物可作为生物标记来鉴别AnAOB的存在。研究至今,根据其反应介质分为羟胺(NH2OH)和一氧化氮(NO)2种反应模型[12-13]。根据16S rRNA同源性可将AnAOB归入浮霉菌纲(Planctomycetia)。以16S rRNA序列差异5%为标准,AnAOB目前共为6个属,分别为Anammoxoglobus[14]、 Anammoximicrobium[15]、Brocadia[16-18]、Jettenia[19]、Kuenenia[20]和Scalindua[21-22]。厌氧氨氧化反应与传统硝化反硝化反应相比具有不需要外加碳源、耗氧耗能和不需加入中和试剂[23]等优点。厌氧氨氧化反应,见式(1 ~ 5):
截至2019年,厌氧氨氧化技术的应用已达到200多项[24],其中对于市政污水(WWTP)[25]、污泥消化液[26]和垃圾渗滤液[27]等废水处理拥有极大的潜力。在国外,厌氧氨氧化技术早已应用于实际工程应用,如,在2002年6月荷兰建成了世界上第一座利用厌氧氨氧化工艺的污水厂——鹿特丹市政污水处理厂[28]。在国内,绝大多数污水处理厂的水温达不到AnAOB生存的最佳温度(30~35 ℃),使得AnAOB的活性下降,引起脱氮效率的降低[29]。因此,研究低温条件下,实现高效快速的厌氧氨氧化脱氮效果显得尤为重要。
在实际工程应用中,厌氧氨氧化工艺常常与短程硝化工艺组合在一起,其中极具代表性的短程硝化反应是Sharon-Anammox(Single Reactor System for High Activity Ammonia Removal over Nitrite)工艺和CANON(Completely Autotrophic Nitrogen Removal over Nitrite)工艺,这2种工艺可应用于主流的厌氧氨氧化工艺。
-
AnAOB是一种化能自养型细菌,属于革兰氏阴性菌,且绝大多数是中温菌,最适的生长温度为30~35 ℃[30]。但也有研究表明,在不同的自然环境中,AnAOB的最适生长温度不同,见表1。如,HU et al[31]发现长期处于12 ℃下的AnAOB,其最适温度为25 ℃;KAWAGOSHI et al[32]发现海洋中的AnAOB最适温度为25 ℃;NAKAJIMA et al[33-34]发现在北极海洋的沉淀污泥中,AnAOB最适生长温度为15 ℃,甚至有的AnAOB在−1.3 ℃下可以存活。除此之外,GILBERT et al[35]发现长期处于低温培养下的AnAOB,其在10 ℃下的活性比降温至10 ℃下的AnAOB活性稍高。但这并不表明,所有处于低温培养下的AnAOB都能在低温下提高活性。此外,研究表明,温度每降低5 ℃,AnAOB其生长速率会减缓30%~40%[7]。
温度是影响微生物酶促反应的主要因素之一。其主要包括:1)影响酶催化反应速率;2)影响基质扩散到细胞的速率[41] 。由于AnAOB独特的细胞结构,温度的降低往往会降低细胞内酶促反应的速率。从而导致AnAOB增殖缓慢,倍增时间及反应器启动时间过长。常温条件下厌氧氨氧化反应器启动时间一般长达2个月以上[42-43]。此外,在研究厌氧氨氧化工艺时,发现胞外聚合物(extracellular polymers, EPS)、活化能[44](activation energy, Ea)、群体感应[45-46](quorum sensing, QS)及AnAOB代谢产物丰度和代谢通路活性[47]均对脱氮能力产生影响。
-
AnAOB生长周期较长,其污泥絮体及颗粒的完整性对于厌氧氨氧化的高效脱氮和稳定十分关键。据相关文献报道,EPS有利于细胞膜的稳定,可以保护AnAOB生物膜的微观结构及功能的完整[48-49],因此EPS的含量对AnAOB起着十分关键的作用。WILEN et al[50]研究污水厂中污泥絮体的组成和沉降性时发现,夏季EPS含量低于冬季,其相关成分与温度呈负相关。宋成康等[51]通过阶梯式降温再升温的方法,发现在15 ~ 33 ℃的条件下,EPS的含量逐渐升高,但在10 ℃时,EPS含量较低。前者是由于逐渐降低温度,AnAOB产生了应激反应,EPS含量增加保证了污泥絮体及颗粒的稳定性。后者是由于低温导致细胞代谢缓慢,从而减少了EPS的分泌量。可以看出,EPS含量与温度紧密相关,采用阶梯式降温的方法,需要控制在一定的温度范围,低于该温度范围EPS含量不足以保护AnAOB免受外界伤害。
-
活化能是指分子从常态转变为容易发生反应的活跃状态所需要的能量,活化能越小,生化反应越容易。在废水生物处理中,通常生化反应的活化能取值范围为8.37 ~ 83.68 kJ/mol[52]。厌氧氨氧化活化能在不同温度下的对比,见表2。
表2可知,不同温度下AnAOB的活化能各不相同,其原因可能是不同实验所驯化的污泥各不相同。因此,在低温下对厌氧氨氧化活化能的影响还有待进一步的研究。
-
霍唐燃等[47]研究表明,在低温条件下的AnAOB菌群代谢物中脂肪酸延长、CO2的固定、TCA循环和丙酮酸下调可能是导致脱氮效率降低的原因,但菌群中RNA合成水平,腐胺与信号分子合成上调,通过转录、调控膜结构和膜组成使得AnAOB菌群可以适应较低的温度。通过代谢产物的丰度及代谢通路活性,从而判断AnAOB在低温下的生理机制。此外,郑贝贝[45]研究发现,群体感应信号通过改变细胞膜结构和冷应激蛋白含量来影响AnAOB的低温适应性。但由于相关实验并没有解释其机理,因此还需要进行大量的研究。彭永臻等[46]研究表明,AnAOB菌群具有分泌自诱导物(autoinducers, AI)的能力,并可以通过提高AI的含量来迅速加强AnAOB的活性,使其在底物竞争中成为优势菌群,并可以在厌氧氨氧化工艺中有快速启动的作用。但由于目前没有获得一株纯种AnAOB,因此对其机理研究较为困难。同时在低温下对厌氧氨氧化的群体感应研究少有报道,因此若能对其深入探讨,在生态学层面和实际工程应用都具有重大的意义。
-
与厌氧氨氧化技术相比,传统的脱氮技术存在着较多的不足。如,传统硝化反硝化技术需外加碳源及供氧设备作为支撑且占地面积大,所产生的剩余污泥较多[53]。因此以厌氧氨氧化为主的新工艺,为脱氮处理开辟了新的思路。
Sharon-Anammox的基本工艺流程,见图1。该工艺是将硝化作用控制在亚硝酸盐阶段,接着通过厌氧氨氧化作用直接将亚硝酸盐转化为氮气,从而达到脱氮的效果。该工艺除了AnAOB起到重要作用,还需要促进氨氧化细菌(ammonia-oxidizing bacteria, AOB)的生长,同时抑制亚硝酸盐氧化细菌(nitrite-oxidizing bacteria, NOB)的生长。祝贵兵等[54]发现升高温度可以筛选亚硝化细菌,淘汰硝化细菌,从而促进短程硝化的作用。由于该工艺具有操作简便、脱氮效率高、投资及运行费用低等优点[55-56],成为许多污水厂提标改造的首选工艺。但该工艺需在高温和高氨氮质量浓度下运行,若使其在低温下正常稳定运行,还需要大量的研究。
CANON工艺是将Sharon工艺与Anammox工艺结合,在同一个反应器内进行[57]。该工艺不需要外加碳源且运行费用与投资较低。与Sharon-Anammox工艺相同的是,其所需温度及氨氮质量浓度较高,反应机理都是将氨氮氧化成部分亚硝态氮,与剩下的氨氮进行厌氧氨氧化反应生成氮气。李冬等[58]研究在12.7 ~ 18.3 ℃下,使用CANON工艺,总氮去除率可达86.7%,氨氮几乎可以完全去除,但前期会导致NOB出现过量增殖的现象,使得其在低氨氮浓度条件下总氮脱除下降至75.3%。研究表明,在低温低氨氮条件下,CANON工艺应该抑制NOB的富集及活性,增强AOB及AnAOB的丰度及活性[59-61]。因此,对于CANON工艺其运行条件还需要进行优化,从而达到在低温条件下高效脱氮并稳定运行的状态。
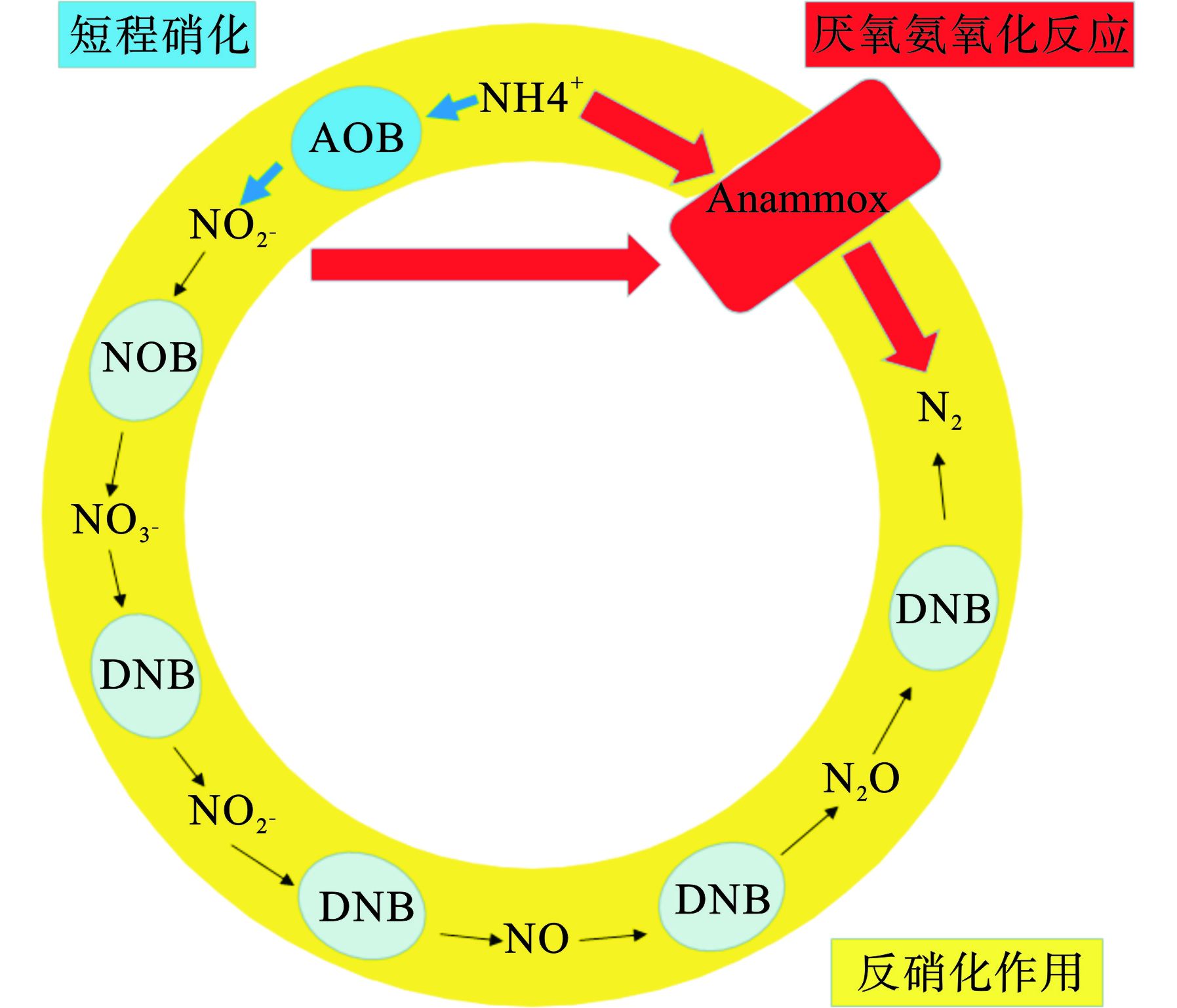
主流厌氧氨氧化工艺分为主流短程硝化-厌氧氨氧化工艺和主流短程反硝化-厌氧氨氧化工艺,见图2。
主流短程硝化-厌氧氨氧化工艺具有不需要外加碳源[62]、产生的剩余污泥量较少[63]和节省约60%曝气量[64]等优点。经研究表明,部分硝化反应器的最适运行温度为30 ~ 35 ℃[65]。主流短程反硝化-厌氧氨氧化工艺不仅脱氮速率高,而且可以降低55%的剩余污泥、节省25%曝气量[66]。AGRAWAL et al[67]在10 ~ 20 ℃条件下,通过采用MBBR反应器与SBR反应器检测AnAOB、AOB和NOB菌群的稳定性。研究表明,MBBR反应器中菌群稳定性更高,与SBR反应器相比更适合主流厌氧氨氧化工艺。AKABOCI et al[68]采用SBR反应器在15 ~ 25 ℃条件下成功稳定运行主流厌氧氨氧化工艺,并且保持较高的脱氮效率。尽管降温后的AnAOB活性下降,但仍可以保证主流厌氧氨氧化工艺的稳定运行。LV et al[69]采用SBR反应器,建立了AnAOB和异养细菌(heterotrophic bacteria, HB)共存系统。温度从35降至10 ℃,脱氮效率保持在90%以上。温度降至10 ℃,Denutrotisoma属呈下降趋势,而Comamonadaceae属呈上升趋势。在10 ℃时,系统中颗粒污泥和絮状污泥的厌氧菌活性对比表明,尽管絮凝污泥中的厌氧菌属的丰度比颗粒污泥的丰度低得多,但厌氧氨氧化活性没有明显差异。絮凝污泥中Comamonadaceae属和Chloroflexales属的丰度比颗粒污泥中的丰度高得多,这表明它们在低温下对厌氧氨氧化活性起着关键作用。该结果表明在主流废水处理过程中,微生物间的相互作用对低温下厌氧氨氧化反应有着实际应用意义。据报道[70] Candidatus Brocadia在低温下的主流厌氧氨氧化工艺中是优势菌属。
侧流厌氧氨氧化工艺一般处理氨氮浓度较高的废水,其与主流厌氧氨氧化工艺的区别在于可以处理污泥消化液[71]。传统的A/O工艺处理市政污水联合侧流厌氧氨氧化系统[72],见图3。目前用于侧流式脱氮工艺的反应器主要是SBR反应器,其中大多数以DEMON(deammonification)工艺运行。GILBERT et al[73]采用4个不同实验室反应器,以SBR反应器和MBBR反应器2种不同配置为主,通过缓慢降温的方法(10 ~ 20 ℃),研究不同反应器对部分硝化-厌氧氨氧化的影响。研究结果表明,悬浮在水中的AnAOB在15 ℃时受到影响。而附着在生物膜载体上的AnAOB在温度低于13 ℃时仍可以保持一定的活性和数量。此外,与较薄的生物膜相比,较厚的生物膜对厌氧氨氧化活性的影响较小,并且MBBR中AnAOB菌群较SBR相比更加稳定[73-74]。
同时部分硝化、厌氧氨氧化和反硝化(simultaneous partial nitrification, ANAMMOX, and denitrification, SNAD)工艺在低温、低基质条件下的难点在于如何抑制硝化细菌的富集,从而提高脱氮效率[74]。李冬等[58]通过先启动厌氧氨氧化耦合反硝化(simultaneously anaerobic ammonia oxidation and denitrification, SAD)工艺,从而抑制NOB的富集,为后续的SNAD工艺提供良好的基础。研究表明在12.7 ~ 18.3 ℃下,通过先启动SAD工艺,再启动SNAD工艺,氨氮几乎完全去除,总氮去除率达到89.1%。在低氨氮浓度的运行时,氨氮浓度<1.0 mg/L,总氮浓度<6 mg/L。因此,可以通过抑制硝化细菌的富集,使该工艺能够稳定运行并高效脱氮。
-
在低温条件下,AnAOB的活性会大大降低,提高AnAOB活性的一种方法是在其工艺中加入无机物,使得其可能发生结构变化或者提高相应酶的活性。
石墨烯是一种由碳原子以sp2杂化轨道组成六角型呈蜂巢晶格的二维碳纳米材料。通过还原氧化石墨烯(reduced graphene oxide, RGO)来增强AnAOB的活性。WANG et al[75-76]在30 ℃以上的温度下,通过RGO来增强AnAOB的活性,TOMASZEWSKI et al[77]在10 ~ 30 ℃下研究发现,在13 ℃时加入15 mg RGO/L可促进AnAOB的活性达28%,超过40 mg RGO/L的浓度会导致工艺抑制,但加入50 mg RGO/L时高达30%,因此得到在20 ~ 45 RGO/g VSS(volatile suspended solids)范围内为最佳值。统计分析表明,在较低的温度(20 ℃)下,AnAOB的活性增强,这可能与厌氧氨氧化动力学的变化有关。通过观察和相关文献报道表明,RGO可以作为催化剂,增加酶的活性使其更接近活化能[78]。这些发现有助于在低温条件下使用RGO,降低废水处理系统中的成本。ZHANG et al[79]采用生物过滤器,在14 ~ 16 ℃的条件下研究了1 mg/L的重金属离子对AnAOB的生物活性以及厌氧氨氧化过程中微生物群落的影响。研究表明,Cu2+与Zn2+在短期内可以提高AnAOB的活性,但长时间的接触会对AnAOB的活性产生抑制作用,而Fe2+在短期内对活性产生抑制作用,长时间接触可以提高细菌活性。此外,Cu2+对厌氧氨氧化影响大于 Zn2+,而Fe2+对厌氧氨氧化的影响最小。最后,通过观察微生物的群落发现Cu2+与Zn2+的出现降低了Candidatus Kuenenia的含量,而Fe2+的出现增加了Candidatus Kuenenia的含量。研究表明,生物膜中的胞外聚合物具有突出的铁吸附能力,这是帮助AnAOB抵抗Fe2+的关键因素,并且Candidatus Kuenenia的富集可以用来处理具有重金属离子含氮废水[80]。
唐政坤等[81]采用UASB反应器,在12 ℃条件下通过投加0.04 mmol/L Ca2+,使NH4+-N、NO2−-N去除率分别达到65%、68%,总氮的去除负荷提高至0.200 kg/(m3·d)。研究表明,投加适量的Ca2+可以提高厌氧氨氧化污泥的脱氮效率,但投加过量会导致颗粒污泥外层厚度增加,降低传质作用,从而降低脱氮效率。WANG et al[82]通过控制温度的方法,通过连续搅拌反应器(continuously stirred tank reactor, CSTR)来研究不同浓度NaCl对厌氧氨氧化的影响,表明通过不断加入NaCl并提升温度的方法可以恢复活性,但再次降温厌氧氨氧化活性仍急剧下降。此外,加入NaCl使得EPS增加并降低沉速。
综上可知,许多研究在低温下投加适量的NaCl等无机物,增加AnAOB活性,提高脱氮效率,使得厌氧氨氧化工艺在低温下稳定运行。由于不同的无机物对于AnAOB中不同菌属及酶的活性作用不同,因此所用的量也不相同。大部分无机物成本较低且方便运输,与其他方法相比,投加无机物应用于实际工程的可能性较大。
-
提高AnAOB活性的方法,除了加入无机物之外,还可以通过加入有机物来影响AnAOB的活性。OSAKA et al[83]采用多孔聚酯非织造布,在 18 ~25 ℃下富集AnAOB菌群,总氮去除率可以达到0.07 ~ 0.26 kg/(m3·d),拥有良好的脱氮效能。KHANH et al[84]采用聚乙烯醇(PVA)凝胶及质量分数为1%的藻酸作为AnAOB的包埋材料,在(25±0.5)℃时,脱氮负荷达到8.0 kg/(m3·d) 。张硕等[85]采用UASB反应器进行厌氧氨氧化连续流的培养,在12 ℃条件下,投加不同浓度的海藻糖,观察厌氧氨氧化反应器的脱氮效率,研究表明投加0.1 mmol/L海藻糖脱氮效率最好,其NH4+-N、NO2−-N去除率分别上升为69%和73%,总氮的去除负荷可以提高26%左右。ZHU et al[86]发现甘氨酸甜菜碱(glycine betaine, GB)可以稍微增强低温条件下的脱氮效能,作为低温保护剂,防止细胞和酶的冻融损伤。这对于低温下厌氧氨氧化很有帮助。WANG et al[82]在20 ℃条件下,研究了添加GB对于加入不同浓度NaCl厌氧氨氧化的影响。当加入8 g/L的NaCl时抑制了厌氧氨氧化活性,GB有益于缓解活性的抑制。但当加入10 g/L的NaCl时,GB对于缓解抑制是无效的。研究表明,在低NaCl浓度下,GB的添加可以缓解抑制厌氧氨氧化活性。除此之外,在相同的温度条件下,加入35 mg/L的苯酚,AnAOB的活性仅为22%,当每天排放一定量的污泥并添加新的污泥,苯酚浓度降为20 mg/L时,反应器可稳定且高效运行,EPS产量增加。但沉降速度降低,以及对AnAOB中起代谢作用的肼脱氢酶(Hydrazine dehydrogenase, HDH)有所影响。
-
在低温下提高AnAOB活性的方法,除了通过添加有机物、无机物而改变其细菌结构,提高相关酶活性等方法,有部分研究者通过超声波辐射等方法,提高厌氧氨氧化活性的方法。LOTTI et al[87]在15 ℃采用搅拌回流等手段来强化传质功能,研究表明在低温下厌氧氨氧化的除氮效率可以达到75% ~ 80%。YU et al[88]采用低强度超声波辐射的方法,使得在14.8 ℃条件下,厌氧氨氧化的总氮去除负荷提高到3.96 kg/(m3·d) 。ZHANG et al[89]在(20±1)℃温度条件下,采用中低频脉冲电场(pulsed electric field, PEF)时,厌氧氨氧化工艺的除氮效率增加。但该研究仅在中低频率下进行试验,并没有在其他频率下试验,因此还具有一定的局限性。ZHANG et al[90]在(16±1)℃温度条件下,采用不同频率的PEF对厌氧氨氧化工艺的影响。研究表明,中等频率的PEF可以通过提高离子迁移速率和细胞膜通透性来有效增强关键酶的活性,甚至可以增强AnAOB的活性。而且,PEF的中频可以刺激细胞产生EPS并保持较高的PN/PS水平,有利于AnAOB颗粒污泥的稳定性。由于厌氧氨氧化的最佳pH范围为7.0 ~ 7.5[91],TOMASZEWSKI et al[92]研究表明,最佳pH的范围随温度降低而变窄,因此可以通过校正和控制pH来提高低温下厌氧氨氧化工艺的效率。
综上可知,可以通过超声波、脉冲电场等其他方法,提高低温下厌氧氨氧化工艺的脱氮效率,保证厌氧氨氧化的稳定运行。尽管与添加适量的无机物或有机物相比较,这些方法仅处于实验室阶段,且有些方法成本较高,但由于不需要投加药剂,不会产生二次污染,因此通过不断地深入研究,其未来的应用前景仍不可忽视。
-
研究表明,在(32±1)℃范围内,AnAOB的活性较高,增殖时间需要长达11 d。相比于上述适宜温度,在常温低氨氮条件下,厌氧氨氧化需要启动时间更长[93-94],脱氮效率随温度的降低而快速下降[95]。目前大部分的研究者仍然将厌氧氨氧化反应器在中等水温(25 ℃)的状态下进行快速启动[96-97]。因此,选用合适的反应器也显得尤为重要。常见的在低温下运行成功的厌氧氨氧化反应器,见表3。
张彦江等[94]使用UASB反应器,经过59 d成功在常温下(20 ~ 29 ℃)启动了厌氧氨氧化工艺,并实现了在27 ℃下快速启动且总氮去除率达到了80%以上,随后采用阶梯式降温至22 ℃,仍然保持高效率脱氮。LIU et al[102]采用UASB厌氧氨氧化反应器,在15 ~ 17 ℃低强度条件下,通过高通量测序技术研究了污泥中种群的异质性。研究表明,污泥中70%的菌属为Candidatus Jettenia,且污泥尺寸<400 μm,从而得出中小型尺寸的污泥可能对脱氮过程有重要作用。
DE et al[103]采用SBR反应器,从30 ℃分别降低到12.5和10 ℃,并且分别连续培养140 d,得到82和92 mg NH4+-N/g VSS·d的去除率,并且厌氧氨氧化的沉降颗粒粒径从30 ℃的1.2 mm增加到10 ℃的1.6 mm。研究表明,降低温度不会对AnAOB颗粒形成不利影响,甚至可以增大颗粒粒径。这对在低温条件下厌氧氨氧化工艺作为以后的主流工艺提供了新的帮助。李海玲等[104]使用SBR反应器,采用升温再降温的方法(20 ~ 27 ℃),以及缩短沉淀时间的方法使得在常温下30 d实现厌氧氨氧化颗粒污泥启动。表明厌氧氨氧化颗粒污泥能够通过控制温度在低基质下快速启动。
张永辉等[105]在进水浓度相同,温度在25、30和35 ℃条件下,使用ASBR反应器通过持续不断地缩短水力停留时间(hydraulic retention time, HRT),使得3个厌氧氨氧化反应器分别在117、90和75 d成功启动。之后分别通过突然降温和阶梯式降温的方式,将温度从30 降到15 ℃,测出采用阶梯式降温的AnAOB活性(specific anammox activity, SAA)更高。最后,对阶梯式降温后的厌氧氨氧化反应器进行快速升温,但此时的脱氮效率不如未降温前的脱氮效率。安芳娇等[106]使用ASBR反应器,通过比较阶梯式降温和直接式降温(15 ~ 30 ℃)2种方法对于AnAOB脱氮效率的影响,结果表明阶梯式降温的脱氮效率高于直接式降温脱氮效率,且阶梯式降温过后的反应器可以通过快速回温的方式提升脱氮速率。周同等[107]采用ASBR反应器,研究在不同温度下海水中AnAOB的脱氮效率。研究表明,在25 ~ 30 ℃之间脱氮效率基本保持在82%,温度对ASBR反应器影响不大。在10 ~ 15 ℃之间脱氮效率明显下降,温度的降低对AnAOB的活性有抑制的作用。但是在20 ℃时,总氮的去除效率为79%,表明ASBR反应器在低温下仍有较强的脱氮效率潜能。
黄方玉等[26]采用气升式内循环反应器,在30、25、20和15 ℃ 4个温度条件下,进行脱氮效能的研究。结果表明当温度从30 ℃降低到15 ℃,总氮去除率降低至37%,AnAOB丰度降低10%。
WU et al[108]采用CAMBR反应器(combining with the Anaerobic Baffled reactor and Membrane bioreactor, CAMBR)在13 ℃条件下,通过接种絮凝硝化污泥、厌氧颗粒污泥和絮凝反硝化污泥,分别在75 、45和90 d后成功启动了厌氧氨氧化工艺且脱氮率超过90%。微生物群落分析表明Candidatus Brocadia和Candidatus Jettenia为优势菌属,与其他菌属比较,Candidatus Brocadia菌属生长速率最快,并且启动接种厌氧颗粒污泥的反应器速度最快。WU et al[109]采用UASB反应器,部分硝化-厌氧氨氧化反应器与ASBR反应器进行耦合组成的新反应器系统。在14 ~ 15 ℃条件下,研究了亚硝酸盐-厌氧氨氧化(NirAnammox)和硫酸盐-厌氧氨氧化(Sulfammox)协同去除垃圾渗滤液中的氮和硫酸盐。研究表明,协同作用的除氮效率可以达到98.48%,硫酸盐的去除率可以达到52.80%。其中Sulfammox的除氮效果要比NirAnammox的去除效果显著。Sulfammox的优势菌属是Candidatus Kuenenia比NirAnammox中的该菌属相对丰度多10 ~ 20倍。此外,有机物对NirAnammox产生负面影响,但对Sulfammox没有影响。溶解氧(dissolved oxygen, DO)对两者皆有负面影响。
综上可知,针对不同温度条件,不同基质下的情况,可使用一种厌氧氨氧化反应器也可以使用几种反应器的相互结合,使得其减少启动时间,并有效地保证厌氧氨氧化的除氮效率。
-
厌氧氨氧化作为一种高效的生物脱氮技术,具有不需要外加碳源、耗氧量低、无需pH调和和污泥产量低等优点,受到国内外水处理研究学者、污水处理厂技术工作人员的加倍关注。随着研究的深入,厌氧氨氧化技术日趋成熟,但是在低温条件下稳定运行厌氧氨氧化工艺仍是一个难题。
目前,在低温条件下厌氧氨氧化已经可以成功启动,并且启动时间相应地减少。但与最适温度相比,启动时间仍然较长。因此,在缩短厌氧氨氧化反应器启动时间的方面,可以选择适合的反应器及优化操作过程,从而达到短时间内启动的效果。此外,AnAOB在低温与适宜温度条件下相比较,其活性大幅度降低,细菌增殖速度变缓,从而导致细菌富集培养难度提高。因此提高AnAOB活性的方法显得尤为重要,但由于大部分提升细菌活性的方法是在实验室内完成,对于在实际应用操作中,还需要大量的研究与论证。
在实际工程应用中,通过优化厌氧氨氧化工艺组合,调整污水中DO含量和盐度等,使得在低温条件下厌氧氨氧化工艺正常运行。目前对于厌氧氨氧化工艺的瓶颈有以下3个方面需要解决:1)通过微生物角度,研究AnAOB的代谢条件及酶的分解产物,从而强化AnAOB的富集及快速增殖能力;2)通过添加适量有机物或无机物,提高在低温条件下的AnAOB的活性,使其稳定运行;3)通过优化厌氧氨氧化反应器、改变启动条件和强化反应措施,从而缩短在低温条件下反应器的启动时间。
低温条件下厌氧氨氧化技术的研究进展
A review of anaerobic ammonia oxidation technology at low temperature
-
摘要: 厌氧氨氧化(anaerobic ammonia oxidation, Anammox)技术作为可以实现高效脱氮的一种工艺,近些年广受大家关注。作为废水处理的升级技术,厌氧氨氧化细菌(anaerobic ammonia-oxidizing bacteria, AnAOB)是厌氧氨氧化技术的核心菌种,其生长的最适温度(30 ~ 35 ℃)远高于我国大部分污水处理厂的运行水温,无法满足大规模的投入使用。为了使厌氧氨氧化技术得到广泛应用,文章对低温条件下厌氧氨氧化工艺的进展,无机物及有机物等对厌氧氨氧化细菌的影响以及厌氧氨氧化反应器的应用进展进行系统的论述;重点提出了通过优化厌氧氨氧化反应器、改变启动条件、投加有机物或无机物,从而缩短在低温条件下反应器的启动时间以及强化AnAOB的富集。以期为低温下高氨氮废水的工程处理提供技术参考。Abstract: Anaerobic ammonia oxidation (Anammox), a high-efficiency technology for nitrogen removal, is favored in recent years. Anaerobic ammonia-oxidizing bacteria oxidizing bacteria (AnAOB) is the core bacteria in the anammox technology. Its optimal temperature (30 ~ 35 ℃) is much higher than the operating temperature of most wastewater treatment plants in China. It is impossible to achieve the large-scale use. In order that the anammox technology can be widely used, this paper systematically discussed the progress of anammox process at low temperature, the influence of inorganic and organic substances on anammox bacteria, and the application progress of anammox reactor. It was emphasized that by optimizing the anaerobic ammonia oxidation reactor, changing the start-up conditions and adding organic or inorganic substances, the start-up time of the reactor under low temperature conditions could be shortened and the enrichment of AnAOB could be strengthened. It is expected to provide a technical reference for the engineering treatment of high ammonia nitrogen wastewater at a low temperature.
-

-
表 1 部分AnAOB的最适温度及pH
种类 最适温
度/℃最适pH 参考
文献Candidatus Brocadiaan ammoxidans 20~43 6.7~8.3 [36] Candidatus Brocadia fulgida 30 7.8 Candidatus Brocadia sinica 25~45 6.5~8.8 Candidatus Jettenia caeni 20~42.5 6.5~8.5 [37] Candidatus Jettenia moscovienalis 20~45 8 Candidatus Kuenenia stuttgartiensis 25~37 6.5~9.0 [38] Candidatus Scalindua sp. 10~30 6.0~8.5 [39] Candidatus Anammoximicrobium moscowii 15~25 7.8~8.3 [40] 表 2 厌氧氨氧化活化能对比
温度范
围/℃活化能/ kJ·mol−1 污泥种类 参考文献 6~28 93~94 厌氧氨氧化颗粒污泥 [53] 28~37 33 厌氧氨氧化颗粒污泥 [53] 20~43 70 Candidatus Brocadia anammoxidans [12] 10~40 63 Candidatus Kuenenia stuttgartiensis [10] 6.5~37 61 海洋沉积物 [54] 10~25 76 海洋沉积物 [55] 5~17 66 Candidatus Brocadia fulgida [56] 10~20 152.9 Candidatus Kuenenia stuttgartiensis [50] 20~33 9.4 Candidatus Kuenenia stuttgartiensis [50] -
[1] 彭秋桐, 李中强, 邓绪伟, 等. 城市湖泊氮磷沉降输入量及影响因子——以武汉东湖为例[J]. 环境科学学报, 2019, 39(8): 2635 − 2643. doi: 10.13671/j.hjkxxb.2019.0191 [2] CHENG H H, NARINDIR B, CHU H, et al. Recent advancement on biological technologies and strategies for resource recovery from swine wastewater[J]. Bioresource Technology, 2020, 303: 122861. doi: 10.1016/j.biortech.2020.122861 [3] TAYLOR D I, OVIATT C A, GIBLIN A E, et al. Wastewater input reductions reverse historic hypereutrophication of Boston Harbor, USA[J]. Ambio, 2020, 49(1): 187 − 196. doi: 10.1007/s13280-019-01174-1 [4] BRODA E. Two kinds of lithotrophs missing in nature[J]. Zeitschrift fur Allgemeine Mikrobiologie, 1977, 17(6): 491 − 493. doi: 10.1002/jobm.19770170611 [5] MULDER A,VAN DE GRAAF A A , ROBERTSON L A, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor[J]. FEMS Microbiology Ecology, 1995, 16(3): 177 − 183. doi: 10.1111/j.1574-6941.1995.tb00281.x [6] WEN D, VALENCIA A, ORDONEZ D, et al. Comparative nitrogen removal via microbial ecology between soil and green sorption media in a rapid infiltration basin for co-disposal of stormwater and wastewater[J]. Environmental Research, 2020, 184: 109338. doi: 10.1016/j.envres.2020.109338 [7] DOSTA J, FERNANDEZ I, VAZQUEZ P J R, et al. Short-and long-term effects of temperature on the Anammox process[J]. Journal of Hazardous Materials, 2008, 154(1-3): 688 − 693. doi: 10.1016/j.jhazmat.2007.10.082 [8] 姚俊芹, 刘志辉, 周少奇. 温度变化对厌氧氨氧化反应的影响[J]. 环境工程学报, 2013, 7(10): 3993 − 3996. [9] 洪义国, 李猛, 顾继东. 海洋氮循环中细菌的厌氧氨氧化[J]. 微生物学报, 2009, 49(3): 281 − 286. doi: 10.3321/j.issn:0001-6209.2009.03.001 [10] STROUS M, KUENEN J G, JETTEN M S. Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology, 1999, 65(7): 3248 − 3250. doi: 10.1128/AEM.65.7.3248-3250.1999 [11] DAMSTE J S S, STROUS M, RIJPSTRA W I C, et al. Linearly concatenated cyclobutane lipids form a dense bacterial membrane[J]. Nature, 2002, 419(6908): 708 − 712. doi: 10.1038/nature01128 [12] GRAAF A A V D, BRUIJN P D, ROBERTSON L A, et al. Metabolic pathway of anaerobic ammonium oxidation on the basis of 15N studies in a fluidized bed reactor[J]. Microbiology, 1997, 143(7): 2415 − 2421. doi: 10.1099/00221287-143-7-2415 [13] BORAN K, WOUTER J M, NAOMI M A, et al. Molecular mechanism of anaerobic ammonium oxidation[J]. Nature, 2011, 479(7371): 127 − U159. doi: 10.1038/nature10453 [14] KARTAL B, RATTRAY J, NIFTRIK L, et al. Candidatus “Anammoxoglobus propionicus” a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria[J]. Systematic and Applied Microbiology, 2007, 30(1): 39 − 49. doi: 10.1016/j.syapm.2006.03.004 [15] BANDEIRA D A R G, DINIZ D S C E, LUDERS T C, et al. Nitrogen removal by simultaneous partial nitrification, anammox and denitrification (SNAD) in a structured-bed reactor treating animal feed processing wastewater: Inhibitory effects and bacterial community[J]. International Biodeterioration & Biodegradation, 2018, 133: 108 − 115. [16] STROUS M, FUERST J A, KRAMER E H, et al. Missing lithotroph identified as new planctomycete[J]. Nature, 1999, 400(6743): 446 − 449. doi: 10.1038/22749 [17] BORAN K, LAURA V N, Jayne R, et al. Candidatus ‘Brocadia fulgida’: an autofluorescent anaerobic ammonium oxidizing bacterium[J]. FEMS Microbiology Ecology, 2008, 63(1): 46 − 55. doi: 10.1111/j.1574-6941.2007.00408.x [18] OSHIKI M, SHIMOKAWA M, FUJII N, et al. Physiological characteristics of the anaerobic ammonium-oxidizing bacterium "Candidatus Brocadia sinica"[J]. Microbiology, 2011, 157(6): 1706 − 1713. doi: 10.1099/mic.0.048595-0 [19] HU B-L, RUSH D, VAN D B E, et al. New Anaerobic, Ammonium-Oxidizing Community Enriched from Peat Soil[J]. Applied and Environmental Microbiology, 2011, 77(3): 966 − 971. doi: 10.1128/AEM.02402-10 [20] STROUS M, PELLETIER E, MANGENOT S, et al. Deciphering the evolution and metabolism of an anammox bacterium from a community genome[J], Nature, 2006, 440(7085): 790-794. [21] SCHMID M, WALSH K, WEBB R, et al. Candidatus "Scalindua brodae", sp. nov., Candidatus "Scalindua wagneri", sp. nov., two new species of anaerobic ammonium oxidizing bacteria[J]. Systematic and applied microbiology, 2003, 26(4): 529 − 538. doi: 10.1078/072320203770865837 [22] WOEBKEN D, LAM P, MARCEL M M K, et al. A microdiversity study of anammox bacteria reveals a novel Candidatus Scalindua phylotype in marine oxygen minimum zones[J]. Environmental Microbiology, 2008, 10(11): 3106 − 3119. doi: 10.1111/j.1462-2920.2008.01640.x [23] STROUS M, HEIJNEN J J, KUENEN J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 1998, 50(5): 589 − 596. doi: 10.1007/s002530051340 [24] CAO Y, LOOSDRECHT M, DAIGGER G. Mainstream partial nitritation-anammox in municipal wastewater treatment: status, bottlenecks, and further studies[J]. Applied Microbiology & Biotechnology, 2017, 101(4): 1365 − 1383. [25] XU X X, MA B, LU W K, et al. Effective nitrogen removal in a granule-based partial-denitrification/anammox reactor treating low C/N sewage[J]. Bioresource Technology, 2020, 297: 122467. doi: 10.1016/j.biortech.2019.122467 [26] 黄方玉, 邓良伟, 杨红男, 等. 温度对自养型同步脱氮工艺处理猪场废水厌氧消化液性能及微生物群落的影响[J]. 环境科学, 2019, 40(5): 2357 − 2367. [27] LI R W, LI L, ZHANG Z M, et al. Speciation and conversion of carbon and nitrogen in young landfill leachate during anaerobic biological pretreatment[J]. Waste Management, 2020, 106: 88 − 98. doi: 10.1016/j.wasman.2020.03.011 [28] VAN D U, JETTEN M S M, VAN L M C M. The SHARON((R))-Anammox((R)) process for treatment of ammonium rich wastewater[J]. Water Science & Technology, 2001, 44(1): 153 − 160. [29] GUO Q, XING B S, LI P, et al. Anaerobic ammonium oxidation (anammox) under realistic seasonal temperature variations: Characteristics of biogranules and process performance[J]. Bioresour Technology, 2015, 192: 765 − 773. doi: 10.1016/j.biortech.2015.06.049 [30] DU R, CAO S B, WANG S Y, et al. Performance of partial denitrification (PD)-ANAMMOX process in simultaneously treating nitrate and low C/N domestic wastewater at low temperature[J]. Bioresour Technology, 2016, 219: 420 − 429. doi: 10.1016/j.biortech.2016.07.101 [31] HU Z, LOTTI T, DE K M, et al. Nitrogen removal by a nitritation-anammox bioreactor at low temperature[J]. Applied and Environmental Microbiology, 2013, 79(8): 2807 − 2812. doi: 10.1128/AEM.03987-12 [32] KAWAGOSHI Y, FUJISAKI K, TOMOSHIGE Y, et al. Temperature effect on nitrogen removal performance and bacterial community in culture of marine anammox bacteria derived from sea-based waste disposal site[J]. Journal of Bioscience & Bioengineering, 2012, 113(4): 515 − 520. [33] NAKAJIMA J, SAKKA M, KIMURA T, et al. Enrichment of anammox bacteria from marine environment for the construction of a bioremediation reactor[J]. Applied Microbiology and Biotechnology, 2008, 77(5): 1159 − 1166. doi: 10.1007/s00253-007-1247-7 [34] RYSGAARD S, GLUD R N, RISGAARD-PETERSEN N, et al. Denitrification and anammox activity in Arctic marine sediments[J]. Limnology and Oceanography, 2004, 49(5): 1493 − 1502. doi: 10.4319/lo.2004.49.5.1493 [35] GILBERT E M, AGRAWAL S, KARST S R M, et al. Low temperature partial nitritation/anammox in a moving bed biofilm reactor treating low strength wastewater[J]. Environmental Science & Technology, 2014, 48(15): 8784 − 8792. [36] TSUSHIMA I, OGASAWARA Y, KINDAICHI T, et al. Development of high-rate anaerobic ammonium-oxidizing (anammox) biofilm reactors[J]. Water Research, 2007, 41(8): 1623 − 1634. doi: 10.1016/j.watres.2007.01.050 [37] ALI M, OSHIKI M, AWATA T, et al. Physiological characterization of anaerobic ammonium oxidizing bacterium "CandidatusJettenia caeni'[J]. Environmental Microbiology, 2015, 17(6): 2172 − 2189. doi: 10.1111/1462-2920.12674 [38] SCHMID M, SCHMITZ E S, JETTEN M, et al. 16S-23S rDNA intergenic spacer and 23S rDNA of anaerobic ammonium-oxidizing bacteria: implications for phylogeny and in situ detection[J]. Environmental Microbiology, 2001, 3(7): 450 − 459. doi: 10.1046/j.1462-2920.2001.00211.x [39] VAN N L, GEERTS W J C, VAN D E G, et al. Linking ultrastructure and function in four genera of anaerobic ammonium-oxidizing bacteria: Cell plan, glycogen storage, and localization of cytochrome c proteins[J]. Journal of Bacteriology, 2008, 190(2): 708 − 717. doi: 10.1128/JB.01449-07 [40] KHRAMENKOV S V, KOZLOV M N, KEVBRINA M V, et al. A novel bacterium carrying out anaerobic ammonium oxidation in a reactor for biological treatment of the filtrate of wastewater fermented sludge[J]. Microbiology, 2013, 82(5): 628 − 636. doi: 10.1134/S002626171305007X [41] 郑宇慧. 温度对厌氧氨氧化的影响研究[D]. 苏州: 苏州科技学院, 2011. [42] 鲍林林, 赵建国, 李晓凯, 等. 常温低基质厌氧氨氧化反应器启动及其稳定性[J]. 环境工程学报, 2013, 7(3): 981 − 986. [43] BAO L, ZHAO J, LI X, et al. Start-up and stability of Anammox bioreactor at normal temperature and low substrate concentration[J]. Chinese Journal of Environmental Engineering, 2013, 7(03): 981 − 986. [44] LOTTI T, KLEEREBEZEM R, VAN L M C M. Effect of temperature change on anammox activity[J]. Biotechnology and Bioengineering, 2015, 112(1): 98 − 103. doi: 10.1002/bit.25333 [45] 郑贝贝. 耐冷菌Bacillus cereus MYB41-22群体感应系统与其温度适应性相关功能研究[D]. 昆明: 昆明理工大学, 2018. [46] 彭永臻, 张向晖, 马斌, 等. 厌氧氨氧化菌群体感应机制[J]. 北京工业大学学报, 2018, 44(3): 449 − 454. [47] 霍唐燃, 潘珏君, 刘思彤. 基于代谢组的厌氧氨氧化菌群对温度的响应机制[J]. 微生物学通报, 2019, 46(8): 1936 − 1945. [48] HU H, WAN H, DONG L, et al. Surface hydroxyls regulation promotes light-induced cell detachment on TiO2 nanodot films[J]. Surface & Coatings Technology, 2019, 358: 461 − 466. [49] WANG W, YAN Y, ZHAO Y, et al. Characterization of stratified EPS and their role in the initial adhesion of anammox consortia[J]. Water Research, 2020, 169(Feb.1): 115223.1 − 115223.11. [50] WILEN B M, LUMLEY D, MATTSSON A, et al. Relationship between floc composition and flocculation and settling properties studied at a full scale activated sludge plant[J]. Water Research, 2008, 42(16): 4404 − 4418. doi: 10.1016/j.watres.2008.07.033 [51] 宋成康, 王亚宜, 韩海成, 等. 温度降低对厌氧氨氧化脱氮效能及污泥胞外聚合物的影响[J]. 中国环境科学, 2016, 36(7): 2006 − 2013. doi: 10.3969/j.issn.1000-6923.2016.07.015 [52] 胡宝兰, 郑平, 冯孝善. 新型生物脱氮技术的工艺研究[J]. 应用与环境生物学报, 1999(S1): 68 − 73. doi: 10.3321/j.issn:1006-687X.1999.Z1.018 [53] 王淑莹, 孙洪伟, 杨庆, 等. 传统生物脱氮反硝化过程的生化机理及动力学[J]. 应用与环境生物学报, 2008(5): 732 − 736. doi: 10.3321/j.issn:1006-687X.2008.05.029 [54] 祝贵兵, 彭永臻, 郭建华. 短程硝化反硝化生物脱氮技术[J]. 哈尔滨工业大学学报, 2008, 1(10): 1552 − 1557. doi: 10.3321/j.issn:0367-6234.2008.10.009 [55] MILIA S, TOCCO G, ERBY G, et al. Preliminary evaluation of sharon-anammox process feasibility to treat ammonium-rich effluents produced by double-stage anaerobic digestion of food waste[C]// Frontiers international conference on wastewater treatment and modelling. Springer, Cham, 2017: 536-543. [56] 彭正阳. 单级全程自养脱氮推流式反应器处理生活污水的研究[D]. 哈尔滨: 哈尔滨工业大学, 2018. [57] HUYNH T V, NGUYEN P D, PHAN T N, et al. Application of CANON process for nitrogen removal from anaerobically pretreated husbandry wastewater[J]. International Biodeterioration & Biodegradation, 2019, 136: 15 − 23. [58] 李冬, 崔雅倩, 赵世勋, 等. 低温SNAD颗粒污泥工艺启动方式[J]. 环境科学, 2019, 40(1): 376 − 382. [59] REINO C, CARRERA J. Low-strength wastewater treatment in an anammox UASB reactor: Effect of the liquid upflow velocity[J]. Chemical Engineering Journal, 2017, 313: 217 − 225. doi: 10.1016/j.cej.2016.12.051 [60] LIU W, JI X, WANG J, et al. Microbial community response to influent shift and lowering temperature in a two-stage mainstream deammonification process[J]. Bioresource Technology, 2018, 262: 132 − 140. doi: 10.1016/j.biortech.2018.04.082 [61] QIAN H, WANG Y-C, SUN F, et al. Effects of seasonal temperature variation on nitrogen removal from a tidal flow constructed wetland system with CANON process[J]. The Journal of Applied Ecology, 2020, 31(5): 1715 − 1724. [62] WETT B. Development and implementation of a robust deammonification process[J]. Water Science and Technology:a Journal of the International Association on Water Pollution Research, 2007, 56(7): 81 − 88. doi: 10.2166/wst.2007.611 [63] DAIGGER, T. G. Oxygen and carbon requirements for biological nitrogen removal processes accomplishing nitrification, nitritation, and anammox[J]. Water Environment Research, 2014, 86(3): 204 − 209. doi: 10.2175/106143013X13807328849459 [64] JETTEN M S M, HORN S J, LOOSDRECHT M C M V. Towards a more sustainable wastewater treatment system[J]. Water Science & Technology, 1997, 35(9): 171 − 180. [65] SOLIMAN M, ELDYASTI A. Ammonia-Oxidizing Bacteria (AOB): opportunities and applications-a review[J]. Reviews in Environmental Science and Bio-Technology, 2018, 17(2): 285 − 321. doi: 10.1007/s11157-018-9463-4 [66] PENG Y, ZHU G. Biological nitrogen removal with nitrification and denitrification via nitrite pathway[J]. Applied Microbiology & Biotechnology, 2006, 73(1): 15 − 26. [67] AGRAWAL S, KARST S M, GILBERT E M, et al. The role of inoculum and reactor configuration for microbial community composition and dynamics in mainstream partial nitritation anammox reactors[J]. Microbiologyopen, 2017, 6(4): 1 − 15. [68] AKABOCI T R V, GICH F, RUSCALLEDA M, et al. Assessment of operational conditions towards mainstream partial nitritation-anammox stability at moderate to low temperature: Reactor performance and bacterial community[J]. Chemical Engineering Journal, 2018, 350: 192 − 200. doi: 10.1016/j.cej.2018.05.115 [69] LV Y, PAN J, HUO T, et al. Enhance the treatment of low strength wastewater at low temperature with the coexistence system of AnAOB and heterotrophic bacteria: Performance and bacterial community[J]. Science of the Total Environment, 2020, 714: 136799. doi: 10.1016/j.scitotenv.2020.136799 [70] LAURENI M, FALAS P, ROBIN O, et al. Mainstream partial nitritation and anammox: long-term process stability and effluent quality at low temperatures[J]. Water Research, 2016, 101: 628 − 639. doi: 10.1016/j.watres.2016.05.005 [71] LIANG Z, LIU J-X, LI J. Decomposition and mineralization of aquatic humic substances (AHS) in treating landfill leachate using the Anammox process[J]. Chemosphere, 2009, 74(10): 1315 − 1320. doi: 10.1016/j.chemosphere.2008.11.073 [72] 解云飞, 徐文杰, 迟媛媛, 等. 厌氧氨氧化技术在市政污水中的应用和研究进展[J]. 工业水处理, 2019, 39(12): 1 − 6. doi: 10.11894/iwt.2018-1153 [73] GILBERT E M, AGRAWAL S, SCHWARTZ T, et al. Comparing different reactor configurations for Partial Nitritation/Anammox at low temperatures[J]. Water Research, 2015, 81: 92 − 100. doi: 10.1016/j.watres.2015.05.022 [74] 完颜德卿, 袁怡, 李祥, 等. 一种CANON工艺处理低氨氮废水的新模式[J]. 环境科学, 2017, 38(3): 1122 − 1129. [75] WANG D, WANG G, ZHANG G, et al. Using graphene oxide to enhance the activity of anammox bacteria for nitrogen removal[J]. Bioresour Technology, 2013, 131: 527 − 530. doi: 10.1016/j.biortech.2013.01.099 [76] YIN X, QIAO S, ZHOU J, et al. Fast start-up of the anammox process with addition of reduced graphene oxides[J]. Chemical Engineering Journal, 2016, 283: 160 − 166. doi: 10.1016/j.cej.2015.07.059 [77] TOMASZEWSKI M, CEMA G, ZIEMBINSKA B A. Short-term effects of reduced graphene oxide on the anammox biomass activity at low temperatures[J]. Science of the Total Environment, 2019, 646: 206 − 211. doi: 10.1016/j.scitotenv.2018.07.283 [78] Yin X, Qiao S, Yu C, et al. Effects of reduced graphene oxide on the activities of anammox biomass and key enzymes[J]. Chemical Engineering Journal, 2015, 276: 106 − 112. doi: 10.1016/j.cej.2015.04.073 [79] ZHANG X, CHEN Z, ZHOU Y, et al. Impacts of the heavy metals Cu (II), Zn (II) and Fe (II) on an Anammox system treating synthetic wastewater in low ammonia nitrogen and low temperature: Fe (II) makes a difference[J]. Science of the Total Environment, 2019, 648: 798 − 804. doi: 10.1016/j.scitotenv.2018.08.206 [80] ZHANG X, ZHOU Y, XU T, et al. Toxic effects of CuO, ZnO and TiO2 nanoparticles in environmental concentration on the nitrogen removal, microbial activity and community of Anammox process[J]. Chemical Engineering Journal, 2018, 332: 42 − 48. doi: 10.1016/j.cej.2017.09.072 [81] 唐政坤, 张硕, 李光蕾, 等. 低温胁迫下Ca2+对厌氧氨氧化污泥脱氮效能影响研究[J]. 环境污染与防治, 2019, 41(3): 279 − 282. [82] WANG G, DAI X, ZHANG D. Effects of NaCl and phenol on anammox performance in mainstream reactors with low nitrogen concentration and low temperature[J]. Biochemical Engineering Journal, 2019, 147: 72 − 80. doi: 10.1016/j.bej.2019.03.026 [83] OSAKA T, KIMURA Y, OTSUBO Y, et al. Temperature dependence for anammox bacteria enriched from freshwater sediments[J]. Journal of Bioscience and Bioengineering, 2012, 114(4): 429 − 434. doi: 10.1016/j.jbiosc.2012.05.003 [84] KHANH D, QUAN L, ZHANG W, et al. Effect of temperature on low-strength wastewater treatment by UASB reactor using poly(vinyl alcohol)-gel carrier[J]. Bioresource Technology, 2011, 102(24): 11147 − 11154. doi: 10.1016/j.biortech.2011.09.108 [85] 张硕, 李军, 向韬, 等. 低温胁迫下海藻糖强化厌氧氨氧化污泥活性研究[J]. 水处理技术, 2018, 44(11): 116 − 119. doi: 10.16796/j.cnki.1000-3770.2018.11.025 [86] ZHU W, LI J, DONG H, et al. Nitrogen removal performance and operation strategy of anammox process under temperature shock[J]. Biodegradation, 2017, 28(4): 261 − 274. doi: 10.1007/s10532-017-9794-9 [87] LOTTI T, KLEEREBEZEM R, HU Z, et al. Simultaneous partial nitritation and anammox at low temperature with granular sludge[J]. Water Research, 2014, 66: 111 − 121. doi: 10.1016/j.watres.2014.07.047 [88] YU J J, CHEN H, ZHANG J, et al. Enhancement of ANAMMOX activity by low-intensity ultrasound irradiation at ambient temperature[J]. Bioresource Technology, 2013, 142: 693 − 696. doi: 10.1016/j.biortech.2013.05.013 [89] ZHANG C, LI L, HU X, et al. Effects of a pulsed electric field on nitrogen removal through the ANAMMOX process at room temperature[J]. Bioresource Technology, 2019, 275: 225 − 231. doi: 10.1016/j.biortech.2018.12.037 [90] ZHANG C, LI L, WANG Y, et al. Enhancement of the ANAMMOX bacteria activity and granule stability through pulsed electric field at a lower temperature (16±1 ℃)[J]. Bioresource Technology, 2019: 121960. [91] LU X, YIN Z, SOBOTKA D, et al. Modeling the pH effects on nitrogen removal in the anammox-enriched granular sludge[J]. Water Science & Technology, 2016, 75(2): 378 − 386. [92] TOMASZEWSKI M, CEMA G, ZIEMBINSKA B A. Significance of pH control in anammox process performance at low temperature[J]. Chemosphere, 2017, 185: 439 − 444. doi: 10.1016/j.chemosphere.2017.07.034 [93] 张永辉, 彭永臻, 曾立云, 等. 常温低基质厌氧氨氧化ASBR反应器的快速启动[J]. 工业水处理, 2017, 37(2): 43 − 47. doi: 10.11894/1005-829x.2017.37(2).043 [94] 张彦江, 姚俊芹. 常温下UASB反应器厌氧氨氧化生物脱氮试验[J]. 安徽农业科学, 2018, 46(12): 81 − 83. doi: 10.3969/j.issn.0517-6611.2018.12.024 [95] 李祥, 黄勇, 郑宇慧, 等. 温度对厌氧氨氧化反应器脱氮效能稳定性的影响[J]. 环境科学, 2012, 33(4): 1288 − 1292. doi: 10.13227/j.hjkx.2012.04.047 [96] TANG C J, ZHENG P, WANG C H, et al. Performance of high-loaded ANAMMOX UASB reactors containing granular sludge[J]. Water Research, 2011, 45(1): 135 − 144. doi: 10.1016/j.watres.2010.08.018 [97] ISAKA K, SUMINO T, TSUNEDA S. High nitrogen removal performance at moderately low temperature utilizing anaerobic ammonium oxidation reactions[J]. Journal of Bioscience and Bioengineering, 2007, 103(5): 486 − 490. doi: 10.1263/jbb.103.486 [98] LIU T, LIM Z K, CHEN H, et al. Temperature-tolerated mainstream nitrogen removal by anammox and nitrite/nitrate-dependent anaerobic methane oxidation in a membrane biofilm reactor[J]. Environmental Science & Technology, 2020, 54(5): 3012 − 3021. [99] WANG X, QI G, YAN Y, et al. Influence of temperature fluctuations on one-stage deammonification systems in northern cold region[J]. Environmental Science and Pollution Research, 2018, 25(19): 18632 − 18641. doi: 10.1007/s11356-018-2050-y [100] REINO C, EUGENIA S O M, PEREZ J, et al. Stable long-term operation of an upflow anammox sludge bed reactor at mainstream conditions[J]. Water Research, 2018, 128: 331 − 340. doi: 10.1016/j.watres.2017.10.058 [101] DE C H, VLAEMINCK S E, DE W F, et al. One-stage partial nitritation/anammox at 15 ℃ on pretreated sewage: feasibility demonstration at lab-scale[J]. Applied Microbiology and Biotechnology, 2013, 97(23): 10199 − 10210. doi: 10.1007/s00253-013-4744-x [102] LIU W, YANG D, CHEN W, et al. High-throughput sequencing-based microbial characterization of size fractionated biomass in an anoxic anammox reactor for low-strength wastewater at low temperatures[J]. Bioresource Technology, 2017, 231: 45 − 52. doi: 10.1016/j.biortech.2017.01.050 [103] DE C P, BESSIERE Y, HERNANDEZ R G, et al. Enrichment and adaptation yield high anammox conversion rates under low temperatures[J]. Bioresource Technology, 2018, 250: 505 − 512. doi: 10.1016/j.biortech.2017.11.079 [104] 李海玲, 李冬, 张杰, 等. 调控温度和沉降时间实现ANAMMOX颗粒快速启动及其稳定运行[J]. 环境科学, 2019, 40(2): 837 − 844. [105] 张永辉. 厌氧氨氧化工艺的启动及影响因素试验研究[D]. 兰州: 兰州交通大学, 2017. [106] 安芳娇, 彭永臻, 董志龙, 等. 不同运行策略下厌氧氨氧化的脱氮性能[J]. 环境科学, 2018, 39(6): 2770 − 2777. [107] 周同, 于德爽, 李津, 等. 温度对海洋厌氧氨氧化菌脱氮效能的影响[J]. 环境科学, 2017, 38(5): 2044 − 2051. [108] WU P, CHEN Y, JI X, et al. Fast start-up of the cold-anammox process with different inoculums at low temperature (13 ℃) in innovative reactor[J]. Bioresource Technology, 2018, 267: 696 − 703. doi: 10.1016/j.biortech.2018.07.026 [109] WU L, YAN Z, LI J, et al. Low temperature advanced nitrogen and sulfate removal from landfill leachate by nitrite-anammox and sulfate-anammox[J]. Environmental Pollution, 2020, 259: 113763 − 113763. doi: 10.1016/j.envpol.2019.113763 -



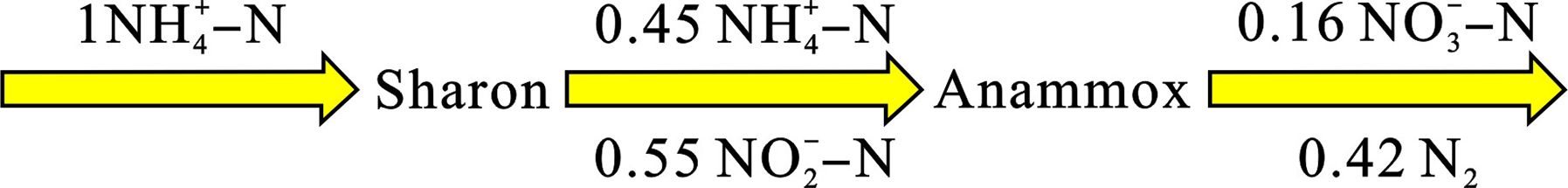
 下载:
下载: