-
双酚A(bisphenol A,BPA)被广泛用作制造环氧树脂和聚碳酸酯塑料的添加剂,这些塑料制品常被用于奶瓶、食品罐内衬、饮料容器、医疗设备金属涂层等产品中,双酚A极易通过这些产品的使用迁移到食品、饮用水和环境中[1-3]。研究表明,双酚A具有内分泌干扰特性,对人体生长、生殖、发育产生不利影响,诱发内分泌系统疾病,增加癌症发病率[4-5]。由于双酚A对人类健康和环境的严重危害,建立一种特异、灵敏的双酚A检测方法具有重要意义。目前,双酚A的常规检测方法主要有高效液相色谱、气相色谱-质谱联用、液相色谱-质谱联用等,这些方法准确、可靠,但也存在前处理复杂、分析时间长、仪器较昂贵等缺点[6-8]。近年来,基于光学、电化学、表面增强拉曼、免疫原理的传感检测方法发展迅速,广泛用于各种环境污染物的快速检测[9-11],其中电化学方法因其灵敏度高、响应快速、仪器简单、可实现现场分析等优点,特别受到关注[12-14]。
为了提高传感器检测的选择性,生物分子包括抗体、适配体、多肽等常被用作识别元素对目标物进行特异性识别。虽然抗体作为识别探针具有很高的特异性,但价格昂贵、易受环境干扰,并且针对小分子识别的抗体制备困难[15-18]。适配体是一种短的单链DNA或RNA寡核苷酸,对环境较稳定,可选择性地识别各种目标物,因此常被作为抗体的良好替代品[19-20]。此外,为了提高传感器检测灵敏度,需要对工作电极进行表面修饰,其中,金属纳米粒子、量子点、碳纳米管、石墨烯等纳米材料由于具有较大的比表面积和良好的导电性,常被用于电极表面修饰,提高目标物检测灵敏度[15,21-22]。本研究利用恒电位法在玻碳电极表面制备均一的纳米金颗粒,再引入双酚A适配体,制备了纳米金-适配体电化学传感器,成功用于环境水样中痕量双酚A的选择性检测。
-
电化学分析仪(CHI650D)、玻碳电极(CHI104)、银/氯化银参比电极(CHI111)、铂丝对电极(CHI115)(上海辰华仪器有限公司);扫描电子显微镜(S4800,日本日立公司);高效液相色谱仪(Agilent 1100,安捷伦科技有限公司)。
5′端修饰巯基的双酚A适配体(序列为:5′-SH-C6-CCG GTG GGT GGT CAG GTG GGA TAG CGT TCC GCG TAT GGC CCA GCG CAT CAC GGG TTC GCA CCA-3′,宝生物工程(大连)有限公司);双酚A(>99%)、四氯金酸三水化合物(≥99.9%)、6-巯基-1-己醇(98%)(上海阿拉丁生化科技股份有限公司);铁氰化钾(分析纯)、氯化钾(分析纯)、磷酸二氢钠(分析纯)、亚铁氰化钾(分析纯)、无水硫酸钠(分析纯)、磷酸氢二钠(分析纯)和硫酸(优级纯)(天津市大茂化学试剂厂);1.0、0.3、0.05 μm Al2O3抛光粉(上海辰华仪器有限公司)。
-
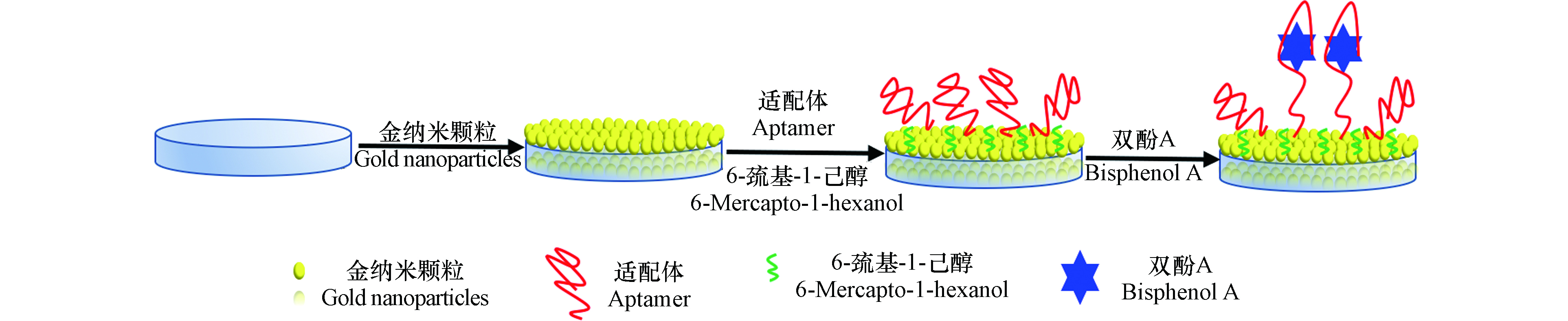
电极制备原理如图1所示。
玻碳电极依次用1.0、0.3、0.05 μm的Al2O3 粉抛光,超纯水冲洗后置于0.5 mol·L−1 H2SO4 中循环伏安扫描(−0.2—1.6 V,100 mV·s−1)20圈,直到电化学信号稳定,超纯水冲洗后氮气吹干待用;将处理好的玻碳电极浸入含1 mmol·L−1 HAuCl4的0.2 mol·L−1 Na2SO4溶液中,在−0.2 V电压下电沉积400 s,得到金纳米粒子修饰的玻碳电极,将10 μL浓度1 μmol·L−1的双酚A适配体溶液移至金纳米粒子表面,于冰箱中4 ℃ 放置12 h,超纯水冲洗后浸入1 mmol·L−1 6-巯基-1-己醇(MCH)溶液室温下掩蔽1 h,封闭未被适配体固定的表面,最后用超纯水充分清洗电极表面,氮气吹干,于4 ℃保存,待用。
-
将上述制备好的电极置于一定浓度双酚A的磷酸盐缓冲液(pH=7.0)中,磁力搅拌下富集50 min,之后用超纯水冲洗电极表面,氮气吹干,置于5 mmol·L−1 [Fe(CN)6]3-/4-的KCl(0.1 mol·L−1)溶液中进行电化学测定。
电化学检测采用标准的三电极系统:修饰电极为工作电极,铂丝电极为对电极,饱和银/氯化银电极为参比电极。循环伏安(CV)参数:扫描范围−0.1—0.5 V,扫描速率100 mV·s−1;微分脉冲伏安(DPV)参数:电位扫描范围0.04—0.4 V,振幅0.025 V,脉冲宽度0.05 s,采样间隔0.02 s,脉冲时间0.2 s,静置时间0 s;交流阻抗(EIS)参数:振幅5 mV,频率0.1 Hz—100 kHz,偏振电压0.19 V。所有电化学测量均在室温下进行。
-
取自来水(实验室)、河水(大连马栏河)、二沉池出水(污水处理厂)各100 mL分别通过0.45 μm的玻璃纤维滤膜,以除去较大的颗粒物,并将获得的水样进行固相萃取,用高效液相色谱法对水样中双酚A的本底值进行检测。通过向实际水样中加入双酚A标准溶液,使其最终浓度分别为5 nmol·L−1和50 nmol·L−1进行电化学检测。
-
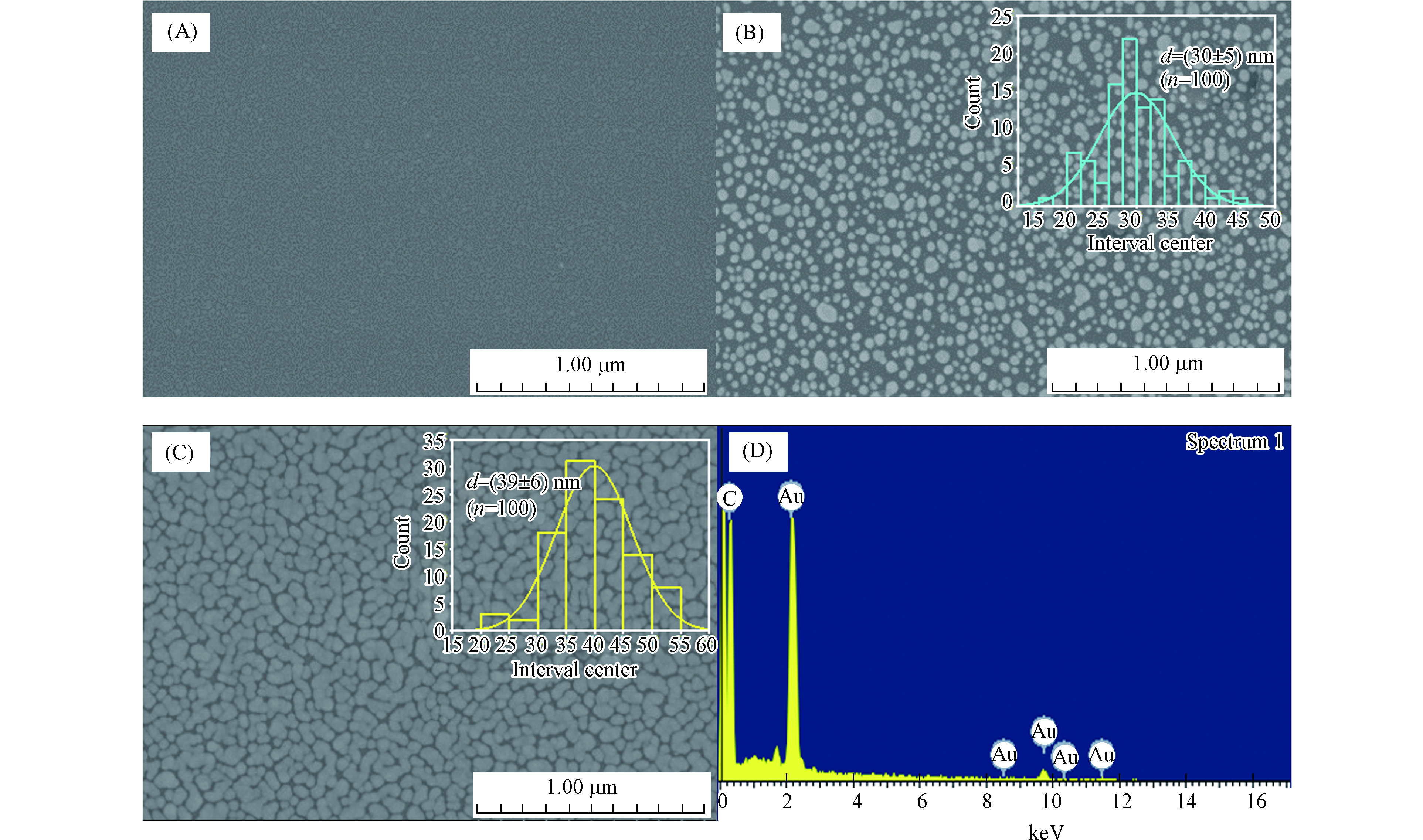
抛光处理后的玻碳电极在HAuCl4溶液中恒电位沉积,在玻碳电极表面负载金纳米颗粒,进一步增加电极的表面积和导电性能。使用扫描电子显微镜(SEM)研究了修饰电极的形貌特征,图2A和2C分别为裸玻碳电极和电沉积金纳米粒子后的扫描电镜图。
由图2C可知,在电极表面产生了均匀致密的金纳米颗粒,粒径范围为(39±6) nm,有助于增加捕获双酚A适配体的电极表面积。此外,通过能量色散X射线(EDX)光谱分析对GCE-AuNPs表面的元素进行了表征,由EDX谱图(图2D)可明显看出Au特征峰的存在。接下来,通过Au—S键将双酚A适配体固定在电极表面,为了防止在电极表面发生非特异性吸附,对电极进行了掩蔽处理。
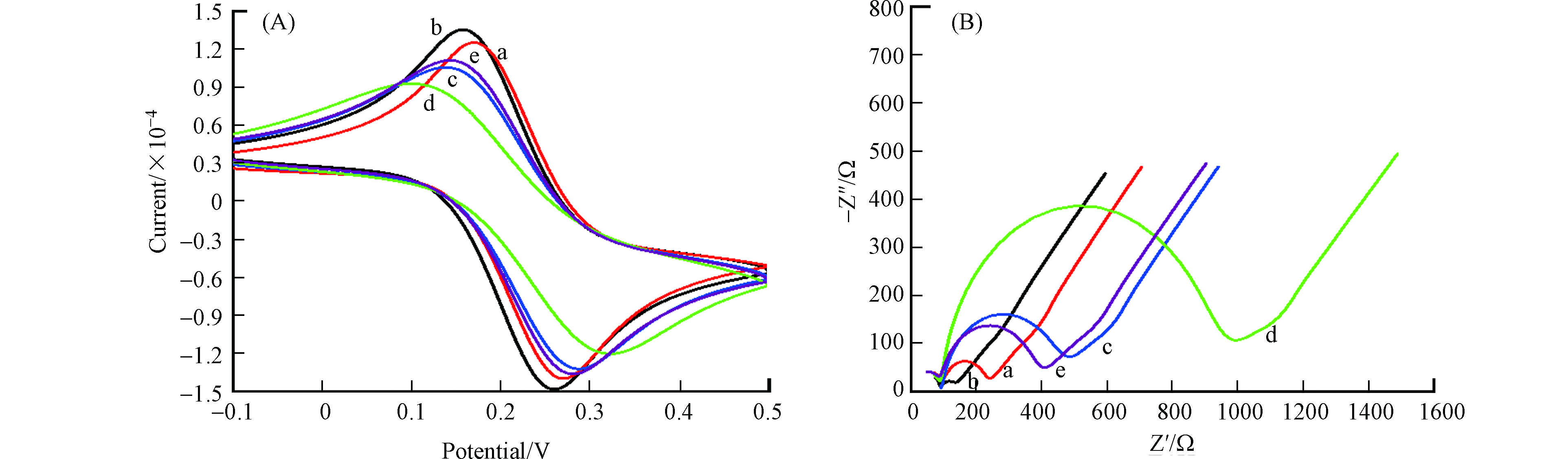
采用CV和EIS对不同修饰阶段的电极进行了表征。图3A是不同修饰电极的CV曲线,裸电极(曲线a)CV曲线中出现两个可逆的氧化还原峰(0.26 V和0.15 V处),分别对应于Fe2+/Fe3+的氧化和还原过程,与裸电极相比,经金纳米粒子修饰后的电极(曲线b)峰电流有明显的增加,这是因为金纳米粒子具有良好的导电性能、比表面积大等优点,增加了电极的有效面积,促进了[Fe(CN)6]3-/4- 氧化还原探针在电极与溶液界面之间的反应。当双酚A适配体固定在GCE-AuNPs时(曲线c),电极表面带负电荷的适配体阻碍了带负电荷的[Fe(CN)6]3-/4-在电极与溶液界面之间的电子转移,同时也增加了[Fe(CN)6]3-/4-转移到电极表面的空间位阻,使得峰值电流显著降低。在GCE-AuNPs-Aptamer被掩蔽之后(曲线d),由于电极表面未与适配体结合的空间位点通过Au—S键与6-巯基-1-己醇结合,进一步增加空间位阻,阻碍[Fe(CN)6]3-/4- 氧化还原探针的转移,使得峰值电流进一步降低。当结合了双酚A分子之后,电流信号增加(曲线e),这是因为双酚A与适配体的结合改变了适配体在电极表面的空间位置,由之前的平躺或倾斜状态逐渐直立起来,这种直立取向可以降低[Fe(CN)6]3-/4-到达电极表面的电子转移电阻,即电流值的增加[23]。
EIS是研究电极界面行为的有效工具[23-24]。图3B为不同修饰电极的阻抗谱图,由图可知,与裸电极(曲线a)相比,经金纳米粒子修饰后的电极(曲线b),其阻抗值由于金纳米粒子良好的导电性和较大的比表面积而明显降低。当双酚A适配体修饰在电极表面之后(曲线c),半圆直径增大,电荷转移电阻Rct 增加,表明电极表面固定的双酚A适配体所带的负电荷对[Fe(CN)6]3-/4-探针起到排斥作用,阻挡了部分探针在电极表面的转移。经6-巯基-1-己醇掩蔽之后的电极(曲线d)阻抗值最大,这是因为6-巯基-1-己醇在电极表面与金进一步结合,将裸露的空间位点占据而引起的电子交换降低,阻抗值增加。在与双酚A分子作用之后(曲线e),其阻抗值减小,这是因为适配体与双酚A分子的结合改变了适配体的空间位置,促进了氧化还原探针在电极表面的转移。
-
实验通过DPV比较了电化学沉积0、200、400、500、600 s时修饰电极峰电流值的变化。图4显示,随着沉积时间的增加,修饰电极的峰电流信号逐渐增大,在400 s时达到最大,之后随着沉积时间的增加电流信号值保持稳定。由SEM图可知,与电沉积0 s(图2A)相比,电沉积200 s(图2B)和400 s(图2C)时可明显看出电极表面金纳米粒子的存在,且2种沉积时间得到的金纳米颗粒的粒径尺寸相近,但电沉积400 s时金纳米粒子在电极表面的分布比200 s时更为致密,也表明在电沉积400 s时,玻碳电极表面已全部负载上金纳米粒子,电极表面积及导电性能达到最佳,这进一步解释了电流信号的变化趋势。因此,本实验采用400 s作为金纳米颗粒的恒电位沉积时间。
-
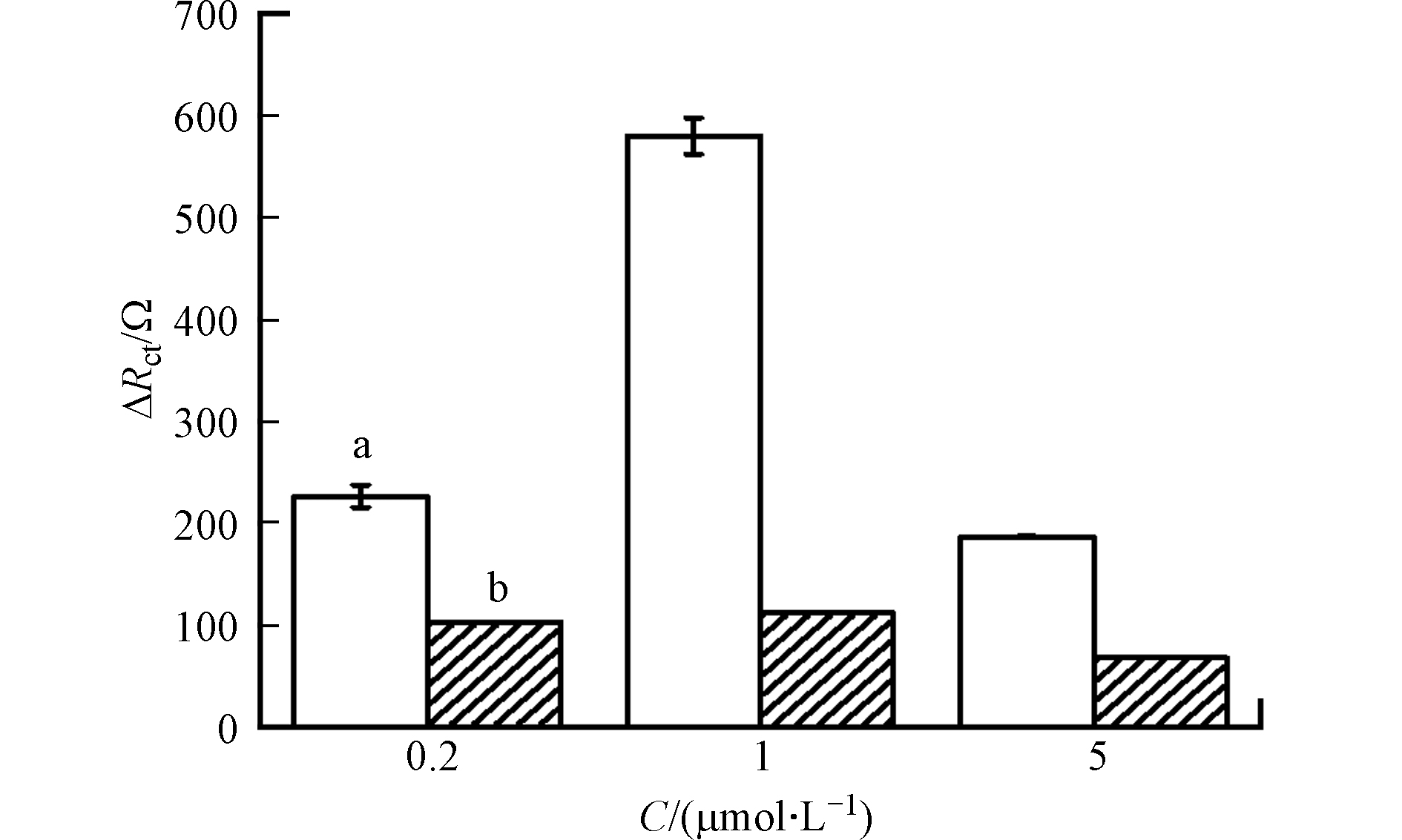
为提高适配体传感器的检测性能,考察了0.2、1、5 μmol·L−1适配体修饰的GCE-AuNPs电极对5 μmol·L−1双酚A的阻抗响应。由图5可知,随着浓度的增加,阻抗响应呈现先增加后减少的趋势,说明适当增加适配体的浓度可以增加电极表面固定的适配体数量,提高传感器检测双酚A的灵敏度。当适配体浓度继续增加至5 μmol·L−1时,检测灵敏度反而下降,这可能是由于电极表面适配体密度过高,使得[Fe(CN)6]3-/4-探针难以到达电极表面发生反应,导致电极灵敏度下降。因此,将1 μmol·L−1作为最佳适配体浓度。
在适配体修饰电极中,常使用掩蔽剂抑制电极的非特异性吸附。本实验采用6-巯基-1-己醇作为掩蔽剂,比较了在有无掩蔽剂存在的情况下,传感器对双酚A的阻抗响应。由图5可知,纳米金电极掩蔽(图5a)时的阻抗响应要明显大于未掩蔽时(图5b),并且对于3个不同的适配体浓度表现出类似的规律。这是因为掩蔽剂中羟基的存在增加了电极表面的亲水性,使得背景值降低[25],目标物与适配体结合引起的阻抗响应的变化更加明显。因此,在后续实验中,均采用掩蔽剂对适配体修饰电极进行掩蔽。
-
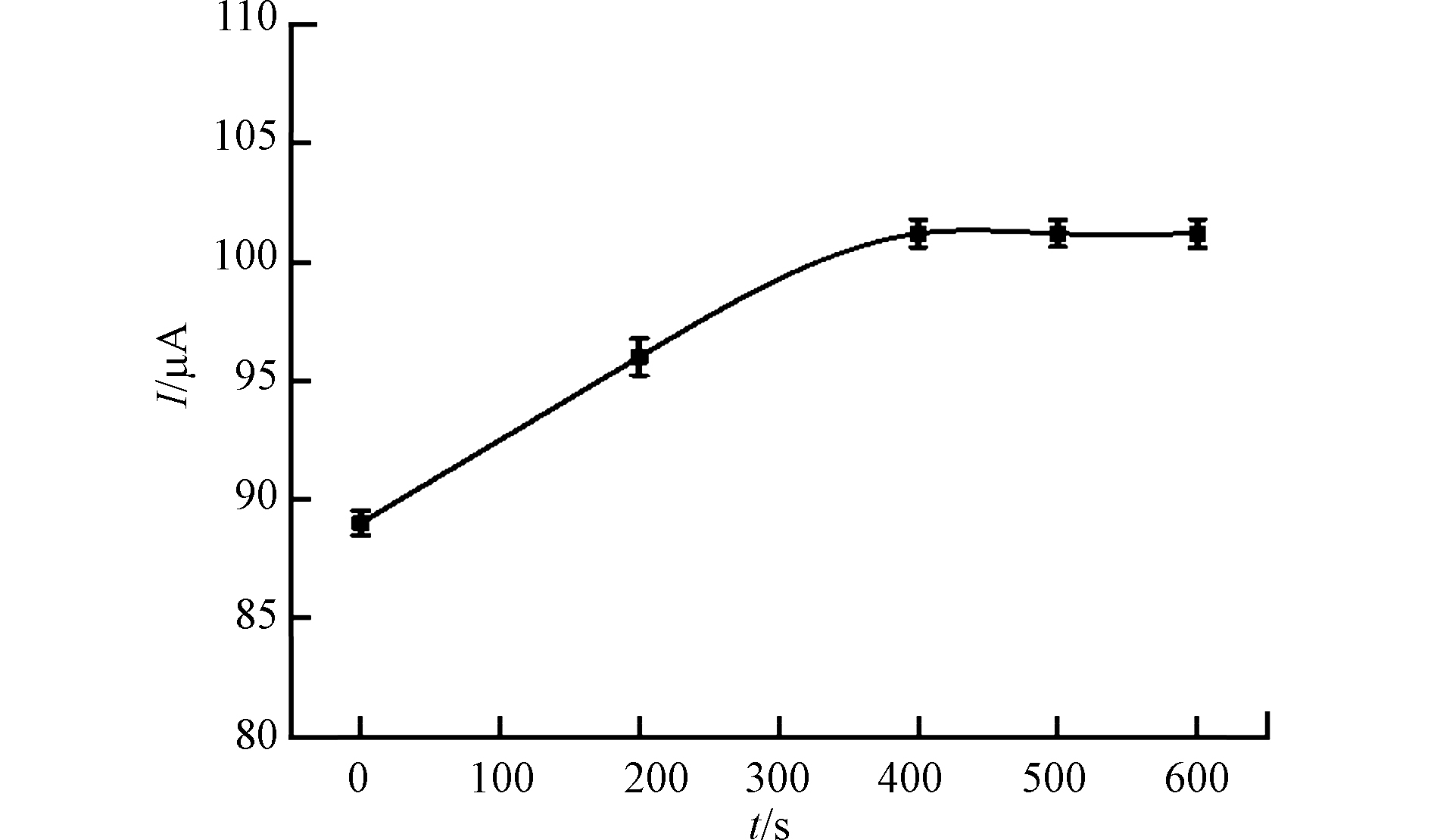
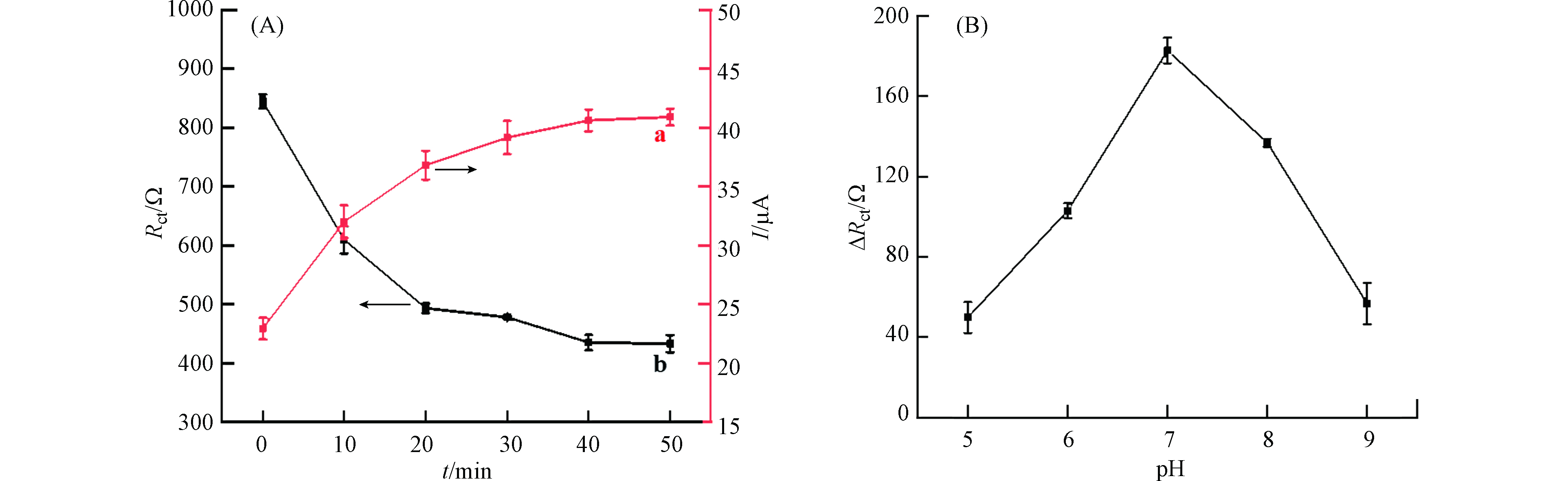
为提高电化学传感器的检测性能,对双酚A的富集时间进行了优化。将修饰电极置于500 nmol·L−1双酚A溶液中富集不同时间,然后在[Fe(CN)6]3-/4-探针溶液中进行DPV和EIS测定。图6A (a) 显示了富集过程中电流的变化情况。随着富集时间的增加,响应电流值逐渐增大,说明双酚A分子到达电极表面并逐渐与适配体进行结合。相应地,由图6A (b) 可知,随着富集时间的增加,阻抗值则逐渐减小,当富集50 min时,峰电流值和阻抗值均达到平衡并趋于稳定,因此确定最佳的富集时间为50 min。
-
由于溶液pH值会影响到电极表面所带电荷的状态,所以研究了溶液pH值对双酚A检测的影响。如图6B所示,随着pH值从5.0变化到7.0,电极的阻抗响应ΔRct逐渐增加,当pH值进一步增加时,ΔRct 明显减小。这可能是在酸性和碱性条件下,双酚A和适配体之间的氢键作用力减弱,使得双酚A结合量减少,响应信号降低。因此,在后续的实验中选择溶液的pH为7.0。
-
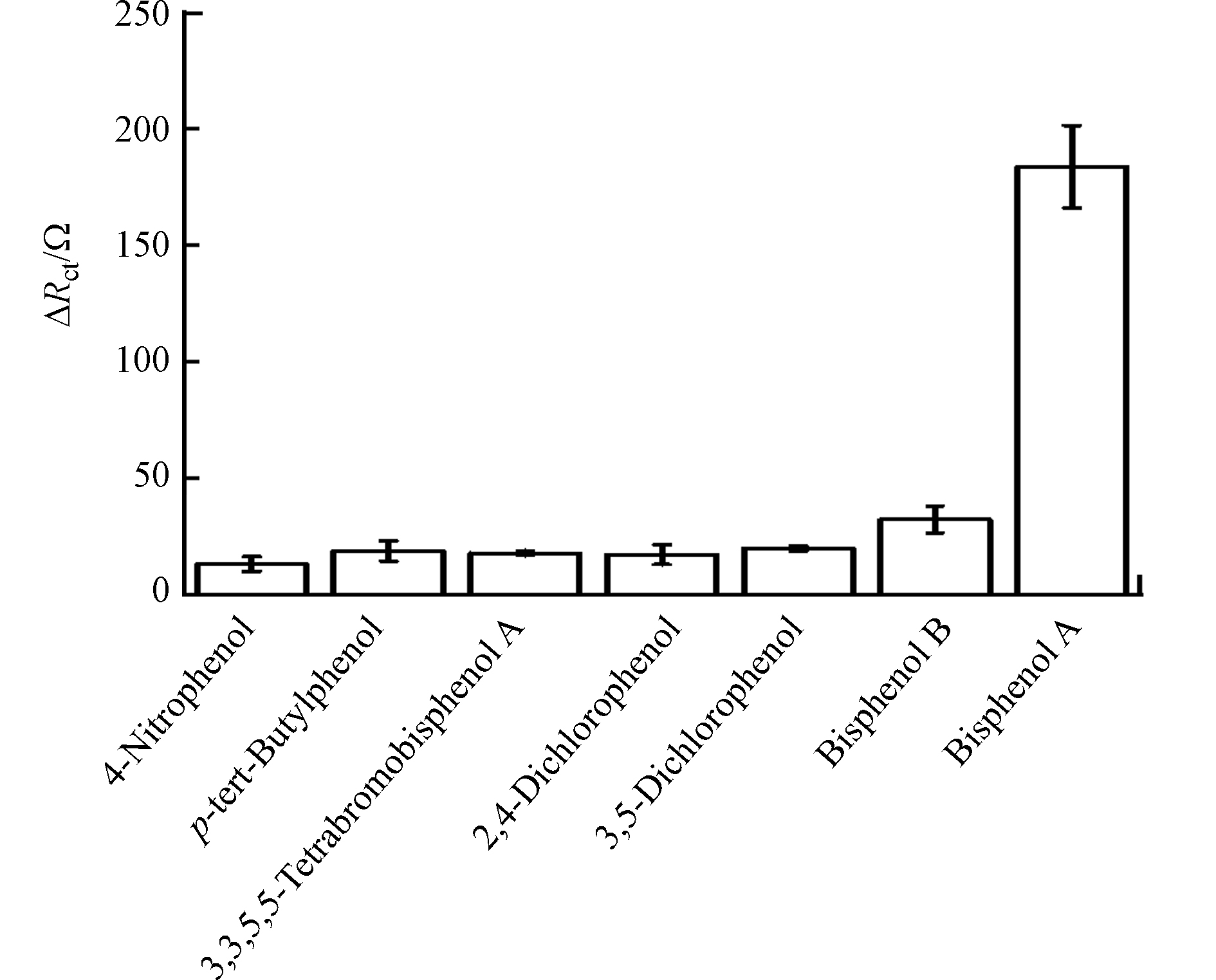
以对硝基苯酚(4-Nitrophenol)、4-叔丁基苯酚(p-tert-Butylphenol)、四溴双酚A(3,3,5,5-tetrabromobisphenol A)、2,4-二氯苯酚(2,4-dichlorophenol)、3,5-二溴苯酚(3,5-dibromophenol)、双酚B(bisphenol B)等6种具有不同分子结构和分子量的酚类化合物作为干扰物质对该传感器进行选择性测试。为了证明该传感器对双酚A分子具有更好的选择性,将双酚A浓度定为10 nmol·L−1,其他酚类化合物的浓度定为500 nmol·L−1。由图7可知,与其他化合物相比,修饰电极对双酚A的阻抗响应值最大,说明该电极对双酚A具有较好的选择性。此外,该电极对双酚B的响应比其他五种酚类化合物的响应略高,这可能是因为双酚B与双酚A的结果最为相似。
-
为评价纳米金-适配体传感器对双酚A的浓度响应,在优化条件下测试了传感器对不同浓度双酚A(1—5000 nmol·L−1)的阻抗及电流响应(图8A和图8B)。由图8A可知,阻抗值随双酚A浓度的增加而逐渐减小,阻抗变化与双酚A浓度的对数值之间呈现良好的线性关系,其线性方程为 y=130.59x+71.911,相关系数为0.996。图8B显示了双酚A浓度与电流响应之间的关系,随着浓度增加,电流逐渐增大,并与浓度的对数值之间呈线性相关,相关系数为0.993。将动态检测范围的最低浓度(1 nmol·L−1)作为该方法的定量检测限(LOQ)。表1提供了文献中已报道的双酚A检测方法,与已有报道方法相比,本方法具有操作简便,线性范围宽,灵敏度高等优势。
-
为研究纳米金-适配体电化学传感器的稳定性,分别制备了4支电极,4 ℃下于磷酸盐缓冲溶液中保存,2周内对其进行间隔测定。结果显示,峰值电流为初始电流的90.4%,阻抗为初始阻抗值的93.6%,其峰值电流和阻抗响应的相对标准偏差分别为6.7%和3.4%,表明该电极在环境中具有良好的稳定性。
为研究纳米金-适配体电化学传感器的重现性,通过该方法制备了4个独立的电极,并记录其对10 nmol·L−1双酚A的信号响应值(n=3)。结果显示,峰值电流和阻抗响应的相对标准偏差分别为7.1%和2.0%,表明该方法的重现性良好,即可重复制备双酚A适配体修饰的电极。
-
为进一步说明纳米金-适配体电化学传感器对实际样品中双酚A浓度检测的可行性,通过阻抗法对河水、污水处理厂出水和自来水中的双酚A进行测定,在测定前使用高效液相色谱法进行本底值检测,结果显示均未被检出。之后将所制备电极分别置于5 nmol·L−1和50 nmol·L−1的水样中50 min,进行电化学测定,由表2可知,其样品回收率为87.4%—110.0%,相对标准偏差均小于10%,表明纳米金-适配体电化学传感器可实现对河水、污水、自来水中双酚A的检测。
-
本研究基于金纳米颗粒和双酚A适配体建立了无标记、操作简便、成本低、高灵敏度的纳米金-适配体电化学传感器。该方法具有良好的选择性、稳定性、重现性和抗干扰性,其定量限低至1×10−9 mol·L−1,并可用于实际河水、污水和自来水中双酚A的检测。
纳米金-适配体电化学传感器用于环境水样中双酚A检测
Gold nanoparticles-aptamer electrochemical sensor for detection of bisphenol A in environmental waters
-
摘要: 制备了一种用于检测双酚A的纳米金-适配体电化学传感器。采用恒电位沉积的方法在玻碳电极表面制备金纳米颗粒提高电极的比表面积及导电性,通过Au—S键作用将末端带有巯基、可特异性识别双酚A的适配体固定在电极表面,以[Fe(CN)6]3-/4-作为氧化还原探针,通过循环伏安法和交流阻抗法对纳米金-适配体电化学传感器的检测性能进行研究,优化了检测性能的影响因素。当金纳米颗粒沉积时间为400 s、适配体浓度为1 μmol·L−1、富集时间为50 min、检测溶液pH 7.0时,电极阻抗响应与双酚A浓度在1×10-9—5×10−6 mol·L−1范围内呈良好线性关系。发展的传感器具有良好的重现性、稳定性和抗干扰性,并成功应用于环境水样中双酚A的检测,回收率87.4%—110.0%。Abstract: A gold nanoparticles-aptamer electrochemical sensor was prepared for the determination of bisphenol A (BPA). Gold nanoparticles were deposited on the surface of glassy carbon electrode by potentiostatic deposition to improve the specific surface area and electrical conductivity of the electrode and the bisphenol A aptamer with a terminal sulfhydryl group that can specifically bind bisphenol A was immobilized onto on the modified electrode surface through the interaction between Au—S bond. Using [Fe(CN)6]3-/4- as a redox probe, the performance of gold nanoparticles-aptamer electrochemical sensor was investigated by cyclic voltammetry and electrochemical impedance spectroscopy, and the factors affecting the sensor performance were optimized. When the deposition time of gold nanoparticles was 400 s, the concentration of aptamer was 1 μmol·L−1, the enrichment time was 50 min at solution pH of 7.0, there was a linear relationship between the impedance response and bisphenol A concentrations ranging from 1×10-9 mol·L−1 to 5×10−6 mol·L−1. The prepared electrode had good reproducibility, stability and anti-interference, and was successfully applied to the detection of bisphenol A in environmental water samples with recoveries of 87.4%—110.0%.
-
Key words:
- aptamer /
- bisphenol A /
- electrochemical detection /
- gold nanoparticles
-

-
图 3 GCE (a),GCE-AuNPs (b),GCE-AuNPs-Aptamer (c),GCE-AuNPs-Aptamer-MCH (d),GCE-AuNPs-Aptamer-MCH-BPA (e) 在5 mmol·L−1 [Fe(CN)6]3-/4- 中的CV (A)和EIS (B)曲线图
Figure 3. CV (A) and EIS (B) curves of GCE (a), GCE-AuNPs (b), GCE-AuNPs-Aptamer (c), GCE-AuNPs-Aptamer-MCH (d), GCE-AuNPs-Aptamer-MCH-BPA (e) in 5 mmol·L−1 [Fe(CN)6]3-/4-
表 1 本方法与其他检测双酚A方法的比较
Table 1. Comparison of this method with other methods for detecting bisphenol A
表 2 实际样品中双酚A的测定结果 (n=3)
Table 2. Determination results of bisphenol A in real samples (n=3)
样品
Sample添加水平/(nmol·L−1)
Spiked实测值/(nmol·L−1)
Found回收率/%
Recovery相对标准偏差/%
RSD河水 5 5.5 110.0 1.89 50 43.7 87.4 2.80 污水 5 4.4 88.4 2.45 50 52.9 105.8 3.67 自来水 5 4.5 90.4 3.54 50 53.8 107.5 5.79 -
[1] WU C, CHENG Q, LI L Q, et al. Synergetic signal amplification of graphene-Fe2O3 hybrid and hexadecyltrimethylammonium bromide as an ultrasensitive detection platform for bisphenol A [J]. Electrochimica Acta, 2014, 115: 434-439. doi: 10.1016/j.electacta.2013.10.188 [2] MIRZAJANI H, CHENG C, WU J, et al. A highly sensitive and specific capacitive aptasensor for rapid and label-free trace analysis of Bisphenol A (BPA) in canned foods [J]. Biosensors and Bioelectronics, 2017, 89: 1059-1067. doi: 10.1016/j.bios.2016.09.109 [3] LIM D S, KWACK S J, KIM K B, et al. Potential risk of bisphenol a migration from polycarbonate containers after heating, boiling, and microwaving [J]. Journal of Toxicology and Environmental Health, Part A, 2009, 72(21/22): 1285-1291. [4] JING P, ZHANG X M, WU Z X, et al. Electrochemical sensing of bisphenol A by graphene-1-butyl-3-methylimidazolium hexafluorophosphate modified electrode [J]. Talanta, 2015, 141: 41-46. doi: 10.1016/j.talanta.2015.03.042 [5] COSIO M S, PELLICANÒ A, BRUNETTI B, et al. A simple hydroxylated multi-walled carbon nanotubes modified glassy carbon electrode for rapid amperometric detection of bisphenol A [J]. Sensors and Actuators B:Chemical, 2017, 246: 673-679. doi: 10.1016/j.snb.2017.02.104 [6] LI X N, FRANKE A A. Improvement of bisphenol A quantitation from urine by LCMS [J]. Analytical and Bioanalytical Chemistry, 2015, 407(13): 3869-3874. doi: 10.1007/s00216-015-8563-z [7] HÁKOVÁ M, CHOCHOLOUŠOVÁ HAVLÍKOVÁ L, CHVOJKA J, et al. An on-line coupling of nanofibrous extraction with column-switching high performance liquid chromatography - A case study on the determination of bisphenol A in environmental water samples [J]. Talanta, 2018, 178: 141-146. doi: 10.1016/j.talanta.2017.08.098 [8] NICOLUCCI C, ERRICO S, FEDERICO A, et al. Human exposure to Bisphenol A and liver health status: Quantification of urinary and circulating levels by LC-MS/MS [J]. Journal of Pharmaceutical and Biomedical Analysis, 2017, 140: 105-112. doi: 10.1016/j.jpba.2017.02.058 [9] SPAGNUOLO M L, MARINI F, SARABIA L A, et al. Migration test of Bisphenol A from polycarbonate cups using excitation-emission fluorescence data with parallel factor analysis [J]. Talanta, 2017, 167: 367-378. doi: 10.1016/j.talanta.2017.02.033 [10] PENG C F, PAN N, XIE Z J, et al. Determination of bisphenol A by a gold nanoflower enhanced enzyme-linked immunosorbent assay [J]. Analytical Letters, 2016, 49(10): 1492-1501. doi: 10.1080/00032719.2015.1113420 [11] QIAO Y F, LI J, LI H B, et al. A label-free photoelectrochemical aptasensor for bisphenol A based on surface plasmon resonance of gold nanoparticle-sensitized ZnO nanopencils [J]. Biosensors and Bioelectronics, 2016, 86: 315-320. doi: 10.1016/j.bios.2016.06.062 [12] ZHU Y, ZHOU C Q, YAN X P, et al. Aptamer-functionalized nanoporous gold film for high-performance direct electrochemical detection of bisphenol A in human serum [J]. Analytica Chimica Acta, 2015, 883: 81-89. doi: 10.1016/j.aca.2015.05.002 [13] YU P, LIU Y Q, ZHANG X H, et al. A novel electrochemical aptasensor for bisphenol A assay based on triple-signaling strategy [J]. Biosensors and Bioelectronics, 2016, 79: 22-28. doi: 10.1016/j.bios.2015.12.007 [14] ARABALI V, EBRAHIMI M, GHEIBI S, et al. Bisphenol A analysis in food samples using modified nanostructure carbon paste electrode as a sensor [J]. Food Analytical Methods, 2016, 9(6): 1763-1769. doi: 10.1007/s12161-015-0349-6 [15] HUANG Y, LI X F, ZHENG S N. A novel and label-free immunosensor for bisphenol A using rutin as the redox probe [J]. Talanta, 2016, 160: 241-246. doi: 10.1016/j.talanta.2016.07.017 [16] LIU Y J, LIU Y, LIU B H. A dual-signaling strategy for ultrasensitive detection of bisphenol A by aptamer-based electrochemical biosensor [J]. Journal of Electroanalytical Chemistry, 2016, 781: 265-271. doi: 10.1016/j.jelechem.2016.06.048 [17] ENSAFI A A, AMINI M, REZAEI B. Molecularly imprinted electrochemical aptasensor for the attomolar detection of bisphenol A [J]. Microchimica Acta, 2018, 185(5): 1-7. [18] YANG J, KIM S E, CHO M, et al. Highly sensitive and selective determination of bisphenol-A using peptide-modified gold electrode [J]. Biosensors and Bioelectronics, 2014, 61: 38-44. doi: 10.1016/j.bios.2014.04.009 [19] ALSAAFIN A, MCKEAGUE M. Functional nucleic acids as in vivo metabolite and ion biosensors [J]. Biosensors and Bioelectronics, 2017, 94: 94-106. doi: 10.1016/j.bios.2017.02.030 [20] NA W D, LIU X T, WANG L, et al. Label-free aptamer biosensor for selective detection of thrombin [J]. Analytica Chimica Acta, 2015, 899: 85-90. doi: 10.1016/j.aca.2015.09.051 [21] TAN F, CONG L C, LI X N, et al. An electrochemical sensor based on molecularly imprinted polypyrrole/graphene quantum dots composite for detection of bisphenol A in water samples [J]. Sensors and Actuators B:Chemical, 2016, 233: 599-606. doi: 10.1016/j.snb.2016.04.146 [22] ZHAN T R, SONG Y, TAN Z W, et al. Electrochemical bisphenol A sensor based on exfoliated Ni2Al-layered double hydroxide nanosheets modified electrode [J]. Sensors and Actuators B:Chemical, 2017, 238: 962-971. doi: 10.1016/j.snb.2016.07.151 [23] CHEN D, YAO D S, XIE C F, et al. Development of an aptasensor for electrochemical detection of tetracycline [J]. Food Control, 2014, 42: 109-115. doi: 10.1016/j.foodcont.2014.01.018 [24] ZAMORA-GÁLVEZ A, AIT-LAHCEN A, MERCANTE L A, et al. Molecularly imprinted polymer-decorated magnetite nanoparticles for selective sulfonamide detection [J]. Analytical Chemistry, 2016, 88(7): 3578-3584. doi: 10.1021/acs.analchem.5b04092 [25] WANG Y T, FENG J J, TAN Z A, et al. Electrochemical impedance spectroscopy aptasensor for ultrasensitive detection of adenosine with dual backfillers [J]. Biosensors and Bioelectronics, 2014, 60: 218-223. doi: 10.1016/j.bios.2014.04.022 [26] ALI H, MUKHOPADHYAY S, JANA N R. Selective electrochemical detection of bisphenol A using a molecularly imprinted polymer nanocomposite [J]. New Journal of Chemistry, 2019, 43(3): 1536-1543. doi: 10.1039/C8NJ05883K [27] KOYUN O, GORDUK S, GENCTEN M, et al. A novel copper(ıı) phthalocyanine-modified multiwalled carbon nanotube-based electrode for sensitive electrochemical detection of bisphenol A [J]. New Journal of Chemistry, 2019, 43(1): 85-92. doi: 10.1039/C8NJ03721C [28] KHANNA M, ROY S, KUMAR R, et al. MnO2 based bisphenol-A electrochemical sensor using micro-fluidic platform [J]. IEEE Sensors Journal, 2018, 18(6): 2206-2210. doi: 10.1109/JSEN.2018.2792476 [29] JALALVAND A R, HASELI A, FARZADFAR F, et al. Fabrication of a novel biosensor for biosensing of bisphenol A and detection of its damage to DNA [J]. Talanta, 2019, 201: 350-357. doi: 10.1016/j.talanta.2019.04.037 -



 下载:
下载: