-
四氢呋喃(tetramethylene,简称为THF)是一种具有含氧杂环结构的醚类物质,广泛应用于合成橡胶、农药以及工业溶剂等方面. 此外,THF的高水溶性和低辛醇/水分配系数,使其极易迁移至地下水中,对饮用水安全造成潜在威胁[1]. 然而,杂环结构使其难降解且具有毒性[2],传统生化法无法有效处理. 近年来,高级氧化技术(AOPs)逐渐用于水中有机污染物的去除,包括光-芬顿[3]、光催化氧化[4]、臭氧氧化[5]等. 其中,均相光-芬顿在体系中能产生强氧化性活性物质·OH,因而广泛应用于工业废水处理.
均相光芬顿体系的原理可理解为在光照以及酸性(通常pH<3)条件下,Fe2+通过与H2O2反应实现H2O2的活化,从而分解产生·OH. 但其存在一些不可避免的弊端,如pH条件严苛、活化效率低(H2O2消耗大)、Fe2+不能回收利用[6]等. 因此,构建一种既能克服均相体系中的缺陷且同时具备提升H2O2活化效率能力的异相体系尤为重要.
金属-有机骨架(MOFs)作为一种新型晶态多孔半导体材料,因具有催化活性强以及稳定性高等优点[7]在有机物降解领域倍受关注. 与传统半导体材料相比,MOFs的优势更大,原因在于更小的能带间隙使其具备更强的光吸收能力,这不仅促进了其外层价电子跃迁过程的发生同时激发产生更多的光生载流子(e−和h+),更重要的是,光生e−可将H2O2作为受体产生·OH,这表明MOFs具有活化H2O2的潜力;并且MOFs较稳定,且可重复使用. 因此,MOFs可作为异相体系中H2O2活化剂的良好选择. 拉瓦锡研究所材料(Materials of Institute Lavoisier, 简称MIL)是MOFs的一种. 相比于MOF-5和HKUST-1等其他常用的MOFs,MILs在水中有更好的稳定性[8],并且还具有优良的光吸收能力以及超大比表面积等优点. 其中,Fe基MILs因具有多种优良性质而备受关注. 首先Fe在自然界中含量丰富易得,其次Fe-MOFs的水稳定性良好,另外,由于Fe—O团簇的存在使其拥有大量不饱和位点和优异的光吸收能力,且Fe3+与Fe2+的转化在UV/H2O2中会形成类光-芬顿促进降解[9]. 研究人员围绕Fe基MILs材料在有机污染物去除领域开展了大量工作. 例如Wu等[10]制备了MIL-101(Fe)并与H2O2协同形成光-芬顿,加快了体系中Fe3+和Fe2+的转化,在20 min内降解了约80%的TC-HCl;Du等[11]通过制备异质结MIL-100(Fe)/g-C3N4同样与H2O2协同降解药物双氯芬酸钠,并在50 min内实现了几乎完全降解等.
为解决利用均相光芬顿体系处理工业废水中典型杂环类有机成分THF面临的突出问题,本研究拟探讨基于晶态多孔Fe基MOFs材料MIL-53(Fe)构建异相光催化/芬顿体系实现H2O2高效活化、拓宽pH范围,提升THF降解效率. 同时,研究了初始溶液pH、H2O2投加量以及MIL-53(Fe)添加量对THF降解的影响,除此之外,还探究了MIL-53(Fe)的循环使用性、THF溶液降解前后的可生化性以及THF的降解机理及途径等.
-
主要试剂:六水合氯化铁(FeCl3·6H2O,99%)和四氢呋喃(tetramethylene,AR,99.0%)购自上海麦克林生化科技有限公司;对苯二甲酸(terephthalic,H2BDC,99%)和N,N-二甲基甲酰胺(N,N-dimethylformamide,简称为DMF,99%)购自上海阿拉丁生化科技股份有限公司;乙醇(无水乙醇,95%)和过氧化氢(H2O2,30%)购自国药集团化学试剂有限公司;氢氧化钠(NaOH)和盐酸(HCl)为分析纯,实验用水均为去离子水(电阻率≈18.2 MΩ˖cm). 本研究所使用的化学试剂均为商业市售分析级.
主要仪器:光催化反应仪(包括量筒式烧杯(高39 cm,口径16 cm),28 W紫外灯(λ=254 nm)以及石英套管,冷阱,电源连接及启动装置、磁力搅拌器及搅拌子)(上海季光特种照明电器厂),聚四氟乙烯内衬反应釜(上海予申仪器有限公司,100 mL),COD消解仪(哈希DRB200),UV-vis分光光度计(哈希DR6000),气相色谱仪(岛津GC-17A),液相色谱-质谱联用仪(岛津LC-MS8050).
-
本研究的实验装置简图如图1所示.
-
采用水热合成法制备了金属有机骨架MIL-53(Fe)[12]. 具体方法如下:准确称量2 mmol水合氯化铁(0.541 g)和2 mmol对苯二甲酸(0.332 g)分别溶解在20 mL DMF中,并在室温下磁性搅拌. 随后将FeCl3溶液缓缓加入H2BDC溶液中,继续搅拌. 待溶液成均一状,将其转移至100 mL聚四氟乙烯内衬高压釜中密封,并在120 ℃下反应10 h. 待高压釜自然冷却至室温后,离心收集产物,然后用DMF和乙醇分别洗涤3—5次. 将所得黄褐色产物在120 ℃真空中干燥即可.
-
利用X射线衍射仪(德国BrukerD8)获得了制备材料的X射线衍射图谱(PXRD),以分析其物相组成和晶体结构等. 利用ESCALAB 250Xi(赛默飞世尔科技公司)获得了X射线光电子能谱(XPS),研究了高分辨率C1s、O1s和Fe2p以确定元素价态等. 利用IS5光谱仪(赛默飞世尔科技公司)获得了傅里叶变换红外光谱(FT-IR),以获得MIL-53(Fe)的化学键信息,范围400—4000 cm−1. 利用扫描电子显微镜(日立S4800)获得MIL-53(Fe)的表面形貌及颗粒尺寸. 采用NetzzchTG209F3热重分析仪分析了MIL-53(Fe)的热稳定性(TGA),以10 ℃·min−1的速率从室温加热至800 ℃,观察其重量随温度的变化. 在UV-vis分光光度计(岛津UV3600I Plus)上记录了MIL-53(Fe)的紫外-可见漫反射光谱(UV-vis DRS),以分析其光吸收能力以及带隙宽度等.
-
为评价体系中MIL-53(Fe)的添加对THF降解效率的提升,设计了UV、UV/MIL-53(Fe)、UV/H2O2以及MIL-53(Fe)/UV/H2O2的4组平行实验以比较. THF溶液浓度为50 mg·L−1,体积为400 mL,且各组实验在开启光源前,MIL-53(Fe)在黑暗条件下已达到吸附-解吸平衡. 每隔一定光照时间,取定量反应液于5000 r·min−1下离心10 min. 溶液中THF的残余浓度利用GC测定分析. THF降解率按照以下公式[13]计算:
其中,C0和Ct分别代表THF溶液的初始浓度(mg·L−1)以及某一反应时刻THF溶液的浓度(mg·L−1). 使用后的MIL-53(Fe)用无水乙醇以及去离子水洗涤数次,随后在80 ℃下烘干以进行循环实验.
-
利用OxiTop IS BOD测定仪(德国WTW公司)测定了反应前后溶液BOD5和OUR的值. 此外,还测定了降解前后溶液的COD、TOC,从而计算得到BOD5/COD、OUR、AOS以及COS的4种评价指标值,以判断降解前后溶液的可生化性水平.
-
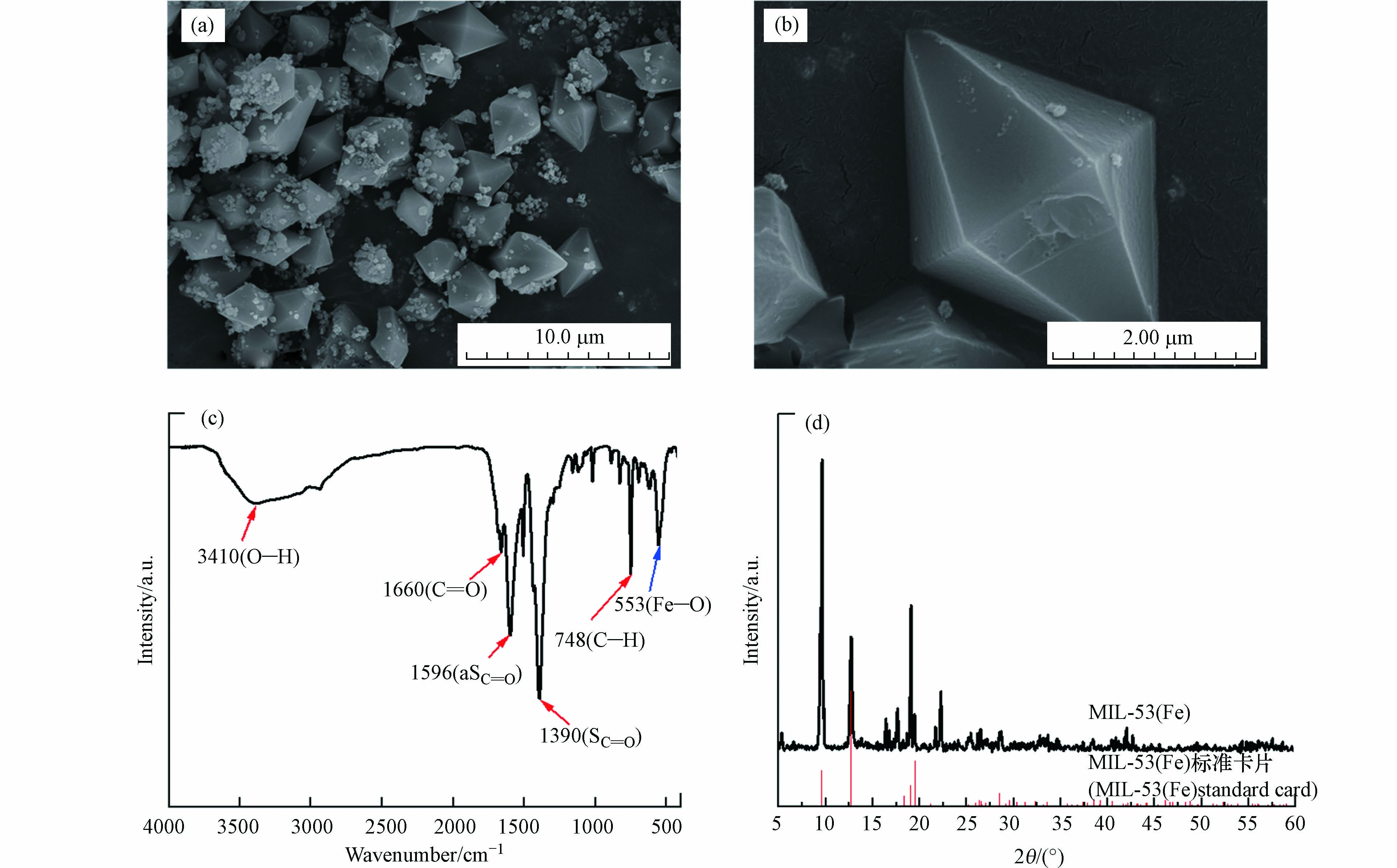
粉末X射线衍射(PXRD)表征结果显示分别在2θ=9.6°、12.7°、19.1°、22.3°附近可观察到高且窄的衍射强峰(图2(d)). 这与先前报道的超声合成法制备的MIL-53(Fe)高度吻合[14],表明MIL-53(Fe)成功合成,且它们的半峰宽分别为0.144°、0.185°、0.133°和0.134°(<0.2°),这说明制得的MIL-53(Fe)晶化程度高. 扫描电子显微镜(SEM)结果如图2(a)、(b)所示,在较低倍数下(5.0 k),观察到大量颗粒聚集,且形状规整呈近似纺锤型,表面附着的白色物质应为残余的DMF未洗涤完全;而在高放大倍数下(25.0 k),测得了颗粒的尺寸,其平均长度为2—4 μm,宽度为1—3 μm,且结晶度较高,与XRD图表现一致.
FT-IR光谱结果如图2(c)所示. 以3410 cm−1为中心的宽峰与表面吸附水的O—H的伸缩振动有关,在1596 cm−1和1390 cm−1处的两个吸收峰分别是羧基的不对称(νas(C=O))和对称((νsC=O))振动,证明了其中二羧酸连接体的存在[15]. 1660 cm−1处的吸收带对应于C=O键的拉伸振动,位于750 cm−1处的吸收峰则是对应于有机配体苯环上C—H的弯曲振动[16]. 此外,在553 cm−1处的吸收峰对应的Fe—O键拉伸振动,证明在Fe与对苯二甲酸的羧基之间形成了Fe—O簇,这是MIL-53(Fe)具备优良光吸收能力的关键所在.
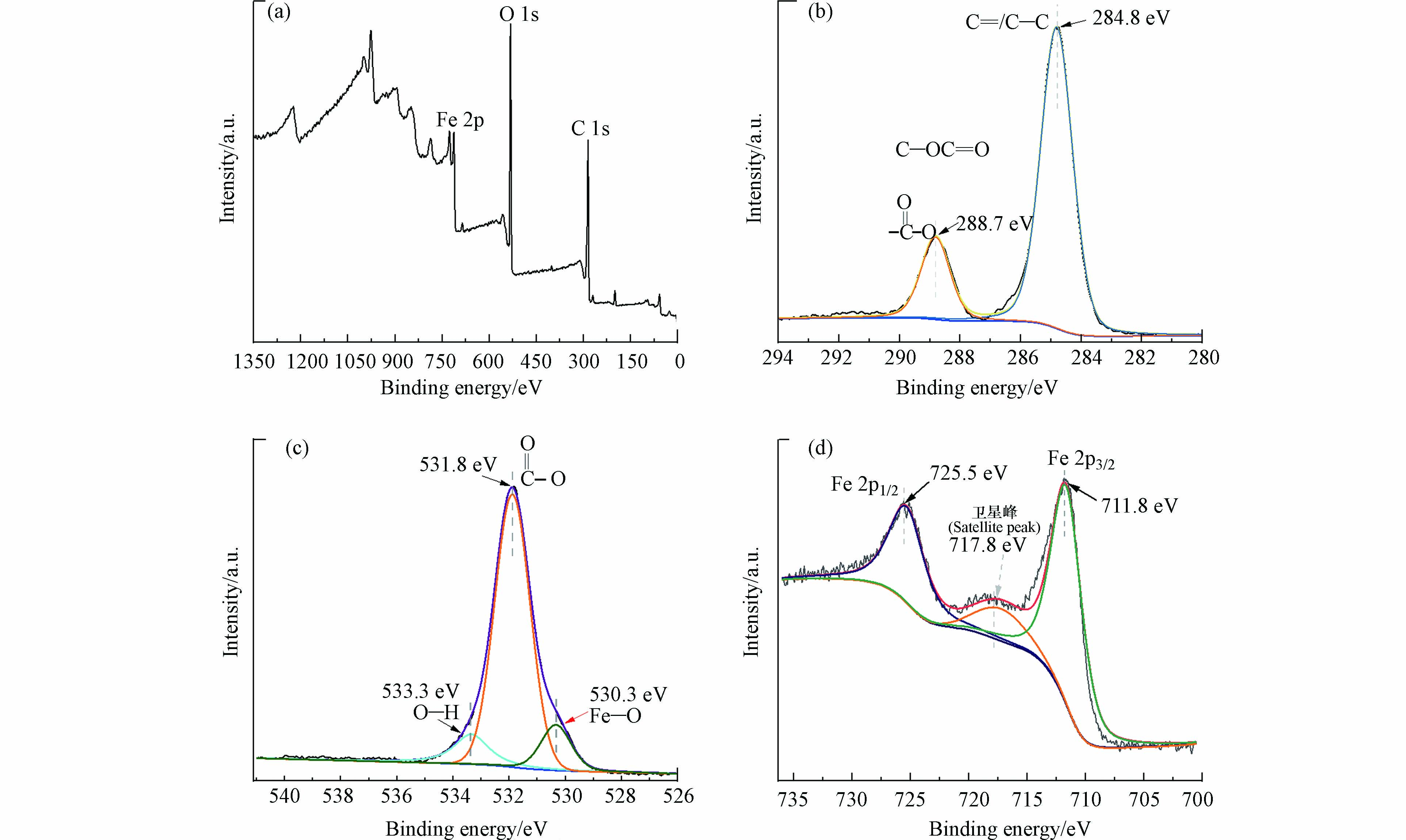
MIL-53(Fe)的XPS电子能谱如图3所示. 图3(a)中的全谱结果表明了MIL-53(Fe)由C、O、Fe元素组成. (b)中高分辨率C1s能谱在结合能为284.8 eV和288.7 eV处共拟合出两个峰,分别对应对苯二甲酸的苯环(C—C/C=C)以及羧酸基团上的碳成分(O=C—O);(c)图中展示的高分辨率O1s能谱在结合能为530.3、531.8、533.3 eV处共拟合出3个峰,分别对应MIL-53(Fe)中心金属Fe与有机配体间形成的Fe—O键以及配体上的氧组成(O=C和O—H);对于Fe2p的高分辨率能谱(图d),结合能在711.8 eV和725.5 eV附近的两个峰分别属于Fe 2p3/2和Fe 2p1/2,并由此计算出Fe 2p1/2和Fe 2p3/2的自旋分裂(ΔFe)为13.7 eV[17],这一结果接近于Fe2O3的理论值13.6 eV[18],证明MIL-53(Fe)中的游离态Fe以Fe3+形式存在[19],这为之后THF降解机理的阐释中Fe3+/Fe2+的转化提供重要依据. 此外,结合能在717.8 eV处的峰为Fe 2p的卫星峰,也是Fe3+的特征峰,表征了Fe3+的存在[20].
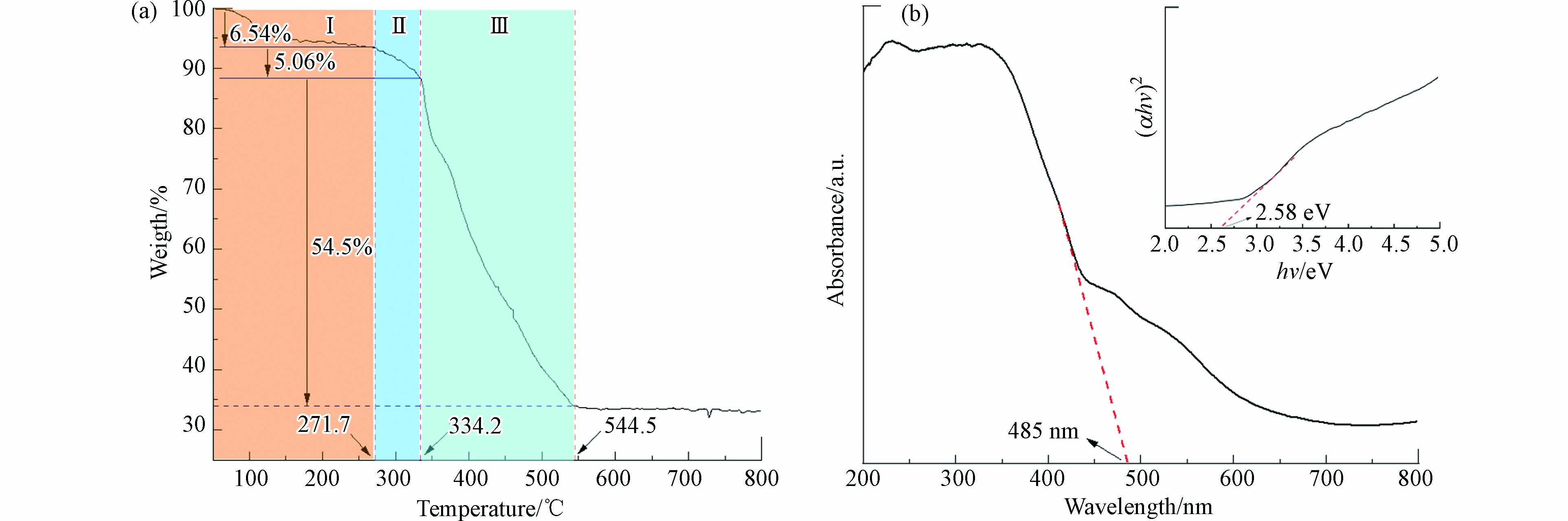
作为催化剂,热稳定性尤为重要. 利用热重分析法得到了MIL-53(Fe)的重量随温度的变化规律. 由图4(a),可将其整个过程的重量变化分为3个主要阶段. 第Ⅰ阶段:当温度升高至270 ℃左右,重量减少了约6.54%,原因在于MIL-53(Fe)孔隙中的水分子以及表面残余DMF的蒸发;第Ⅱ阶段:在270—330 ℃左右,当温度升至此范围内时,与MIL-53(Fe)中心Fe3+相互作用的水分子被剥离出去,导致重量降低了约5.06%;第Ⅲ阶段:材料的环境温度超过330 ℃以后,其重量下降的速率陡增,这主要对应两个过程:一是对苯二甲酸有机配体在高温下逐渐脱离以及发生碳化;二是随着温度的持续升高,MIL-53(Fe)的框架逐渐坍塌[21]. 综上,Ⅰ、Ⅱ阶段中更多是水分子与DMF的蒸发等导致重量的降低,而框架结构没有破坏,但在第Ⅲ阶段中开始逐渐崩塌. 所以MIL-53(Fe)在330 ℃以下能保持结构稳定性,表明其有着良好的热稳定性,有利于应对恶劣的废水环境.
此外,记录了MIL-53(Fe)的UV-vis漫反射光谱(DRS). 如图4(b)所示,MIL-53(Fe)在200—450 nm范围内具有较强的光吸收,这是由于对苯二甲酸有机配体的e−向中心金属Fe3+转移(O(Ⅱ)→Fe(Ⅲ))所致,即LMCT过程;而在450—650 nm波段内光吸收强度较弱,这可以归因于Fe3+与Fe2+间的电子转移[21]. 为进一步了解MIL-53(Fe)的光学性质,利用Tauc-plot公式(αhv)1/n=A(hv-Eg)计算MIL-53(Fe)的带隙值. 其中,
$ \alpha $ 为吸光指数,$ h $ 为普朗克常数,$ \nu $ 为光频,$ A $ 为能量常数,Eg为半导体禁带宽度,$ n $ 与半导体类型相关(直接带隙:n=1/2;间接带隙:n=2),MIL-53(Fe)的n值为1/2. 如图4(b)所示,MIL-53(Fe)的带隙值约为2.58 eV,再由计算公式λ=1240/Eg得到了MIL-53(Fe)的理论吸收边缘[22],约为480 nm. 综上,MIL-53(Fe)具有良好的光吸收能力,且计算所得理论值与图4(b)中实际测定值基本吻合,这也表明材料的纯度较高. -
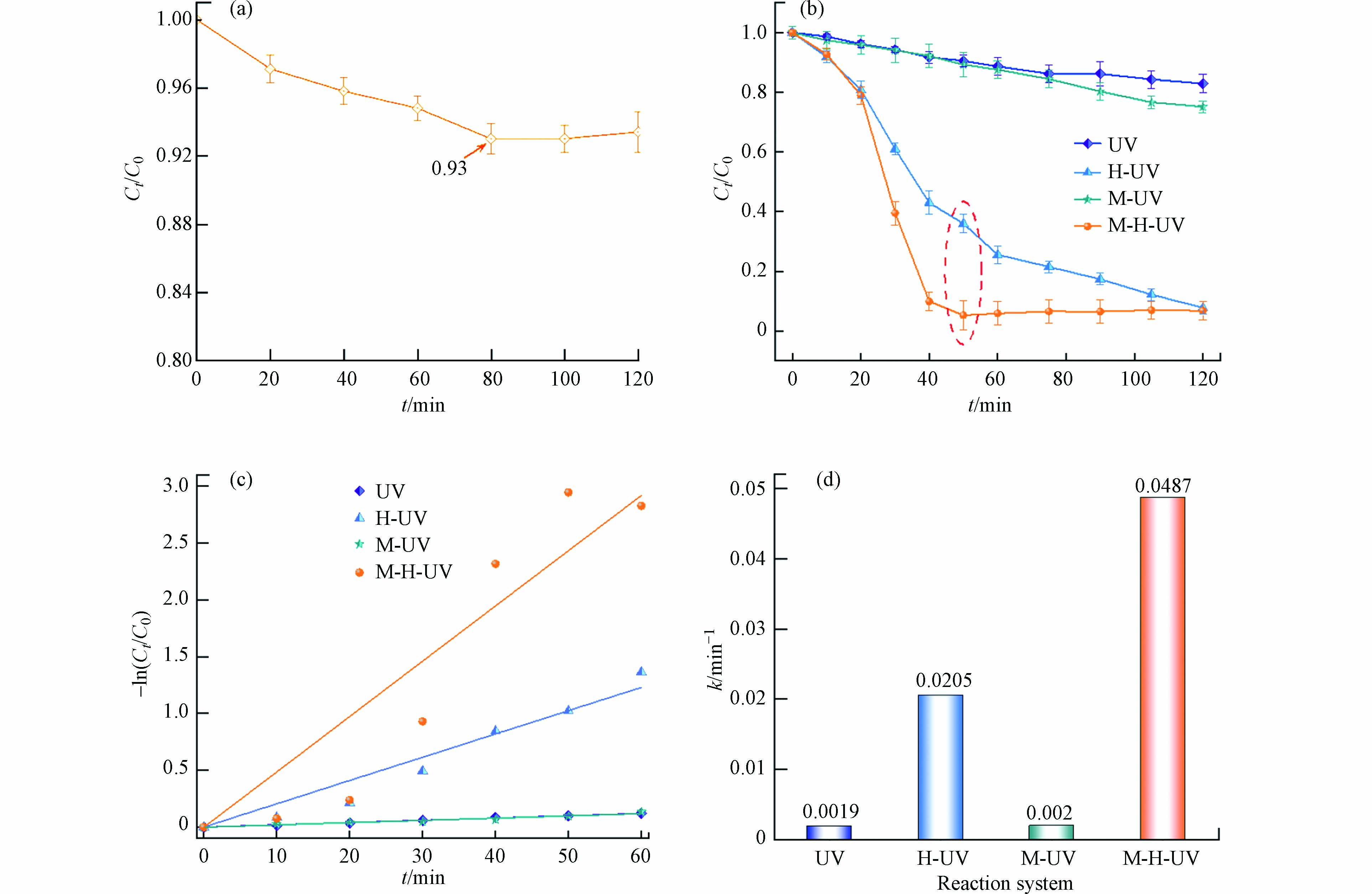
首先研究了MIL-53(Fe)在黑暗条件下对THF的吸附表现. 结果如图5(a)所示. 在本实验环境条件下,MIL-53(Fe)在80 min左右即可达到吸附-解吸平衡. 以体系中THF浓度为评价指标计算得出,MIL-53(Fe)的吸附能力只在约35 mg·g−1,THF吸附去除率也仅为7%左右,表明MIL-53(Fe)对于THF的吸附能力较弱.
图5(b)为4种体系在同一条件下分别降解THF的情况. 单纯UV(图中UV)在120 min内能实现约17%的降解率,随着光照时间的不断延长,降解率也随之缓慢增大,表明THF有一定的紫外光敏性. UV/MIL-53(Fe)体系(图中M-UV)在120 min内可降解约24.9%的THF. 降解率低的主要原因在于MIL-53(Fe)在该体系中没有产生足够·OH或·O2−的能力(具体见2.6),而体系中的光生h+在反应过程中会与光生e−复合,造成损失,因此体系中的有效自由基浓度太低,导致降解效果差. 而在UV/H2O2(图中H-UV)和MIL-53(Fe)/UV/H2O2体系(图中M-H-UV)中,反应至120 min,去除率均可达到90%以上. 然而,如图中所示,添加了MIL-53(Fe)的UV/H2O2体系在反应至约50 min时,降解率就已达到94.7%,这是UV/H2O2体系达到同等降解效果效率的2.4倍. 效率提升的主要原因在于MIL-53(Fe)受激发产生的e−会被H2O2捕获而产生·OH,这使得H2O2的消耗途径增加、消耗速率增大,因此·OH的产生速率也会随之增大,直接提升了THF的降解效率(具体见2.6),也证明MIL-53(Fe)的加入强化了UV/H2O2体系.
此外,THF的光催化降解过程近似遵循伪一级动力学,由图5(c)可知,在MIL-53(Fe)/UV/H2O2体系中,THF的降解速率远远大于另外3种体系. 此外,从图5(d)可知,MIL-53(Fe)/UV/H2O2的降解速率常数(0.0487)是UV/H2O2体系降解速率常数(0.0205)的2.375倍,甚至远超过UV、UV/MIL-53(Fe)和UV/H2O2反应体系速率常数的总和(0.0244),证明MIL-53(Fe)的加入能大幅提升THF的降解效率. 其准一阶降解动力学模型[7]如下:
其中,Ct和C0代表某一反应时刻体系中THF浓度(mg·L−1)以及初始THF浓度(mg·L−1),k代表速率常数,t代表反应时间(min).
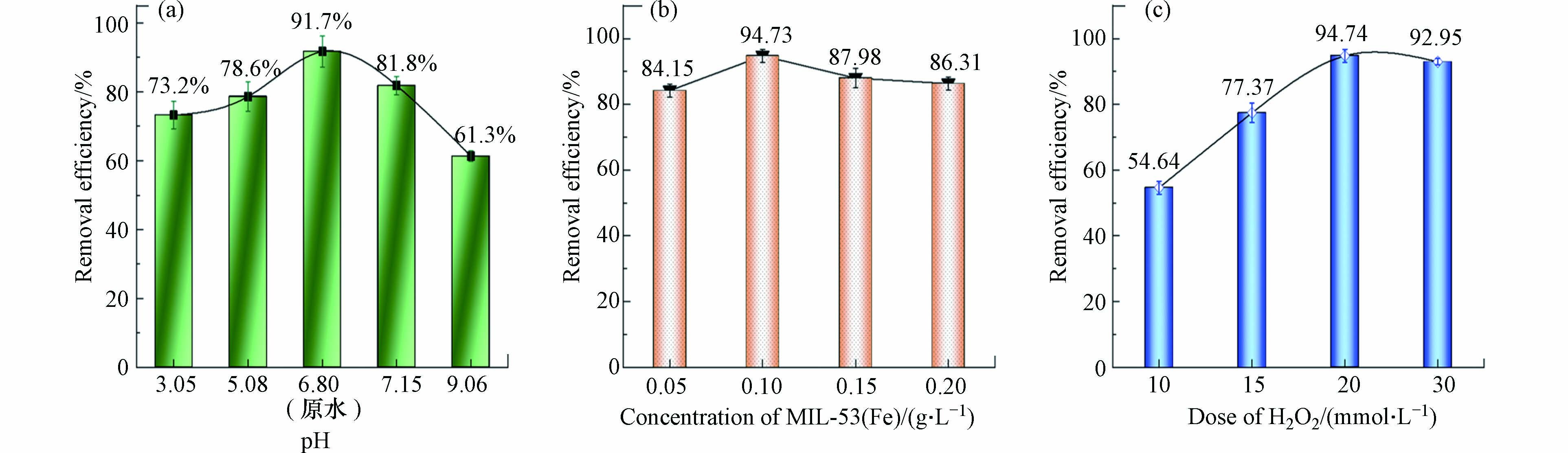
初始pH是影响降解效率的重要因素. 如图6(a)所示,MIL-53(Fe)能在3.0—9.0的THF溶液pH范围内基本保持光催化活性. 随着将溶液pH由极弱酸性(原水≈6.80)调节至碱性(约为9.0),THF的降解率由91.7%逐渐降低至61.3%. 原因可能是H2O2在碱性介质中不稳定,易水解为O2和H2O;而将pH调至强酸性(pH≈3.0)时,降解率的下降幅度较小,约为18.5%. 这可能是H2O2本身呈弱酸性,所以在酸性体系中其氧化能力得到保护,水解趋势减弱,消耗较少. 但过强的酸性会产生反作用,抑制·OH的生成[23],导致降解率下降.
同时,还研究了MIL-53(Fe)的添加量对THF降解的影响. 如图6(b)所示,当投加的MIL-53(Fe)浓度从0.05增加至0.2 g·L−1,降解率呈现先增后减的趋势,并在0.1 g·L−1时达到最高. 随着MIL-53(Fe)的持续搅拌,溶液中的部分THF会被MIL-53(Fe)表面的孔隙“截住”,随后被降解;若继续向溶液中投入过量MIL-53(Fe)至0.2 g·L−1,可能会造成MIL-53(Fe)颗粒的轻微团聚,从而影响光的照射以及催化剂活性位点的暴露,进而影响活性自由基的产生效率,导致降解率的轻度下降.
H2O2作为反应中的氧化剂,其浓度变化可能会影响降解效率. 结果如图6(c)所示. 当H2O2浓度由10 mmol·L−1逐渐增加到20 mmol·L−1时,降解率从54.64%大幅提高至94.74%. 这是由于溶液中H2O2浓度的提高,体系中产生·OH的效率随之提升. 然而,随着H2O2浓度从20 mmol·L−1增至30 mmol·L−1,降解率并没有进一步提高,而是维持在相同水平. 原因在于体系中H2O2的含量超过体系在该时刻消耗H2O2的能力时,溶液中多余的H2O2分子会成为·OH的清除剂,并产生具有较低氧化电位的HO2·. 具体原理如下[24].
-
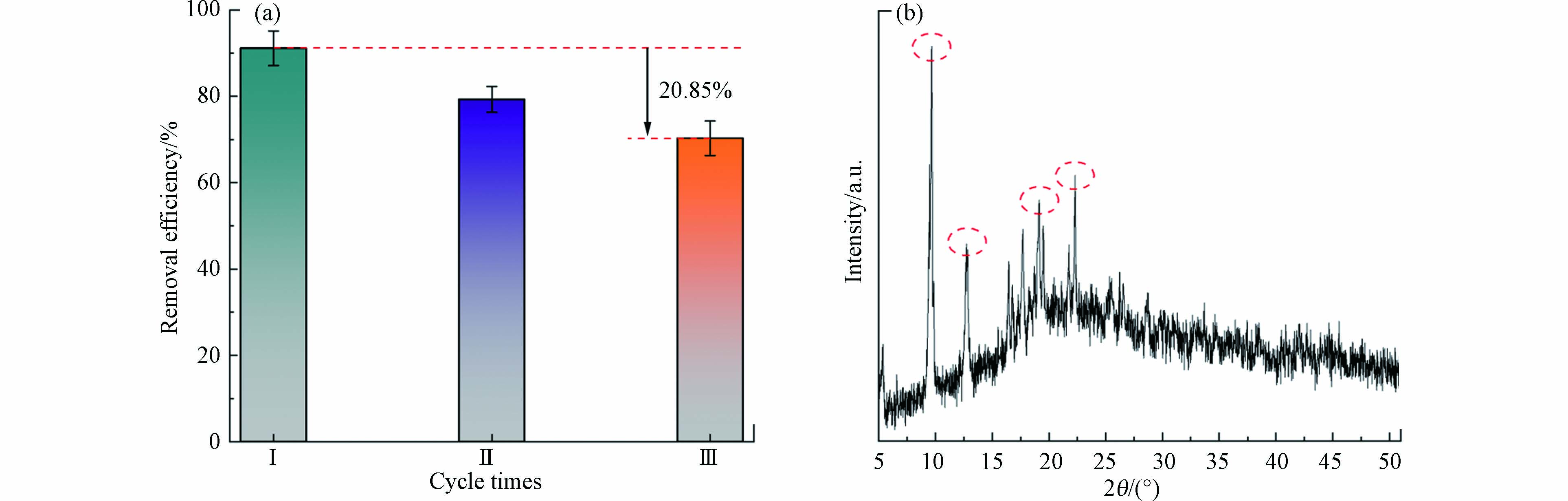
通过模拟进行相同实验条件下的循环降解实验探究MIL-53(Fe)的稳定性. 结果如图7(a)所示. 在经过3次循环实验后,THF去除率由91.14%降至70.29%,降幅约为20.85%. (b)图为MIL-53(Fe)在经过3次试验后测得的PXRD,和反应前相比,仍能观察到相同角度的衍射峰,但峰强有一定程度削弱,这表明反应后的MIL-53(Fe)晶面保持完整,但结晶度受到了影响. 因此推测造成降解率损失较大的原因可能是:MIL-53(Fe)在经多次离心、洗涤、烘干再收集的过程中质量损失;另外连续的反应使MIL-53(Fe)的框架稳定性受到影响,发生了解体. 针对以上结果,后续研究将会在维持高效降解的同时,着力提高体系中MIL-53(Fe)的稳定性,充分发挥其应用潜力.
-
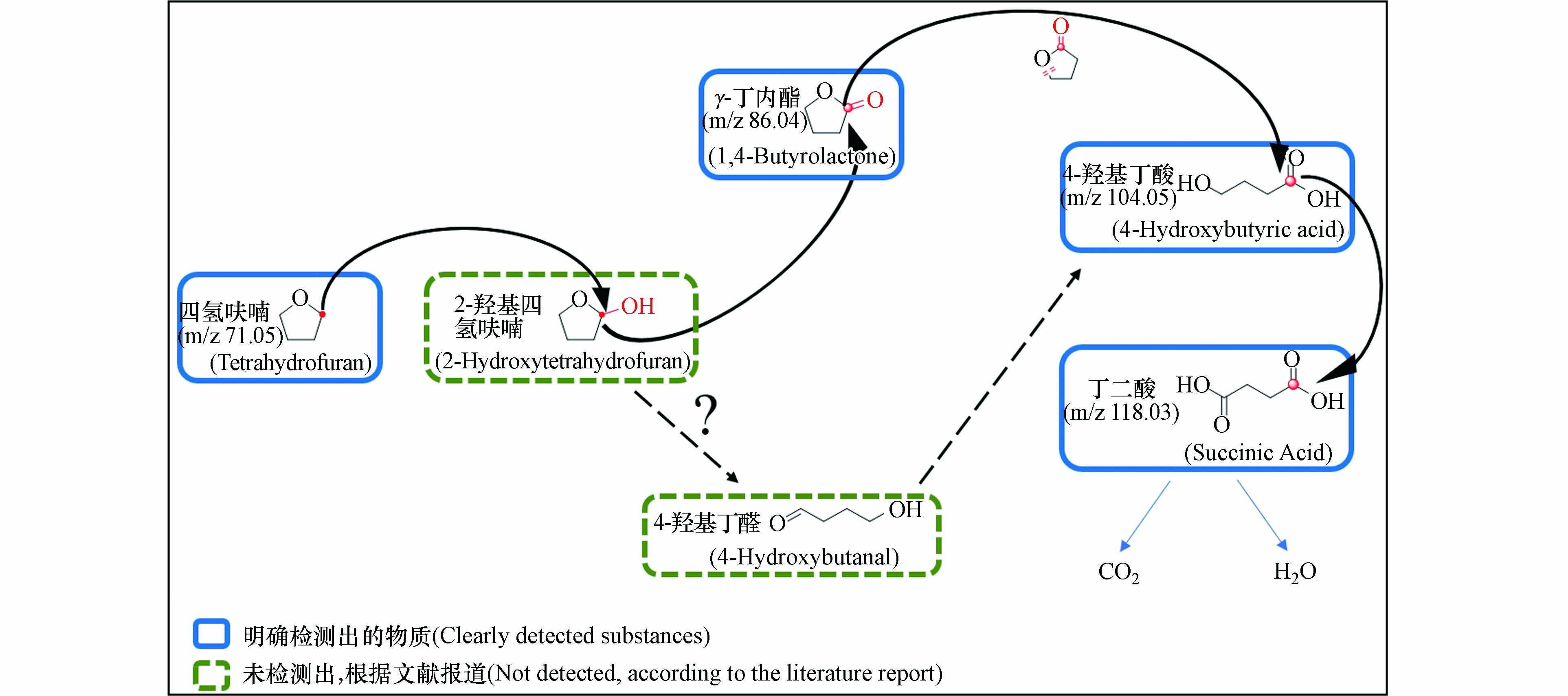
通过LC-MS分析检测了不同反应时间段溶液的成分,结果显示,THF的结构和分子特征在降解过程中发生了变化,因此基于对中间产物的检测,推测出了THF的潜在降解过程. 如图8所示,THF在·OH的强氧化作用下,发生邻位羟基化,从而转化为2-羟基四氢呋喃;然后在羟基处发生再氧化形成酯基,继而生成γ-丁内酯(C4H6O2,m/z=86.04);之后C—O键断裂生成4-羟基丁酸(C4H8O3,m/z=104.05),或者2-羟基四氢呋喃也可能会首先生成异构体4-羟基丁醛,再经氧化生成4-羟基丁酸,再经最后一步氧化生成丁二酸(C4H6O4,m/z=118.03)[25]. 然而,在检测过程中,可能是保留时间太短,并没有检测到2-羟基四氢呋喃以及4-羟基丁醛,但根据相关文献报道,推测THF在降解过程中可能有这两种物质的存在[26].
此外,通过Gaussian 09W软件在b3lyp/6-31+G(d,p)理论水平上进行了THF的几何优化计算,并使用了基于自然键轨道(NBO)分析的电子自旋密度;计算了福井指数(f 0),并根据该数值验证自由基攻击THF分子的区域选择性. 自由基总是倾向攻击f 0值较高的反应位点[27],从表1THF中原子对f 0值的贡献来看,显然,H9、H7、H6、H8通过计算被确定为相对活跃的点,其f 0值分别为0.02281、0.0228、0.02069、0.02069. 因此,本文提出,自由基会首先攻击图9中的H9位点,即THF经邻位羟基化生成2-羟基四氢呋喃,这与上述LC-MS分析中得出的结果一致,印证了该推测的正确性. DFT计算的加入可协助解释THF在MIL-53(Fe)/UV/H2O2体系中的确切降解路径.
-
通过测定降解前后THF溶液在120 h内的总耗氧量,以评价MIL-53(Fe)/UV/H2O2体系对THF溶液毒性的去除能力. 如图10(a)所示,降解前后溶液的总耗氧量曲线分别位于所设定空白(即内源呼吸)耗氧量曲线的上方和下方,这表明THF原溶液对微生物的活动有抑制作用,可生化性差,而降解后的溶液可生化性得到显著提升. 此外,以总耗氧量曲线的一阶拟合曲线斜率作为120 h内的平均OUR值可分析出:降解后溶液(0.37 mg·L−1·h−1)>内源呼吸(0.173 mg·L−1·h−1)>降解前溶液(0.107 mg·L−1·h−1),同样证明溶液的生化性得到提高. 此外,还测定了溶液反应前后的BOD5以及COD,得到了BOD5/COD(简称为B/C)的值. 如图10(b)所示,反应前的B/C为0.23(<0.3),生化性差,而反应后的B/C达到0.76(>0.3),生化性好. AOS和COS分别代表高级氧化态以及碳氧化态,可用于间接表示THF降解前后溶液的生物可降解性水平,其计算公式如下所示[28]:
其中,CODt和TOCt分别代表t时刻溶液的化学需氧量以及总有机碳的值,TOC0代表溶液初始总有机碳的值,单位均为mg·L−1. THF溶液初始的AOS和COS均为−3.436,这表明溶液中有还原性有机物. 而降解后,AOS和COS的值分别为2.726和3.609. 两种指标由负值向正值的转变说明溶液中的THF被分解成了更小的有机中间产物,由此间接证明了溶液生物降解性能的提升[29].
-
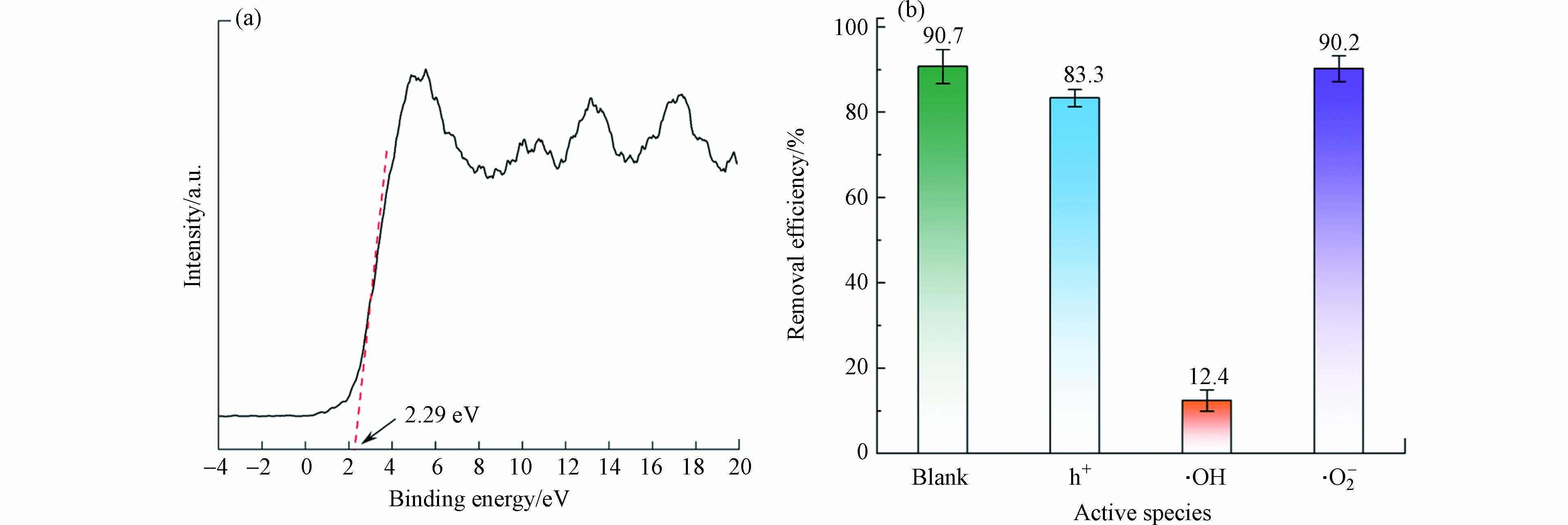
为探究MIL-53(Fe)大幅提升UV/H2O2体系降解THF效率的机理,测定了MIL-53(Fe)的能带位置. 如图11(a)所示,MIL-53(Fe)的VB位置约为2.29 eV(vs. Fermi),其对应的NHE位置利用以下公式计算:EVB,NHE=φ+EVB,XPS−4.44[30],φ代表测试仪器的功函数(4.52 eV). 由此,计算出MIL-53(Fe)的EVB,NHE为2.37 eV,略低于OH−/·OH的氧化电位(2.38 eV vs. NHE),而根据公式Eg=EVB−ECB可计算出MIL-53(Fe)的ECB,NHE为−0.21 eV,高于O2/·O2−的还原电位(-0.33 eV vs. NHE). 因此从理论上,MIL-53(Fe)在体系中没有足够产生·OH和·O2−的能力. 为验证上述结论,设计了3组平行活性物种淬灭实验. 首先是·O2−,反应前向体系中加入0.2 g·L−1的抗坏血酸,结果如图11(b)所示. 可以看到在60 min内THF的降解率几乎无变化,这表明体系中并没有·O2−产生,印证了上述的理论分析. 对于h+,在反应前向体系中加入0.2 g·L−1的EDTA-2Na,如图11(b)所示,降解率减少了约7%,这表明体系中有少量h+参与降解THF. 而在加入1.36 g·L−1异丙醇后,降解率降至12.4%,这表明·OH是THF降解过程中最重要的活性物质;其次,根据图5(a),单纯UV和UV/MIL-53(Fe)体系在60 min内的去除率几乎一致,表明单纯MIL-53(Fe)在体系中并不能产生可破坏THF结构的·OH,印证了前述理论分析. 而体系中的·OH主要来源于H2O2的分解[16],MIL-53(Fe)的加入显然加速了此过程.
以上的理论分析及实验结果证明了·OH是MIL-53(Fe)/UV/H2O2体系降解THF过程中最重要的活性物质,且MIL-53(Fe)本身在体系中无法产生·O2-和·OH. 但对于材料中含有的Fe3+是否参与反应以及体系中是否存在游离态光生e−及是否参与反应仍不了解. 因此,设置了Fe3+以及光生e−的蒙蔽实验以进行探究.
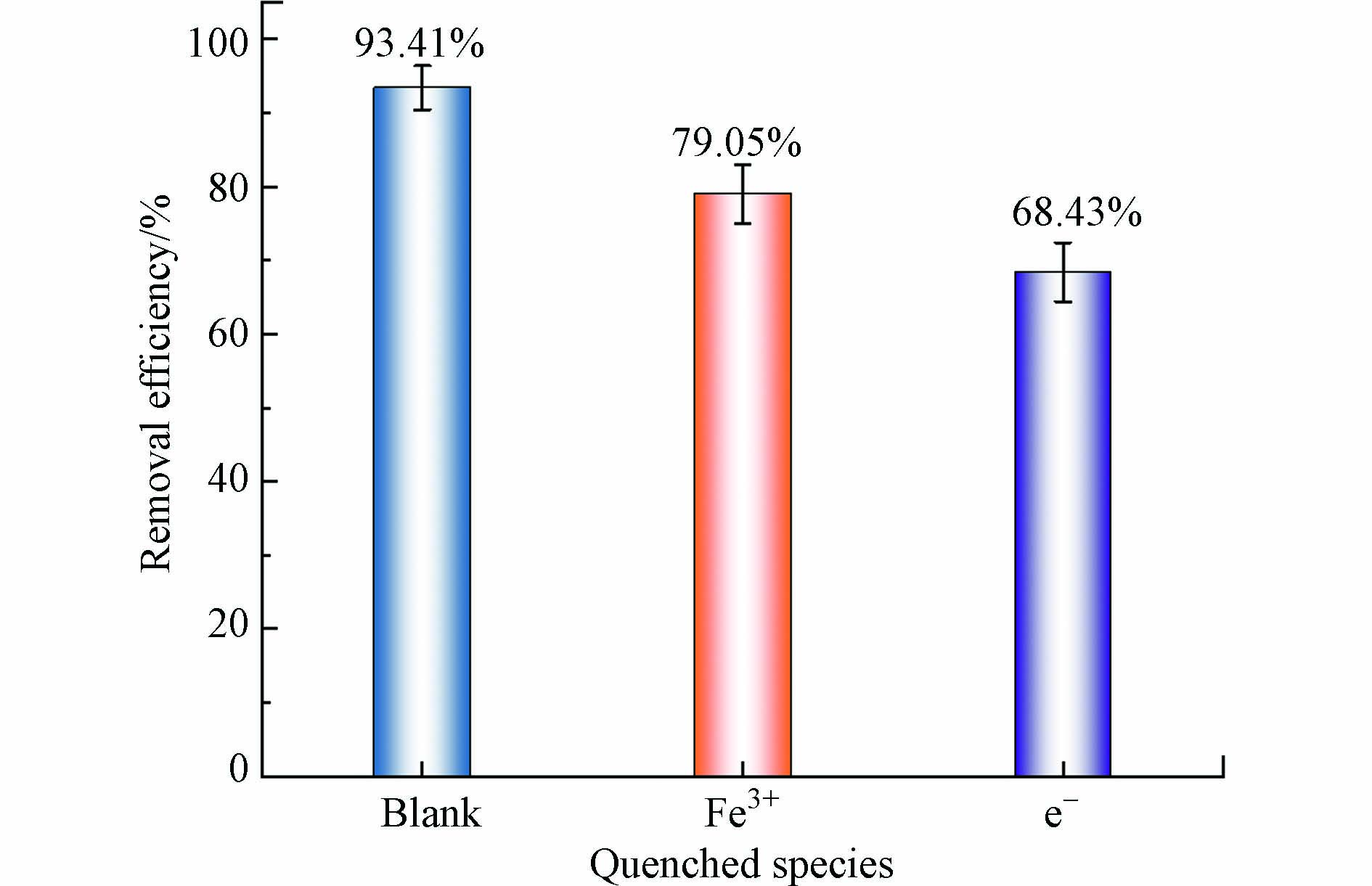
研究利用K3PO4和AgNO3分别消除体系中的Fe3+和e−,具体操作如下. 在THF光催化降解实验前,分别向两组相同体系中投加浓度为0.2 mmol·L−1的K3PO4和AgNO3,以60 min内的THF去除率为标准评价Fe3+以及光生e−的具体影响. 如图12所示,体系中K3PO4的加入使THF降解率从93.41%降至79.05%,这表明Fe3+参与了THF的降解,并可能在体系中经过LMCT形成了Fe3+/Fe2+的转化过程;同样的,AgNO3的投加使THF去除率从93.41%降至68.43%,这一结果甚至低于UV/H2O2在相同时间内的去除率(74.05%),表明体系中e−的缺失THF的去除效率影响最大,即光生e−是THF降解过程中最重要的物质. 此外,AgNO3抑制了THF的降解,这可能是NO3−吸收紫外光的作用以及对H2O2的光照分解造成了影响. 总之,MIL-53(Fe)向体系中引入的Fe3+及产生的e−在THF降解过程中均有贡献,促进了降解效率的提升,且e−将H2O2作为受体,直接提升了H2O2的分解效率.
综上所述,提升THF降解效率的根本原因在于:一方面是MIL-53(Fe)向体系中引入了h+,直接作用于THF促进降解;另一方面,也是最重要的一点,在紫外光的照射下,MIL-53(Fe)向体系中引入e−并被H2O2捕获,以活化H2O2的方式加速其消耗,提高了·OH的产生效率,进而大幅提升降解效率. 此外,MIL-53(Fe)在体系中提供了Fe3+,而Fe3+经过LMCT过程会转化为Fe2+,由于THF溶液为弱酸性,可形成光芬顿,同样可促进降解[31].
MIL-53(Fe)/UV/H2O2体系降解THF的机理可概括为如下.
-
(1) MIL-53(Fe)/UV/H2O2体系在pH≈6.8(原水),MIL-53(Fe)浓度为0.1 g·L−1,H2O2投加量为20 mmol·L−1时,降解效果最佳,在50 min内达到了94.7%,效率为UV/H2O2体系的2.4倍,且MIL-53(Fe)/UV/H2O2体系的准一阶降解动力学常数(0.0487)远大于UV/H2O2和UV/MIL-53(Fe)体系的总和(0.0244).
(2)分析降解前后溶液OUR值得到:降解后溶液(0.37 mg·L−1·h−1)>内源呼吸(0.173 mg·L−1·h−1)>降解前溶液(0.107 mg·L−1·h−1);且降解前后的B/C比分别为0.23和0.76;AOS和COS值也从降解前的负值(−3.436)转变为降解后的正值(2.726和3.609). 3种指标都表明降解前后THF溶液的可生化水平由弱变强.
(3) MIL-53(Fe)强化UV/H2O2体系高效降解THF的机理主要在于:MIL-53(Fe)受到光的激发产生光生e−,而e−直接将H2O2作为受体,加速其分解同时产生·OH,从而大幅提升反应速率.
(4) MIL-53(Fe)对UV/H2O2体系的提升显著,且表现出一定的循环使用性,但若应用于实际含THF废水的处理中,仍需改进. 因此后续需针对该方面继续展开研究. 但不可否认的是,通过以Fe基MOFs材料MIL-53(Fe)活化H2O2的方式构建异相光催化/芬顿体系为THF废水处理提供了良好的思路.
基于MIL-53(Fe)构建异相UV/H2O2活化体系高效降解水中四氢呋喃
Efficient degradation of tetrahydrofuran in water by constructing heterogeneous H2O2 activation system based on Fe-based MOFs
-
摘要: 为克服均相光-芬顿体系中pH范围窄、H2O2活化效率低、Fe2+无法循环使用等缺陷,制备了Fe基MOFs材料MIL-53(Fe)以构建异相H2O2高效活化体系,并通过XRD、XPS以及UV-vis等表征,以探究MIL-53(Fe)/UV/H2O2体系去除THF的性能及机理等. 降解实验结果表明MIL-53(Fe)/UV/H2O2体系相比于UV/H2O2,降解效率提升了2.4倍,其准一阶降解速率常数(0.0487 min−1)是UV/H2O2体系(0.0205 min−1)的2.375倍,并在pH≈6.8(原水),H2O2添加量为20 mmol·L−1,MIL-53(Fe)投加量为0.1 g·L−1时,降解效果最佳,50 min达到了94.7%;通过LC-MS分析确定了中间产物,提出了可能的THF降解途径,并利用Gaussian软件通过DFT计算作了验证;从OUR、BOD5/COD、AOS(高级氧化态)、COS(碳氧化态)4方面证明了降解前后溶液可生化性由弱到强的提升;结合活性物种淬灭实验、Fe3+、e−蒙蔽实验以及价导带分析提出了潜在的THF降解机理,验证出·OH是THF降解过程中最重要的活性物种,而光生e−是反应速率提升的主要驱动者.
-
关键词:
- 四氢呋喃 /
- MIL-53(Fe) /
- 光催化 /
- 可生化性 /
- 降解机理.
Abstract: To overcome the defects of narrow pH range, low activation efficiency of H2O2 and non-recyclability of Fe2+ in homogeneous photo-fenton system, the Fe-based MOFs material MIL-53(Fe) was prepared to construct a heterogeneous and efficient H2O2 activation system, and characterized by XRD, XPS and UV-vis diffuse reflection to investigate the performance and mechanism of THF removal by MIL-53(Fe)/UV/H2O2 system. The degradation experiments results showed that the degradation efficiency of MIL-53(Fe)/UV/H2O2 system was 2.4 times higher than that of UV/H2O2, and its pseudo-first-order degradation rate constant (0.0487 min−1) was 2.375 times higher than that of UV/H2O2 system (0.0205 min−1), the best degradation efficiency was achieved at pH ≈ 6.8 (raw water), H2O2 addition of 20 mmol·L−1 and MIL-53(Fe) dosing of 0.1 g·L−1, reaching 94.7% within 50 minutes; the intermediate products were identified by LC-MS analysis and a possible THF degradation pathway was proposed and verified by DFT calculation using Gaussian software; the biodegradability of the solution was improved from weak to strong before and after degradation was demonstrated in four aspects: OUR, BOD5/COD, AOS(Advanced Oxidation State) and COS(Carbon Oxidation State); combined with the active species quenching experiment, blinding experiment of Fe3+, e− and the valence/conduction band analysis, the potential THF degradation mechanism was proposed, which verified that ·OH was the most important active species in the THF degradation process, and photogenerated e− was the main driver of the increasment of reaction rate.-
Key words:
- tetrahydrofuran /
- MIL-53(Fe) /
- photocatalysis /
- biodegradability /
- degradation mechanism.
-

-
表 1 不同电子状态下THF的Natural Population Analysis(NPA)电荷分布和计算的福井指数(f0)水平
Table 1. Natural Population Analysis (NPA) charge distribution on THF at different electron state and calculated Fukui index (f 0) levels
原子
Atom序号
NumqN qN-1 qN+1 f0 H 9 0.23199 0.14474 0.09913 0.02281 H 7 0.23194 0.14471 0.09911 0.0228 H 6 0.21536 0.13471 0.09333 0.02069 H 8 0.21531 0.13469 0.09331 0.02069 H 10 0.25302 0.1543 0.11408 0.02011 H 13 0.25303 0.15429 0.11409 0.0201 H 11 0.24262 0.13957 0.10681 0.01638 H 12 0.24262 0.13956 0.10681 0.016375 C 4 −0.50911 −0.26359 −0.21837 −0.02261 C 5 −0.50914 −0.26359 −0.21836 −0.02262 C 3 −0.14226 −0.095 −0.04248 −0.02626 C 1 −0.14227 −0.09501 −0.04248 −0.02627 O 2 −0.5831 −0.42938 −0.30498 −0.0622 -
[1] 马香娟. 杂环化合物的电化学氧化行为与降解机理[D]. 杭州: 浙江大学, 2013. MA X J. Electrochemical oxidation behavior and degradation mechanism of heterocyclic compounds[D]. Hangzhou: Zhejiang University, 2013(in Chinese).
[2] 姚燕来. 四氢呋喃的微生物降解研究[D]. 杭州: 浙江大学, 2009. YAO Y L. Study on microbial degradation of tetrahydrofuran[D]. Hangzhou: Zhejiang University, 2009 (in Chinese).
[3] RAMOS M D N, SANTANA C S, VELLOSO C C V, et al. A review on the treatment of textile industry effluents through Fenton processes [J]. Process Safety and Environmental Protection, 2021, 155: 366-386. doi: 10.1016/j.psep.2021.09.029 [4] LI S, SHAN S, CHEN S, et al. Photocatalytic degradation of hazardous organic pollutants in water by Fe-MOFs and their composites: A review [J]. Journal of Environmental Chemical Engineering, 2021, 9(5): 105967. doi: 10.1016/j.jece.2021.105967 [5] LI L, ZHU W, ZHANG P, et al. UV/O3-BAC process for removing organic pollutants in secondary effluents [J]. Desalination, 2007, 207(1): 114-124. [6] GANIYU S O, ZHOU M, MARTÍNEZ-HUITLE C A. Heterogeneous electro-Fenton and photoelectro-Fenton processes: A critical review of fundamental principles and application for water/wastewater treatment [J]. Applied Catalysis B: Environmental, 2018, 235: 103-129. doi: 10.1016/j.apcatb.2018.04.044 [7] ZHANG X, YUAN N, LI Y, et al. Fabrication of new MIL-53(Fe)@TiO2 visible-light responsive adsorptive photocatalysts for efficient elimination of tetracycline [J]. Chemical Engineering Journal, 2022, 428: 131077. doi: 10.1016/j.cej.2021.131077 [8] WANG C, LIU X, KESER DEMIR N, et al. Applications of water stable metal–organic frameworks [J]. Chemical Society Reviews, 2016, 45(18): 5107-5134. doi: 10.1039/C6CS00362A [9] NGUYEN Q K, KUZ’MICHEVA G M, KHRAMOV E V, et al. Design of Metal-Organic Polymers MIL-53(M3+): Preparation and Characterization of MIL-53(Fe) and Graphene Oxide Composite [J] Crystals, 2021, 11(11): 1281. [10] WU Q, YANG H, KANG L, et al. Fe-based metal-organic frameworks as Fenton-like catalysts for highly efficient degradation of tetracycline hydrochloride over a wide pH range: Acceleration of Fe(II)/ Fe(III) cycle under visible light irradiation [J]. Applied Catalysis B: Environmental, 2020, 263: 118282. doi: 10.1016/j.apcatb.2019.118282 [11] DU X, YI X, WANG P, et al. Enhanced photocatalytic Cr(VI) reduction and diclofenac sodium degradation under simulated sunlight irradiation over MIL-100(Fe)/g-C3N4 heterojunctions [J]. Chinese Journal of Catalysis, 2019, 40(1): 70-79. doi: 10.1016/S1872-2067(18)63160-2 [12] JIANG Y, YANG Q-M, XU Q-J, et al. Metal organic framework MIL-53(Fe) as an efficient artificial oxidase for colorimetric detection of cellular biothiols [J]. Analytical Biochemistry, 2019, 577: 82-88. doi: 10.1016/j.ab.2019.04.020 [13] XIANG Q, YU Z, WANG P, et al. Construction of Z-scheme N-doped BiFeO3/NH2-MIL-53(Fe) with the synergy of hydrogen peroxide and visible-light-driven photo-Fenton degradation of organic contaminants [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2022, 654: 130112. doi: 10.1016/j.colsurfa.2022.130112 [14] ABDPOUR S, KOWSARI E, MOGHADDAM M R A. Synthesis of MIL-100(Fe)@MIL-53(Fe) as a novel hybrid photocatalyst and evaluation photocatalytic and photoelectrochemical performance under visible light irradiation [J]. Journal of Solid State Chemistry, 2018, 262: 172-180. doi: 10.1016/j.jssc.2018.03.018 [15] ZHANG C, AI L, JIANG J. Graphene Hybridized Photoactive Iron Terephthalate with Enhanced Photocatalytic Activity for the Degradation of Rhodamine B under Visible Light [J]. Industrial & Engineering Chemistry Research, 2015, 54(1): 153-163. [16] AI L, ZHANG C, LI L, et al. Iron terephthalate metal–organic framework: Revealing the effective activation of hydrogen peroxide for the degradation of organic dye under visible light irradiation [J]. Applied Catalysis B: Environmental, 2014, 148-149: 191-200. doi: 10.1016/j.apcatb.2013.10.056 [17] BANERJEE A, GOKHALE R, BHATNAGAR S, et al. MOF derived porous carbon–Fe3O4 nanocomposite as a high performance, recyclable environmental superadsorbent [J]. Journal of Materials Chemistry, 2012, 22(37): 19694-19699. doi: 10.1039/c2jm33798c [18] ZHANG Y, ZHOU J, CHEN J, et al. Rapid degradation of tetracycline hydrochloride by heterogeneous photocatalysis coupling persulfate oxidation with MIL-53(Fe) under visible light irradiation [J]. Journal of Hazardous Materials, 2020, 392: 122315. doi: 10.1016/j.jhazmat.2020.122315 [19] DU P D, HOAI P N. Synthesis of MIL-53(Fe) Metal-Organic Framework Material and Its Application as a Catalyst for Fenton-Type Oxidation of Organic Pollutants [J]. Advances in Materials Science and Engineering, 2021, 2021: 1-13. [20] YANG T Y, YU D Y, WANG D, et al. Accelerating Fe(III)/Fe(II) cycle via Fe(II) substitution for enhancing Fenton-like performance of Fe-MOFs [J]. Applied Catalysis B-Environmental, 2021, 286:119859. [21] ZHANG Z, CHEN X, TAN Y, et al. Preparation of millimeter-scale MIL-53(Fe)@polyethersulfone balls to optimize photo-Fenton process [J]. Chemical Engineering Journal, 2022, 441: 135881. doi: 10.1016/j.cej.2022.135881 [22] LONG J, WANG S, DING Z, et al. Amine-functionalized zirconium metal–organic framework as efficient visible-light photocatalyst for aerobic organic transformations [J]. Chemical Communications, 2012, 48(95): 11656-11658. doi: 10.1039/c2cc34620f [23] ZHANG S, ZHAO X, NIU H, et al. Superparamagnetic Fe3O4 nanoparticles as catalysts for the catalytic oxidation of phenolic and aniline compounds [J]. Journal of Hazardous Materials, 2009, 167(1): 560-566. [24] CHEN Q, WU P, LI Y, et al. Heterogeneous photo-Fenton photodegradation of reactive brilliant orange X-GN over iron-pillared montmorillonite under visible irradiation [J]. Journal of Hazardous Materials, 2009, 168(2): 901-908. [25] BERNHARDT D, DIEKMANN H. Degradation of dioxane, tetrahydrofuran and other cyclic ethers by an environmental Rhodococcus strain [J]. Applied Microbiology and Biotechnology, 1991, 36(1): 120-123. doi: 10.1007/BF00164711 [26] SKINNER K, CUIFFETTI L, HYMAN M. Metabolism and Cometabolism of Cyclic Ethers by a Filamentous Fungus, a Graphium sp [J]. Applied and Environmental Microbiology, 2009, 75(17): 5514-5522. doi: 10.1128/AEM.00078-09 [27] SHI J, ZHANG B, WANG W, et al. In situ produced hydrogen peroxide by biosynthesized Palladium nanoparticles and natural clay mineral for Highly-efficient Carbamazepine degradation [J]. Chemical Engineering Journal, 2021, 426: 131567. doi: 10.1016/j.cej.2021.131567 [28] MORADI M, GHANBARI F. Application of response surface method for coagulation process in leachate treatment as pretreatment for Fenton process: Biodegradability improvement [J]. Journal of Water Process Engineering, 2014, 4: 67-73. doi: 10.1016/j.jwpe.2014.09.002 [29] PATIDAR R, SRIVASTAVA V C. Ultrasound-Induced Intensification of Electrochemical Treatment of Bulk Drug Pharmaceutical Wastewater [J]. ACS ES&T Water, 2021, 1(8): 1941-1954. [30] LI X, KANG B, DONG F, et al. Enhanced photocatalytic degradation and H2/H2O2 production performance of S-pCN/WO2.72 S-scheme heterojunction with appropriate surface oxygen vacancies [J]. Nano Energy, 2021, 81: 105671. doi: 10.1016/j.nanoen.2020.105671 [31] TOYAO T, SAITO M, HORIUCHI Y, et al. Efficient hydrogen production and photocatalytic reduction of nitrobenzene over a visible-light-responsive metal-organic framework photocatalyst [J]. Catalysis Science & Technology, 2013, 3(8): 2092-2097. -




 下载:
下载: