-
砷是自然界中常见的有毒类金属元素. 亚砷酸盐(As(Ⅲ))和砷酸盐(As(V))是无机砷的两种重要的氧化态,且As(Ⅲ)的毒性是As(V)的60倍[1 − 2]. 因此,为了防止砷污染对人体健康造成危害,1993年世界卫生组织(WHO)将饮用水中砷的浓度限值由50 μg·L−1降低至10 μg·L−1[3].
吸附/氧化法除As(Ⅲ)是最有前景的砷去除方法之一[4 − 6]. 这主要是由于As(Ⅲ)的迁移性强,对金属氧化物亲和力弱. 相反,As(V)对金属氧化物亲和力较强[7 − 8]. 因此,As(Ⅲ)氧化为As(V)后,再利用吸附剂高效吸附As(V)是去除As(Ⅲ)的有效途径. 天然含铁锰矿同时具备吸附和氧化特性,被认为是一种高效、绿色的砷去除剂[9 − 10]. Chakravarty等[11]采用廉价含铁锰矿去除地下水中的砷,结果发现天然含铁锰矿具有良好的砷去除效果. Eleonora Deschamps等采用含有Fe、Mn的天然矿物作为反应实验柱的填充材料去除砷污染的水体,结果发现其砷吸附容量高达14.7 mg·g−1[12]. 但是,由于形成条件复杂,天然含铁锰矿成分存在较大差异[13],对砷的去除效果也明显不同. 然而,目前有关不同成分天然含铁锰矿对砷去除的效果和机制的研究少见报道.
本研究选取不同Fe/Mn比例的天然含铁锰矿为研究对象,采用等温吸附实验评估其对砷的吸附容量,同时探究粒径、溶液pH、共存离子等对砷吸附性能的影响. 实验结合XRD、XPS、SEM等表征手段,探究不同天然含铁锰矿的除砷机制. 本研究探讨不同种类天然含铁锰矿的除砷效果和机制,为砷污染修复材料的选择提供理论依据.
-
实验中使用的化学试剂磷有酸二氢钠(NaH2PO4)、氯化钙(CaCl2)、碳酸氢钠(NaHCO3)、碳酸钠(Na2CO3)、硫酸钾(K2SO4)、硝酸钠(NaNO3)、氢氧化钠(NaOH)、盐酸(HCl)、三氧化二砷(As2O3)均为分析纯试剂,购自于国药化学试剂有限公司. As(Ⅲ)储备液采用
1000 mg·L−1 分析纯As2O3制备而成. 实验中所有水溶液均使用18.25 MΩ·cm的超纯水配制.两种天然含铁锰矿均采自于广西贵港木圭锰矿区,呈岩石块状,根据其Mn/Fe含量比的高低水平,分别标记为NFM-L和NFM-H. 矿石块经水洗、自然风干后,使用球磨机研磨成20目、60目、100目和300目的粉末样,密封备用.
-
分别称取20目、60目、100目、300目NFM-L和NFM-H粉末样品0.15 g于50 mL离心管中,加入15 mL、240 mg·L−1 (pH为7.0)的As(Ⅲ)溶液;在25 ℃、180 r·min−1条件下,连续震荡24 h,实验重复3次. 反应结束后,采用0.22 μm滤膜快速过滤悬浮液,上清液经原子荧光光谱仪测定溶液中砷浓度,并根据公式(1)和公式(2)计算砷去除率与吸附容量.
式中,W为砷去除率,%;C0为砷初始浓度,mg·L−1;C1为反应后上清液中砷浓度,mg·L−1;Qe为砷吸附容量,mg·L−1;V为反应液体积,L;m为吸附剂质量,g.
-
称取0.15 g、100目的矿物材料(NFM-L或NFM-H)于50 mL离心管中. 加入15 mL、240 mg·L−1不同pH (pH分别设置为1、3、5、7、9、11、13)的As(Ⅲ)溶液. 将离心管密封后,置于25 ℃、180 r·min−1恒温振荡器中连续振荡24 h,实验重复3次. 反应结束后,采用0.22 μm滤膜快速过滤悬浮液,上清液经原子荧光光谱仪测定溶液中砷浓度,并根据公式(1)和公式(2)计算砷去除率与吸附容量.
-
称取0.15 g、100目的矿物粉末(NFM-L和NFM-H)于50 mL离心管中,分别加入15 mL不同浓度的As(Ⅲ)溶液(pH为7.0). 密封离心管,放置于25 ℃、180 r·min−1恒温振荡器中连续振荡24 h. 反应结束后,迅速将悬浮液离心过滤,保留上清液,使用原子荧光光谱仪(AFS,型号为AFS-
8220 ,北京吉天仪器有限公司)测定其砷含量. As(Ⅲ)浓度分别设置为10、20、40、80、160、240、400、800 mg·L−1,实验重复3次. 并采用公式(1)和公式(2)分别计算砷去除率、吸附容量.实验数据采用Freundlich模型和Langmuir模型进行拟合,Freundlich模型描述的是非均匀吸附表面在非理想条件下的吸附[14],表达式为:
式中,C为吸附平衡时溶液中重金属的浓度,mg·L−1;
$ {K}_{\mathrm{f}} $ 与n是经验常数,其中$ {K}_{\mathrm{f}} $ 是与吸附性能相关的参数,n是反应键能经验常数.Langmuir吸附等温模型的假设基础是:吸附位点均匀分布且吸附能力无差异,吸附过程为单分子层的物理或化学吸附[15],表达式为:
式中,
$ {Q}_{\mathrm{m}} $ 为最大吸附量,mg·g−1;$ {K}_{\mathrm{L}} $ 是Langmuir常数. -
称取0.15 g、100目的矿物粉末(NFM-L或NFM-H)于50 mL离心管中,然后加入15 mL、240 mg·L−1(pH为7.0)的As(Ⅲ)溶液. 将离心管密封放置于25 ℃、180 r·min−1的恒温振荡器中连续振荡不同时间(10 min、30 min、1 h、2 h、4 h、8 h、12 h、16 h和24 h),反应到设定时间后快速离心过滤,保留上清液,采用原子荧光光谱仪测定溶液中砷浓度,实验重复3次. 根据公式(1)和(2)计算砷的去除率与吸附容量. 通过准一级动力学模型和伪二级动力学模型[16]拟合吸附数据. 准一级动力学方程为:
该方程可以线性化为:
伪二级动力学被广泛用于描述吸附剂对As(Ⅲ)的吸附行为,它假定吸附容量与吸附剂上的活性未占据位点的数量呈正比[17]. 伪二级动力学方程可以表示为:
式中,qt为时间t时吸附在吸附剂上的As(Ⅲ)的量,mg∙g−1;K1为准一级动力学As(Ⅲ)吸附的速率常数,min−1;K2为伪二级动力学As(Ⅲ)吸附的速率常数,g∙mg−1∙min−1.
-
考虑到实际砷污染水体中,往往是多种离子共存的复杂环境. 因此,选取了环境中典型的几种离子(Ca2+、H2PO4−、SO42−和CO32−),考察其对NFM-L和NFM-H除砷的影响. 实验步骤如下:称取0.15 g、100目矿物粉末(NFM-L或NFM-H)于50 mL离心管中,加入15 mL、20 mg·L−1 (pH 7.0)的As(Ⅲ)溶液,As(Ⅲ)溶液中分别添加0、25、50、100 mg·L−1的Ca2+、H2PO4−、SO42−和CO32−离子. 随后,将离心管密封放置于25 ℃、180 r·min−1恒温振荡器中连续振荡24 h,实验重复3次. 反应结束后,采用0.22 μm滤膜快速过滤悬浮液,上清液经原子荧光光谱仪测定溶液中的砷浓度,并根据公式(1)和公式(2)计算砷去除率与吸附容量.
-
为了评估材料的吸附性能,采用吸附/解吸实验观察材料的固砷能力. 吸附实验:分别称取0.15 g、100目的矿物材料(NFM-L或NFM-H)于50 mL离心管中. 加入15 mL、240 mg·L−1(pH 7.0)的As(Ⅲ)溶液,砷溶液中含有浓度为0.01 mol·L−1背景离子NO3−. 离心管密封后,将其放置于25 ℃、180 r·min−1恒温振荡器中连续振荡24 h. 反应结束后,快速离心、过滤,保留上清液,实验重复3次. 最后,采用经原子荧光光谱仪测定吸附液中砷浓度,记为C1.
解吸实验:将上述吸附实验固体用饱和NaCl溶液清洗两次后,将固体沉淀放置于50 mL离心管中. 向离心管中分别加入15 mL、0.1 mol·L−1 NaOH、0.5 mol·L−1 NaHCO3或0.1 mol·L−1 NaCl溶液. 在25 ℃,180 r·min−1恒温振荡器中振荡解吸24 h. 解吸结束后,采用0.22 μm滤膜快速过滤悬浮液,保留解吸液. 解吸液经原子荧光光谱仪测定溶液中砷浓度,记为C2,并根据公式(9)计算砷解吸率:
式中,W1为砷解吸率,%;C2为固体上砷解吸后溶液中的砷浓度,mg·L−1.
-
采用X射线衍射仪(XRD)分析矿物材料的组成,测试条件为:Cu Kα辐射,管压40 kV,管电流20 mA,扫描速度为10(°)·min−1,步长0.02°;采用傅里叶变换红外光谱(FTIR)分析材料与砷反应前后表面官能团的变化;采用扫描电子显微镜(SEM)观察改性前后天然含铁锰矿的表面形貌差异;采用X射线光电子能谱(XPS)分析材料反应前后元素价态变化,测试条件为:Al靶,真空2×10−7 Pa,XPS图谱用Avantage软件进行多峰拟合分离重叠峰,采用C1s作为电荷校正标准;采用比表面积测试仪测试材料的比表面积;电荷零点采用Zeta电位仪测试. 采用王水法消解NFM-L和NFM-H矿物样品,使用ICP-MS测定其各类元素含量. 矿物含水率测定采用烘干法. 首先,将玻璃器皿清洗干净后放置于鼓风干燥箱中烘干. 烘干后,称其质量,m1;称取一定量的矿物粉末(NFM-L或NFM-H)于玻璃器皿中,质量m2;将玻璃器皿和矿物粉末一起放置于105 ℃干燥箱中烘干,至质量恒定不变为止. 最后,将玻璃器皿和矿物粉末放置在室温下冷却后称重,质量记为m3,并根据公式(10)计算矿物粉末含水率W2:
式中,W2为含水率,%;m1为玻璃器皿干重,g;m2为矿物粉末鲜重,g;m3为玻璃器皿和矿物粉末的干重,g.
-
两种材料的元素含量分析如表1所示. 结果表明,NFM-L和NFM-H中除含Fe、Mn元素外,还含有大量其它元素,特别是Al、Si等元素. 这是由于在自然条件下,天然含铁锰矿形成条件复杂导致的. NFM-L中Fe、Mn含量分别为6.45%、45.7%,Mn/Fe为7.09. 然而,NFM-H中Fe、Mn含量分别为1.15%、32.9%,Mn/Fe为28.62. 相比NFM-L,NFM-H为高锰含铁锰矿. 但是,NFM-L和NFM-H的pH区别不大,均在7左右,分别为7.12和7.54;同时,NFM-L和NFM-H的电荷零点差异也较小,分别为6.60和7.36,且含水率分别为1.92%和0.31%,NFM-L略大. 然而,NFM-L(20.14 m2·g−1)的比表面积远大于NFM-H(2.45 m2·g−1),是其8.22倍(表2).
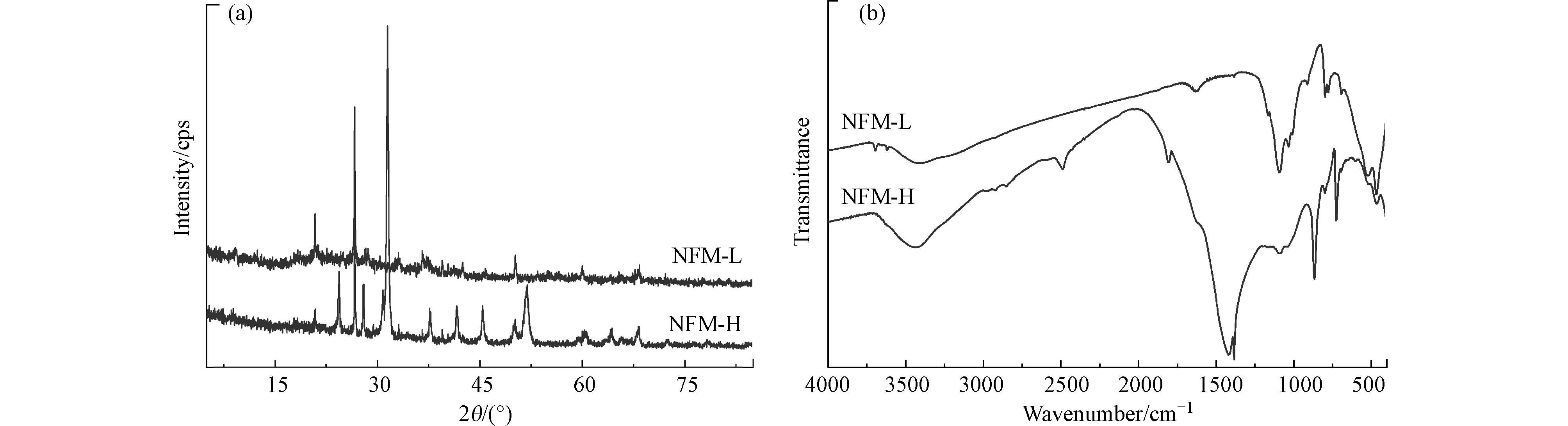
通过对NFM-L和NFM-H进行XRD分析发现,NFM-L和NFM-H均含有软锰矿(19°、28°和37°),磁铁矿(19°、36°),赤铁矿(27°、31°、33°、36°、55°),褐铁矿(21°、35°),铁锰复合氧化物(33°—37°、42°),粒硅锰矿,正长石和白云母等. 另外,NFM-H还含有菱锰矿(MnCO3)和菱铁矿(Ca0.1Mg0.33Fe0.57CO3)的特征峰吸收峰(图1a). 由于天然含铁锰矿组成复杂、杂质较多,虽然判定出其中所含物质种类,但由于各种物质含量少且元素掺杂,不能直接进行矿物晶体结构分析. 如图1b为NFM-L和NFM-H的FTIR图谱,结果发现NFM-L和NFM-H图谱峰型区别不大. 650—500 cm−1为Fe—O的特征吸收峰位置[18],Mn—O键的吸收峰位置出现在436、517、555、624、642、764 cm−1[19 − 20],表明NFM-L和NFM-H中存在铁氧化物和锰氧化物物相,与XRD结果一致.
1095 —1091 cm−1和1100 cm−1处的特征吸收峰为Si—O—Si官能团的振动吸收带[21];3600 —3000 cm−1和1650 —1600 cm−1处的特征吸收峰为水的伸缩及弯曲振动吸收带[22],宽而大的峰型表明NFM-L和NFM-H表面含有大量羟基;—CO3基团的伸缩振动峰在1500 —1340 cm−1,弯曲振动峰出现在900 —700 cm−1. -
图2为NFM-L和NFM-H除As(Ⅲ)的等温吸附曲线. 结果表明,NFM-L (24.82 mg·g−1)的As(Ⅲ)吸附容量明显优于NFM-H (18.94 mg·g−1),NFM-L是NFM-H的1.31倍,表明锰含量高的天然含铁锰矿的As(Ⅲ)去除能力不一定更强. 虽然NFM-H的Mn/Fe高于NFM-L,但是NFM-L(6.45%)中实际Fe含量高于NFM-H(1.15%). 据报道,铁氧化物对砷具有强的吸附能力[23]. 因此,这可能是由于在Mn充足的条件下,Fe含量高的天然含铁锰矿的As(Ⅲ)能力可能更强.
根据Freundlich和Langmuir模型对NFM-L和NFM-H的As(Ⅲ)吸附数据进行拟合发现,NFM-L和NFM-H更符合Freundlich模型,R2大于0.95;而对Langmuir模型拟合效果较差,表明天然含铁锰矿的除As(Ⅲ)过程不是单纯的单层吸附模型,可能还存在化学吸附过程[24 − 25](表3). 这可能是由于天然含铁锰矿成分复杂,除铁氧化物和锰氧化物具备除As(Ⅲ)能力外,其他杂质对As(Ⅲ)仍具有不同程度的去除性能.
-
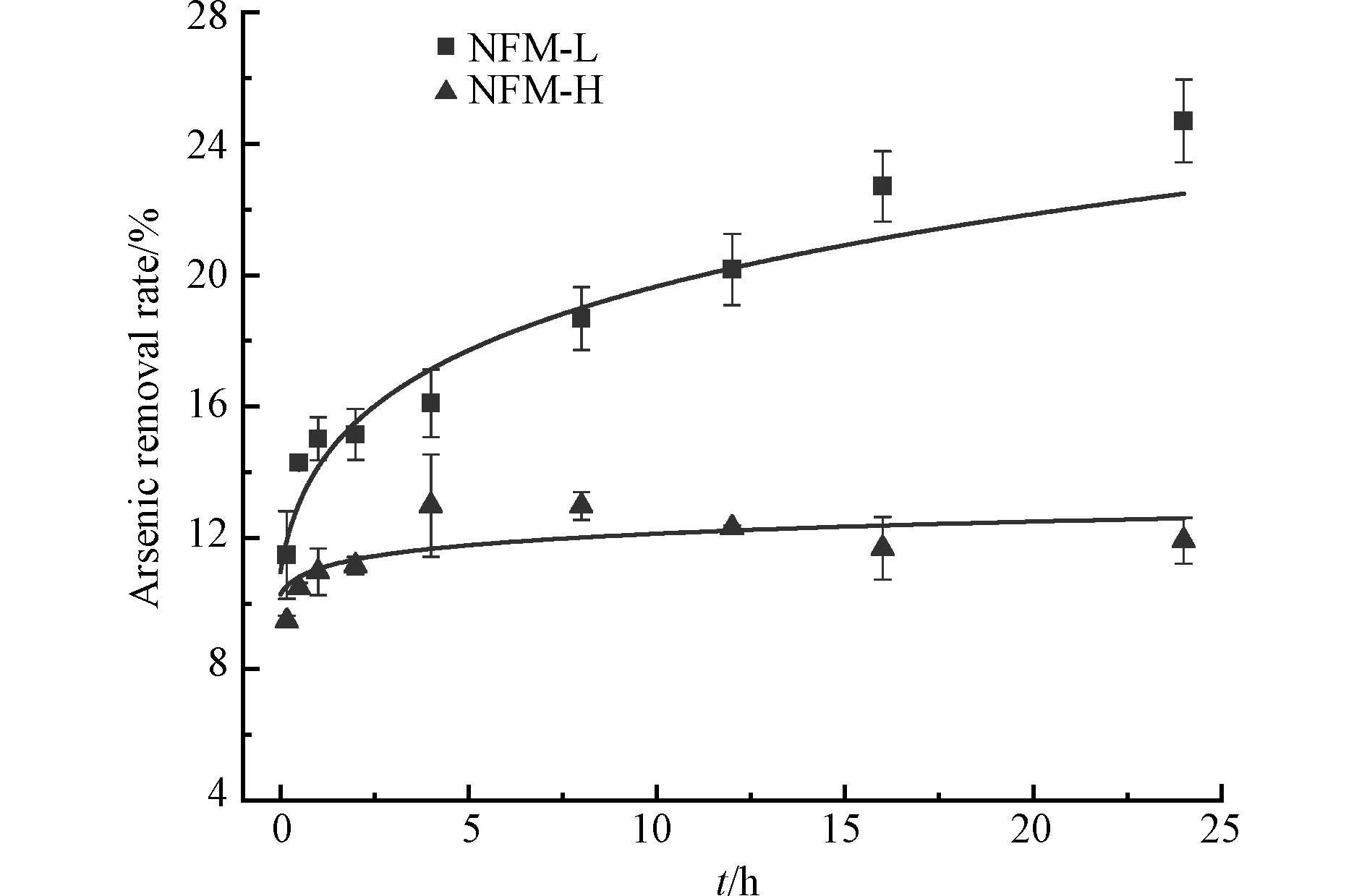
图3为NFM-L和NFM-H在不同反应时间下的As(Ⅲ)去除率,结果表明,低Mn/Fe的NFM-L的砷吸附容量和速率明显优于高Mn/Fe的NFM-H. 在反应0—4 h时,溶液中砷浓度快速降低,NFM-L和NFM-H对As(Ⅲ)的去除率分别为16.10%、12.98%,NFM-L对As(Ⅲ)的去除效率明显高于NFM-H;当反应时间为12 h时,NFM-L和NFM-H对As(Ⅲ)的去除率依次为20.18%、12.31%;而反应12 h后体系基本趋于平衡. NFM-L的吸附速率明显高于NFM-H,这可能是由于锰氧化物将As(Ⅲ)氧化为As(V)后,增加了铁氧化物对砷的吸附亲和力,导致铁含量居多的NFM-L对砷的吸附性能更优.
-
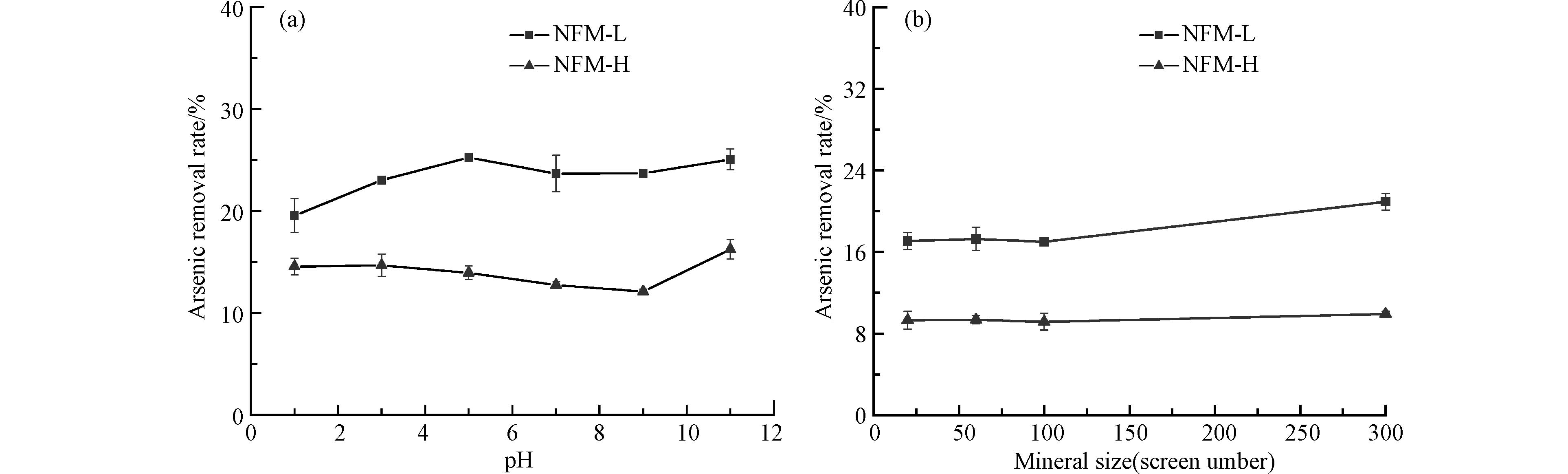
图4(a)为溶液不同pH值对NFM-L和NFM-H除砷的影响. 结果表明,相比NFM-H,溶液pH对NFM-L除As(Ⅲ)的影响较大. 当溶液pH由1增加至5时,NFM-L的As(Ⅲ)去除率逐渐增加,从19.55%增大至25.25%;当pH持续增大时,NFM-L的砷去除率呈现先减小后增加的趋势. 然而,当pH在0—9之间时,随着溶液pH的增加,NFM-H的As(Ⅲ)去除率逐渐降低(由14.53%减少至12.09%),降低2.44%;当溶液pH为11时As(Ⅲ)去除率最高,为16.23%. 虽然,NFM-L和NFM-H的电荷零点相近,但是不同pH环境下的As(Ⅲ)去除效应并不完全相似. 这可能是由于NFM-L和NFM-H中杂质不完全相同导致的.
-
图4(b)为不同粒径的NFM-L和NFM-H对As(Ⅲ)的吸附效果. 结果表明,本实验条件下,材料粒径对NFM-L和NFM-H的As(Ⅲ)去除率影响不大. 当粒径在100目以内时,NFM-L的As(Ⅲ)去除率(17%)相近;粒径增大至300目时,其As(Ⅲ)去除率仅有略微的增加,由17%增大至20.9%. 然而,粒径从20目增大到300目时,对NFM-H的As(Ⅲ)去除率无明显影响,As(Ⅲ)去除率均接近9%左右.
-
图5为不同浓度的典型共存离子(Ca2+、H2PO4−、SO42−和CO32−)对NFM-L和NFM-H除As(Ⅲ)的影响. 结果表明,H2PO4−对NFM-L和NFM-H除As(Ⅲ)的影响最大,其次是CO32−,而Ca2+和SO42−的影响较小. 当H2PO4−浓度从0增加至100 mg·L−1时,NFM-L和NFM-H的As(Ⅲ)去除率依次降低,分别由43.4%减少至23.2%,14.8%减少至5.20%;这可能是由于H2PO4−和砷为同族元素,且具有相似的四面体结构,能与砷激烈的竞争NFM-L和NFM-H表面吸附位点[18]. 然而,当CO32−浓度从0增加至100 mg·L−1时,NFM-L和NFM-H的As(Ⅲ)去除率也呈现逐渐减少的现象,且分别减少18.8% (43.4%降低至24.6%)和5.75%(14.8%降低至9.05%);这是因为CO32−不仅能竞争矿物表面的吸附位点,而且容易在矿物表面形成碳酸盐类复合物,从而影响矿物对砷的吸附. Appelo等[26]发现, CO32−能占据水铁矿表面70%的吸附位点,显著减少了砷在水铁矿表面的吸附.
-
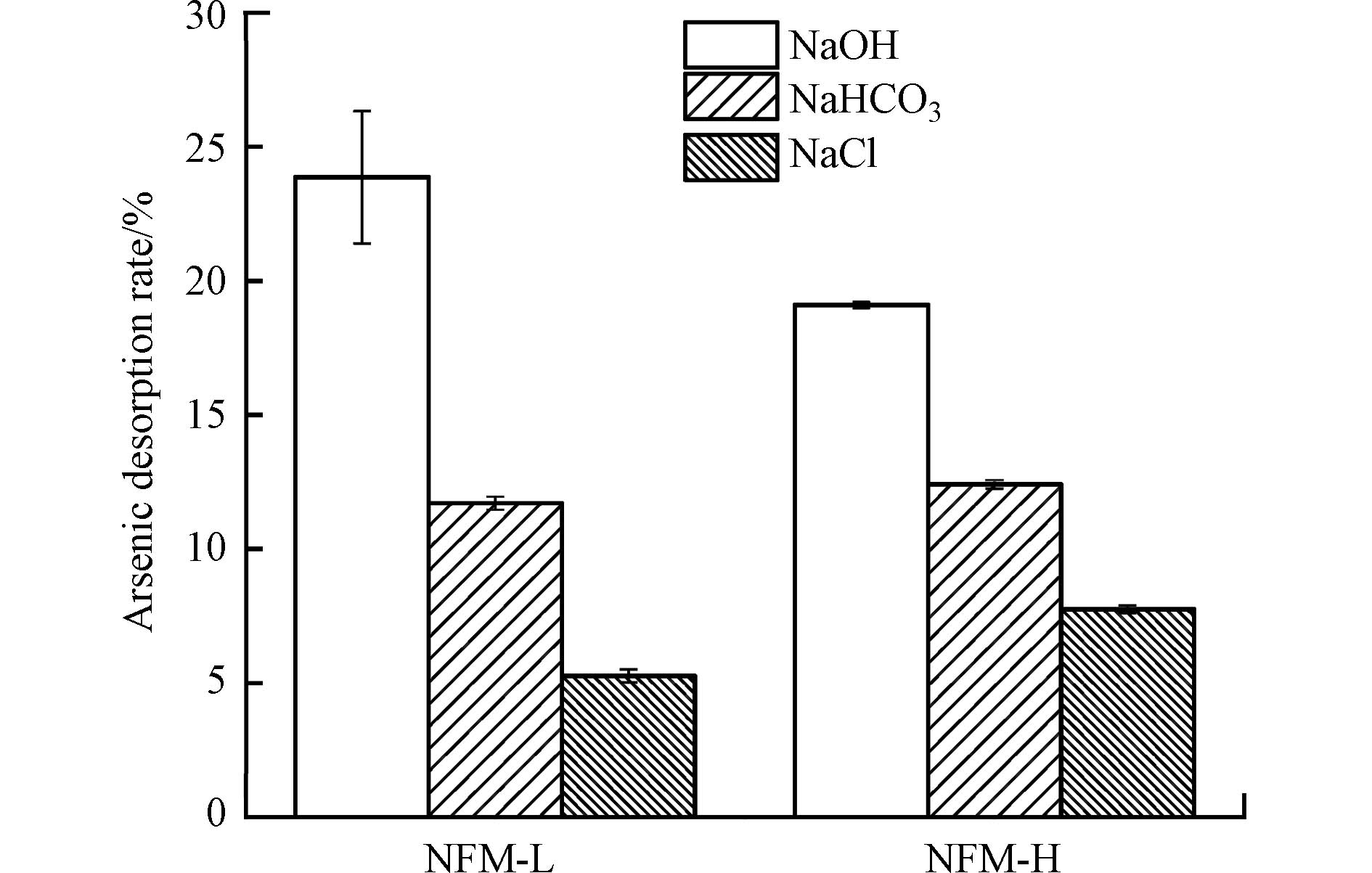
研究了3种典型解吸剂(NaOH、NaHCO3和NaCl)对材料NFM-L和NFM-H吸附砷后的解吸效果(图6). 结果表明,NaOH对NFM-L和NFM-H的解吸效果最好,其次是NaHCO3,NaCl最差. 在吸附实验中,NFM-L和NFM-H对As(Ⅲ)的吸附率分别为48.3%、33.1%. 当解吸剂为NaOH时,NFM-L和NFM-H的As(Ⅲ)解吸率分别为23.9%、19.1%,即NFM-L和NFM-H表面分别有49.5%、57.7%的砷被解吸到溶液中,表明NaOH对高锰的NFM-H解吸效果强于低锰的NFM-L. 这是由于NaOH不仅改变了反应体的pH环境,使得As(Ⅲ)在溶液中的存在形态发生变化,同时大量的OH−离子能与矿物表面砷产生竞争效应. 因此,最终导致了大量的砷从矿物表面解吸到溶液中. 然而,当解吸剂为NaHCO3时,NFM-L和NFM-H的As(Ⅲ)解吸率分别为11.7%、12.4%,由此可见NaHCO3解吸能力明显低于NaOH;当解吸剂为NaCl时,对NFM-L和NFM-H表面砷物种的解吸效果最差,仅有5.27%和7.75%.
-
图7(a)为NFM-L和NFM-H与As(Ⅲ)反应前后的XRD图谱. 结果表明,NFM-L和NFM-H中主要含有软锰矿(19°、28°和37°),磁铁矿(19°、36°),赤铁矿(27°、31°、33°、36°、55°),褐铁矿(21°、35°),铁锰复合氧化物(33°—37°、42°). 与As(Ⅲ)反应后,NFM-L的19°、21°、27°、37°处的吸收峰强度明显增强,但是并无新的吸收峰产生;而NFM-H峰型在反应前后,并未发现明显变化. 这可能是由于As(Ⅲ)浓度偏低,与NFM-L和NFM-H反应后难以在其表面生成结晶强度较高的砷化合物. 同时,对NFM-L和NFM-H与As(Ⅲ)反应前后进行FTIR分析发现,吸附砷后NFM-L和NFM-H的FTIR峰型并未发生明显变化(图7(b)). 但是,与As(Ⅲ)反应后,
1629 cm−1 (Fe(OH)3中羟基的弯曲振动)特征吸收峰的峰强明显增大,同时1383 cm−1 (NO3−和As—O伸缩振动)处特征吸收峰的峰强也明显增大. -
图8为NFM-L和NFM-H与As(Ⅲ)反应前后的SEM. 结果表明,与As(Ⅲ)反应前后,NFM-L和NFM-H表面形貌并未发生明显变化,无新产物生成. 图8(a)所示,NFM-L颗粒表面粗糙,比表面积较大;但吸附As(Ⅲ)后单位面积内的固体颗粒数明显增多(图8(c)). 而NFM-H表面光滑、为不规则块状(图8(b)),在吸附As(Ⅲ)后NFM-H表面出现更多微小的不规则块状(图8(d)).
-
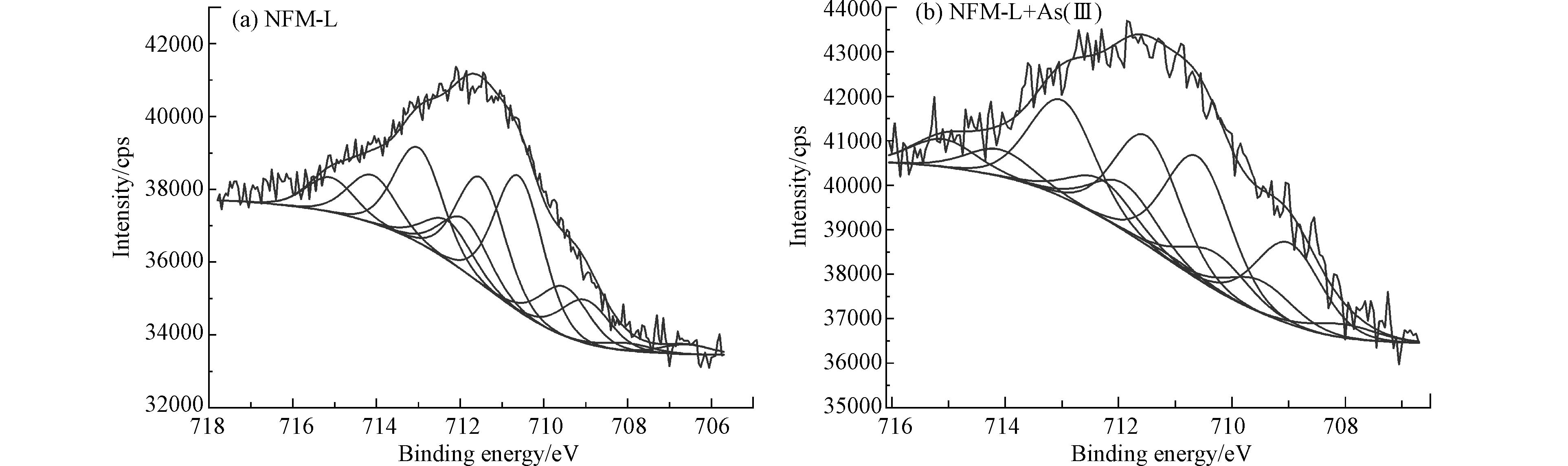
采用XPS分析NFM-L和NFM-H与As(Ⅲ)反应前后的Fe、Mn和As元素价态,如图9 − 11. 图9和图10为NFM-L和NFM-H与As(Ⅲ)反应前后的Fe2p、Mn2p拟合图谱,结果表明,由于高锰的NFM-H中Fe含量过低,XPS无法精准测试,导致Fe2p轨道峰型杂乱,不具备分析价值. 但是,低锰的NFM-L中Fe含量占比6.45%,是NFM-H的5.6倍,Fe2p峰型完整,无杂峰. 如图9所示,NFM-L与As(Ⅲ)反应后,Fe(Ⅱ)占比由53.61%增加至57.13%,而Fe(Ⅲ)占比由44.84%减少至42.87%(表4). 如图10可知,NFM-H中高价锰(Mn(Ⅲ)和Mn(Ⅳ))含量明显高于低锰的NFM-L,表明NFM-H的As(Ⅲ)氧化能力强于NFM-L. 同时,NFM-L和NFM-H与As(Ⅲ)反应后,Mn(Ⅲ)和Mn(Ⅳ)明显减少,Mn(Ⅱ)显著增加(图10). 其中,Mn(Ⅲ)分别减少3.34%、4.0%;Mn(Ⅳ)分别减少3.14%、11.35%;而Mn(Ⅱ)分别增加6.48%、15.35% (表4). 这可能是由于高价锰(Mn(Ⅲ)和Mn(Ⅳ))氧化As(Ⅲ)为As(V)后,自身将还原为低级锰(Mn(Ⅱ)).
图11为NFM-L和NFM-H与As(Ⅲ)反应后As3d拟合图谱. 结果表明,NFM-L和NFM-H对As(Ⅲ)存在明显的氧化作用(图11). 当NFM-L去除As(Ⅲ)时,54.27%的As(Ⅲ)被氧化为As(V)(表4);而NFM-H去除As(Ⅲ)时,67.17%的As(Ⅲ)被氧化为As(V)(表4). 表明NFM-H氧化能力明显优于NFM-L.
-
(1) 天然含铁锰矿主要含有Fe、Mn元素,NFM-L和NFM-H均含有较高浓度的Mn,但是NFM-L的Fe含量是NFM-H的5.61倍. 由于天然含铁锰矿形成条件复杂,同时也含有其他杂质,其主要杂质为Si和Al元素;
(2) NFM-L和NFM-H对As(Ⅲ)的吸附更符合Freundlich模型,且NFM-L的As(Ⅲ)吸附容量明显高于NFM-H. 相比NFM-H,溶液pH值对NFM-L去除As(Ⅲ)的影响更大,共存离子H2PO4−能够明显抑制As(Ⅲ)去除效果,而粒径对两种材料的As(Ⅲ)去除率影响不大;
(3) XPS结果表明,NFM-L和NFM-H去除As(Ⅲ)后检测到了As(V)的存在,且NFM-H氧化As(Ⅲ)的能力明显优于NFM-L,这可能是由于NFM-H的锰含量高于NFM-L导致的. 由此证明天然含铁锰矿除砷过程中,由于NFM-L和NFM-H包含的锰氧化物能将As(Ⅲ)氧化为As(V),从而促进铁氧化物对砷的去除效果.
不同Mn/Fe比例天然含铁锰矿的As(Ⅲ)吸附性能与机制
As(Ⅲ) adsorption performance and mechanisms of natural Fe-bearing manganese ores with different Mn/Fe ratios
-
摘要: 水体中的砷主要以亚砷酸(As(Ⅲ))形态存在. 金属氧化物常用于水体砷的去除,但其对As(Ⅲ)的亲和力较弱,导致水体砷很难去除,因此,寻求高效、廉价、绿色的除As(Ⅲ)材料具有显著的环境意义. 天然含铁锰矿是一种高效的砷吸附剂,由于自然形成条件复杂,其不同含铁锰矿对As(Ⅲ)的去除性能存在较大差异. 本研究以两种不同Mn/Fe比例的天然含铁锰矿(NFM-L、NFM-H)为研究对象,评估其对As(Ⅲ)的吸附性能,并结合XPS、XRD等光谱学表征手段探究其砷的去除机制. 实验结果表明,NFM-L的Fe含量是NFM-H的5.61倍,其As(Ⅲ)的最大吸附量(24.82 mg·g−1)与吸附速率亦显著高于NFM-H(18.94 mg·g−1),NFM-L和NFM-H对As(Ⅲ)的等温吸附曲线更符合Freundlich模型. 影响因子实验表明,溶液pH值对NFM-L的影响更大,共存离子H2PO4−能够显著抑制两种材料对As(Ⅲ)的吸附,但是材料粒径对As(Ⅲ)去除的影响较小. 光谱学表征发现,两种矿物吸附砷后结构并未发生明显变化,但锰氧化物能将As(Ⅲ)氧化为As(V),从而显著提高了铁锰矿对砷的吸附能力.Abstract: Arsenic in water is mainly present in the form of arsenite (As(Ⅲ)). Metal oxides are commonly used for arsenic removal in water, but their affinity with As(Ⅲ) is weak, making it difficult to remove arsenic from water. Therefore, seeking efficient, inexpensive, and environmentally friendly As(Ⅲ) removal materials is of great environmental significance. Natural iron-manganese-containing minerals are efficient arsenic adsorbents, but different iron-manganese-containing minerals have significantly different As(Ⅲ) removal performances due to their complex natural formation conditions. In this study, two natural iron-manganese-containing minerals with different Mn/Fe ratios (NFM-L and NFM-H) were selected as research subjects to evaluate their adsorption performances for As(Ⅲ). XPS, XRD, and other spectroscopic characterization methods were used to explore the arsenic removal mechanism. The results showed that the Fe content of NFM-L was 5.61 times that of NFM-H, and its maximum adsorption capacity for As(Ⅲ) (24.82 mg·g−1) and adsorption rate were significantly higher than that of NFM-H (18.94 mg·g−1). And the isothermal adsorption curves for As(Ⅲ) by NFM-L and NFM-H were more consistent with the Freundlich model. The influence factor experiments showed that the solution pH had a greater impact on NFM-L, and the coexisting ion H2PO4− could significantly inhibit the adsorption of As(Ⅲ) by both materials, while material particle size had a smaller effect on As(Ⅲ) removal. Spectroscopic characterization showed that the structure of the two minerals did not change significantly after arsenic adsorption, but manganese oxide could oxidize As(Ⅲ) to As(V), significantly enhancing the adsorption capacity of iron-manganese-containing minerals for arsenic. In conclusion, this study revealed the arsenic removal mechanism of natural iron-manganese-containing minerals, providing theoretical support for the exploration of efficient, inexpensive and environmentally friendly As(Ⅲ) removal materials and offering new ideas for the treatment of arsenic pollution in water environments.
-
Key words:
- natural iron manganese ore /
- As(Ⅲ) /
- Mn/Fe /
- oxidation /
- adsorption.
-

-
表 1 供试两种含铁锰矿材料的元素组成表(%)
Table 1. Elemental composition of the two tested iron-manganese-containing minerals(%)
材料
MaterialFe Mn Al Si P Ca Mg Ni NFM-L 6.4524 45.6941 7.0730 4.6240 0.6130 0.0560 0.1260 0.0240 NFM-H 1.1455 32.9149 1.6430 4.2500 0.5320 0.3390 0.3420 0.0280 材料
MaterialZn Cd Cr Ti Na K As Pb NFM-L 0.0250 0.0000 0.0040 0.0730 0.0030 0.0050 0.0060 0.0160 NFM-H 0.0370 0.0020 0.0070 0.0090 0.0030 0.0010 0.0350 0.0120 表 2 供试两种含铁锰矿材料的理化性质
Table 2. Physical and chemical properties of the two tested iron-manganese-containing minerals
材料
MaterialpH 含水率/%
Moisture content比表面积/(m2·g−1)
Specific surface area电荷零点
Point of zero chargeNFM-L 7.12 1.92 20.14 6.60 NFM-H 7.54 0.31 2.45 7.36 表 3 Freundlich模型相关拟合参数
Table 3. Freundlich model correlation fitting parameters
材料
MaterialFreundlich模型 Kf 1/n R2 NFM-L 0.0061 1.3125 0.9503 NFM-H 0.0141 1.1217 0.9848 表 4 材料与As(Ⅲ)反应前后的各元素的XPS拟合参数(%)
Table 4. XPS fitting parameters of each element before and after adsorption of As(Ⅲ) (%)
材料
MaterialFe(Ⅱ) Fe(Ⅲ) Mn(Ⅱ) Mn(Ⅲ) Mn(Ⅳ) As(Ⅲ) As(V) NFM-L 53.61 44.84 66.94 17.26 15.8 — — NFM-H — — 52.8 21.37 25.83 — — NFM-L+As(Ⅲ) 57.13 42.87 73.42 13.92 12.66 45.73 54.27 NFM-H+As(Ⅲ) — — 68.15 17.37 14.48 32.83 67.17 -
[1] SHARMA V K, SOHN M. Aquatic arsenic: Toxicity, speciation, transformations, and remediation[J]. Environment International, 2009, 35(4): 743-759. doi: 10.1016/j.envint.2009.01.005 [2] ZHAO F J, McGRATH S P, MEHARG A A. Arsenic as a food chain contaminant: Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 2010, 61: 535-559. doi: 10.1146/annurev-arplant-042809-112152 [3] SMITH A H, LOPIPERO P A, BATES M N, et al. Public health. Arsenic epidemiology and drinking water standards[J]. Science, 2002, 296(5576): 2145-2146. doi: 10.1126/science.1072896 [4] ALI I, GUPTA V K. Advances in water treatment by adsorption technology[J]. Nature Protocols, 2006, 1(6): 2661-2667. doi: 10.1038/nprot.2006.370 [5] CUONG D V, WU P C, CHEN L I, et al. Active MnO2/biochar composite for efficient As(Ⅲ) removal: Insight into the mechanisms of redox transformation and adsorption[J]. Water Research, 2021, 188: 116495. doi: 10.1016/j.watres.2020.116495 [6] WEERASUNDARA L, OK Y S, BUNDSCHUH J. Selective removal of arsenic in water: A critical review[J]. Environmental Pollution, 2021, 268: 115668. doi: 10.1016/j.envpol.2020.115668 [7] HAO L L, LIU M Z, WANG N N, et al. A critical review on arsenic removal from water using iron-based adsorbents[J]. RSC Advances, 2018, 8(69): 39545-39560. doi: 10.1039/C8RA08512A [8] LIU Z M, CHEN J T, WU Y C, et al. Synthesis of magnetic orderly mesoporous α-Fe2O3 nanocluster derived from MIL-100(Fe) for rapid and efficient arsenic(Ⅲ, V) removal[J]. Journal of Hazardous Materials, 2018, 343: 304-314. doi: 10.1016/j.jhazmat.2017.09.047 [9] CHEN D N, LI D G, XIAO Z J, et al. Removal of lead ions by two FeMn oxide substrate adsorbents[J]. Science of the Total Environment, 2021, 773: 145670. doi: 10.1016/j.scitotenv.2021.145670 [10] MA L, CAI D M, TU S X. Arsenite simultaneous sorption and oxidation by natural ferruginous Manganese ores with various ratios of Mn/Fe[J]. Chemical Engineering Journal, 2020, 382: 123040. doi: 10.1016/j.cej.2019.123040 [11] CHAKRAVARTY S, DUREJA V, BHATTACHARYYA G, et al. Removal of arsenic from groundwater using low cost ferruginous Manganese ore[J]. Water Research, 2002, 36(3): 625-632. doi: 10.1016/S0043-1354(01)00234-2 [12] DESCHAMPS E, CIMINELLI V S T, HÖLL W H. Removal of As(Ⅲ) and As(V) from water using a natural Fe and Mn enriched sample[J]. Water Research, 2005, 39(20): 5212-5220. doi: 10.1016/j.watres.2005.10.007 [13] LIU B B, ZHANG Y B, LU M M, et al. Extraction and separation of manganese and iron from ferruginous Manganese ores: A review[J]. Minerals Engineering, 2019, 131: 286-303. doi: 10.1016/j.mineng.2018.11.016 [14] WANG J L, GUO X. Adsorption isotherm models: Classification, physical meaning, application and solving method[J]. Chemosphere, 2020, 258: 127279. doi: 10.1016/j.chemosphere.2020.127279 [15] AL-GHOUTI M A, DA'ANA D A. Guidelines for the use and interpretation of adsorption isotherm models: A review[J]. Journal of Hazardous Materials, 2020, 393: 122383. doi: 10.1016/j.jhazmat.2020.122383 [16] HO Y S, McKAY G. Sorption of dye from aqueous solution by peat[J]. Chemical Engineering Journal, 1998, 70(2): 115-124. doi: 10.1016/S0923-0467(98)00076-1 [17] CAI G Y, TIAN Y, LI D K, et al. Self-enhanced and efficient removal of As(Ⅲ) from water using Fe-Cu-Mn composite oxide under visible-light irradiation: Synergistic oxidation and mechanisms[J]. Journal of Hazardous Materials, 2022, 422: 126908. doi: 10.1016/j.jhazmat.2021.126908 [18] ZHANG G S, LIU H J, LIU R P, et al. Adsorption behavior and mechanism of arsenate at Fe-Mn binary oxide/water interface[J]. Journal of Hazardous Materials, 2009, 168(2/3): 820-825. [19] ZHENG Q, TU S X, HOU J T, et al. Insights into the underlying mechanisms of stability working for As(Ⅲ) removal by Fe-Mn binary oxide as a highly efficient adsorbent[J]. Water Research, 2021, 203: 117558. doi: 10.1016/j.watres.2021.117558 [20] HOU J T, LUO J L, SONG S X, et al. The remarkable effect of the coexisting arsenite and arsenate species ratios on arsenic removal by Manganese oxide[J]. Chemical Engineering Journal, 2017, 315: 159-166. doi: 10.1016/j.cej.2016.12.115 [21] HAHN A, VOGEL H, ANDÓ S, et al. Using Fourier transform infrared spectroscopy to determine mineral phases in sediments[J]. Sedimentary Geology, 2018, 375: 27-35. doi: 10.1016/j.sedgeo.2018.03.010 [22] BAI Y, TANG X J, SUN L Y, et al. Application of iron-based materials for removal of antimony and arsenic from water: Sorption properties and mechanism insights[J]. Chemical Engineering Journal, 2022, 431: 134143. doi: 10.1016/j.cej.2021.134143 [23] ZHANG G S, QU J H, LIU H J, et al. Removal mechanism of As(Ⅲ) by a novel Fe-Mn binary oxide adsorbent: Oxidation and sorption[J]. Environmental Science & Technology, 2007, 41(13): 4613-4619. [24] RAWAT A P, KUMAR V, SINGH P, et al. Kinetic behavior and mechanism of arsenate adsorption by loam and sandy loam soil[J]. Soil and Sediment Contamination:an International Journal, 2022, 31(1): 15-39. doi: 10.1080/15320383.2021.1900071 [25] WANG J B, XU J, XIA J, et al. A kinetic study of concurrent arsenic adsorption and phosphorus release during sediment resuspension[J]. Chemical Geology, 2018, 495: 67-75. doi: 10.1016/j.chemgeo.2018.08.003 [26] APPELO C A J, van der WEIDEN M J J, TOURNASSAT C, et al. Surface complexation of ferrous iron and carbonate on ferrihydrite and the mobilization of arsenic[J]. Environmental Science & Technology, 2002, 36(14): 3096-3103. -



 下载:
下载: