-
量子点(quantum dots,QDs)作为新型纳米材料,在基因组学,蛋白质组学和高通量筛选等研究中均有很好的应用前景[1-3],同时在半导体产业和光电子器件方面影响巨大,目前部分产业如量子点电视已量化生产且投放市场[4]。随着量子点生产和应用规模不断扩大,大量QDs在生产和应用过程中被释放到环境中,对环境和人体健康造成不利影响,但其生态健康风险及相关环境行为并未完全探明。
硒化镉量子点(CdSe QDs)比较稳定、不易降解[1],具有致癌性。研究发现,QDs可通过皮肤和黏膜被动物和人体吸收,对人成纤维上皮细胞和皮肤细胞均表现出一定的毒性效应[5-6]。对斑马鱼胚胎的暴露研究发现,QDs影响斑马鱼胚胎的形态发育、氧化应激和应激蛋白的基因表达[7]。铜绿假单胞细菌(Pseudomonas aeruginosa)中积累的硒化镉量子点可通过食物链传递到其捕食者原生动物——嗜热四膜虫(Tetrahymena thermophila)中,并存在生物放大现象[8],还有研究显示在量子点保护性外层包被的存在下,随食物链的转移使初级消费者的摄入量增加,从而造成更高营养水平生物的暴露和损伤的风险增加[9]。对拟南芥进行硒化镉量子点暴露研究,虽没有观察到硒化镉量子点的内化,但观察到植物体产生了明显的氧化应激反应[10]。
Klaine等[11]认为纳米材料在土壤和水生态系统中的环境行为研究十分重要,特别需要开展纳米材料对于这些生态系统中栖息的生物效应的研究。小球藻作为水生态系统的初级生产者,外源污染物对它的影响会直接影响食物链的物质传递和能量传递,进而影响高营养级生物[12],因此,以小球藻为代表的藻类微生物,其种群发展对整个生态系统的平衡和稳定具有重要影响[13]。另外,小球藻对外源污染物较为敏感,是生态毒理学研究中的重要模式生物[14-15],常被用于评估环境污染物毒性、水环境安全等[16-17],在纳米材料[13, 17-23]、抗生素[12]、重金属[14]、有机污染物[24]等的毒性研究中都有广泛应用。
本研究重点关注了硒化镉量子点与普通小球藻(Chlorella vulgaris)的相互作用,研究硒化镉量子点在环境中的迁移转化,揭示其对水生微生物的毒性效应,阐释潜在生态环境与健康风险。
-
硒化镉量子点CdSe(ZnS-CA QDs)购于苏州星烁纳米科技有限公司,光致发光波长(photoluminescence emission,简写PL Emission)为621 nm,半峰全宽(Full width at half maximum,简写FWHM)为24 nm,荧光量子产率(quantum yield,简写QY)为45%。标准样品保存于4 ℃黑暗条件。
普通小球藻Chlorella vulgaris(FACHB-8),购于中科院水生生物研究所淡水藻种库,培养于灭菌的BG11培养基中。小球藻的培养和暴露均在光照恒温箱(PAX-1000C,中国)内进行,条件设置为:光照强度22000 LX下照射16 h,温度约为28 ℃,黑暗8 h,温度约为25 ℃,每天人工振荡若干次。
-
移取适量普通小球藻置于250 mL锥形瓶内,使用流式细胞仪测定细胞个数[25]并保证小球藻的初始生物量为2.5×105 cell·mL−1,在小球藻溶液中加入适量量子点材料后用BG11培养基定容至150 mL。量子点暴露浓度设置为:0(阴性对照组,含有小球藻,不含量子点)、0.2、1、5、10、20 nmol·L−1,每个浓度组设置3个平行(n=3)。另准备以超纯水配置的各实验浓度的量子点溶液(不含有小球藻,只含有量子点)和既不含藻也不含量子点的超纯水分别作空白组1(n=3)和空白组2(n=3),这两个空白组均被用于酶标仪空白的测定,结果显示这两组空白对照的酶标仪测定结果无显著差异,所以后续分析中直接以纯水用于酶标仪空白值的测定,并在细胞数测定中对测定值进行扣除空白处理。暴露组和对照组均培养于光照培养箱内,在暴露的各时间点对暴露体系和阴性对照组进行取样分析,分别测定培养基中总Cd浓度、细胞数和各生化指标、并用显微镜观察细胞形态。由于设置的暴露浓度中,较低的暴露浓度组(0.2 nmol·L−1和1 nmol·L−1)与较高的暴露浓度组(5、10、20 nmol·L−1)结果存在较大差异,因此后面的讨论中将0.2 nmol·L−1和1 nmol·L−1浓度组称为低浓度组,将5、10、20 nmol·L−1的浓度组称为高浓度组。
-
在暴露的第1、2、4 d对培养基中Cd浓度进行取样测定,并在低浓度组实验中为了进一步观察短时间内的暴露效应变化,增加了4 h这一取样时间点。取样后过滤去除藻细胞,测定经过藻细胞吸收/吸附、代谢量子点后培养基溶液中剩余的量子点含量,具体操作如下:用注射器吸取2 mL暴露瓶中的藻液,经0.2 µm PES滤膜针头过滤器进行过滤,收集滤液于10 mL离心管,加入0.5 mL浓硝酸后用超纯水稀释定容至10 mL。最终稀释Cd浓度至500 µg·g−1以下,用电感耦合等离子体质谱仪(ICP-MS,Agilent 8800,USA)测定Cd的浓度。
-
在暴露后6 h和1、2、4 d对细胞数进行取样测定。不同浓度(即细胞数不同)藻液各取200 µL,用流式细胞仪慢速测定其单位体积细胞数。用酶标仪(Thermo Scientific,VARIOSKAN FLASH)测量这些小球藻液在680 nm处的光密度值[26],以去除空白后的光密度为x轴,以单位体积细胞数为y轴作图,得到单位体积细胞数和光密度的标准曲线线性方程为:
$ y=234.72x+3.2782 $ ($ R² = 0.9901 $ ),据此可以计算暴露过程中暴露组和对照组中的藻细胞数变化。具体操作为:按时间间隔对暴露体系和对照组进行取样,测定藻液样品在680 nm处的光密度值,扣除空白后代入以上标准曲线得到细胞数。 -
在暴露后4 h和1、2、4 d对各生化指标进行取样测定。根据Yu等[27]和Liu等[28]的方法,使用荧光素二乙酸盐(fluorescein diacetate,FDA)、碘化丙啶(propidium iodide,PI)、罗丹明123(rhodamine 123,Rh123)、2',7'-二氯荧光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate,H2DCFDA)分别对普通小球藻进行染色,避光孵育后测定其荧光信号,可分别反映小球藻细胞酯酶活性、细胞膜完整性、线粒体膜电位、细胞内活性氧(ROS)含量。具体操作为:取1 mL藻液,加入适量染色试剂(工作溶液1 mmol·L−1),室温铝箔纸包裹避光孵育一定时间后,进行离心(4500 r·min−1,10 min),弃去上清液,收集的藻细胞中加入1 mL磷酸缓冲盐溶液(phosphate buffer saline,PBS),重悬浮后再次离心(4500 r·min−1,10 min),弃去上清液。加入200 µL PBS重悬浮后用流式细胞仪(ACCURI C6,BD,USA)检测对应通道的荧光值(表1)。各染色剂用量、避光孵育时间和对应荧光通道如表1所示。叶绿素的测量无需添加外源染色试剂,样品经过两次离心清洗、重悬浮即可用流式细胞仪检测FL3通道的荧光值。
应用流式细胞仪测定染色后藻细胞的荧光响应,采用中速进样方式,采集10000个细胞信号,得到旁散射(SSC)-前散射(FSC)图,其中SSC可反映细胞/颗粒的内部复杂程度,FSC可反映细胞/颗粒的体积大小。以SSC和FSC为依据,确定其中符合活细胞特征的信号,分析其对应通道的荧光强度。以相对荧光强度(无量纲)表示指标测试水平。
-
通过光学显微镜,对小球藻细胞形态进行观察:直接吸取暴露4 d后的藻液滴到载玻片上,在400倍的放大倍数下进行观察。
-
本研究中所有数据呈现为平均值±标准偏差,暴露组和阴性对照组之间数据差异的显著性用SPSS软件的单因素方差分析进行统计分析。其中*表示P<0.05,具有显著差异;**表示P<0.01,具有极显著差异。
-
小球藻暴露QDs后,藻细胞的生长和增殖均会受到一定的影响,对于小球藻细胞增殖的变化可以用比生长速率(μ)进行评估,其计算公式如下[29]:
其中,Nx表示暴露x时刻的细胞数,Ny表示暴露y时刻的细胞数,tn表示从暴露x时刻到y时刻的天数。
为避免在没有QDs干扰的生长条件下,小球藻细胞正常增殖过程对于QDs效应评估的影响,利用阴性对照组(0 nmol·L−1)的平均比生长速率对QDs暴露组的比生长速率进行了归一化处理,得到相对比生长速率(μ,无量纲),公式如下:
利用上述公式计算得到量子点暴露各时间段内(6 h至1 d、1至2 d、2 d至4 d)小球藻的相对比生长速率。如图1所示,6 h至1 d、1至2 d、2 d至4 d的3个时间段内,除了0.2 nmol·L−1暴露组相对比生长速率在接近0 nmol·L−1组数值的范围内波动外,其他暴露组的相对比生长速率均小于阴性对照组,有的组别的相对比生长速率还出现负值的情况,表明在暴露期间,1、5、10、20 nmol·L−1暴露组中小球藻的细胞增殖均低于阴性对照组,有的甚而出现负增长,即有可能出现了藻细胞的死亡。6 h至1 d的时间段内,1、5、10、20 nmol·L−1暴露组的相对比生长速率在整个测试时间段内最低,表明小球藻对量子点的毒性响应非常迅速且灵敏,而暴露浓度越大,小球藻的相对比生长速率越小,这种差异性在暴露初期最大。1—2 d内各浓度暴露组的相对比生长率均有明显的抬升,表明暴露一段时间之后,小球藻对量子点的毒性有了一定的耐受能力,从而生长增殖活性有所回升;2—4 d数据显示各浓度暴露组的相对比生长速率趋于稳定,但均小于阴性对照组(0 nmol·L−1)。在量子点胁迫下,1、5、10、20 nmol·L−1小球藻细胞数在暴露初期显著低于对照组,在后期有所回升,表明受到胁迫后还能够存活的抗逆性强的藻细胞在适应了外界胁迫后又继续生长繁殖,但其生长速率还是低于阴性对照组。而浓度最低的0.2 nmol·L−1暴露组虽然受影响最小,但仍表现出一定的抑制作用。
用比生长速率的半数效应浓度(EC50)进一步评估小球藻生长受到的抑制。EC50指能引起50%最大效应的浓度,即根据抑制率与浓度的关系,计算目标化合物对藻类生长抑制率为对照的50%时的作用浓度[30]。抑制率(I)根据比生长速率计算,公式如下[31]:
其中,μ0表示阴性对照组的平均比生长速率,μz表示各暴露处理组的比生长速率。
经计算96 h(4 d)后各处理组对小球藻生长的抑制率如表2所示,结果表明不同浓度的量子点在暴露总时长内(4 d)对小球藻的生长均表现出抑制效应。纳米材料对小球藻生长抑制的剂量-效应关系曲线多呈 S 型[32-33],本实验的数据同样符合S型曲线特征。利用origin软件中的Growth/Sigmoidal函数组中的Hill函数拟合CdSe(ZnS-CA QDs)对小球藻生长抑制率曲线,得到EC50(4 d)为0.70 nmol·L−1。本实验选择的暴露浓度5、10、20 nmol·L−1均远大于EC50(4 d),致使小球藻生长受到明显抑制,生长抑制率均大于70%(表2)。
进一步用光学显微镜对暴露4 d的藻细胞进行形态学观察,发现0.2 nmol·L−1暴露组的小球藻细胞形态、数量与阴性对照组(0 nmol·L−1)差异不大(图2)。而1、5、10、20 nmol·L−1暴露组的小球藻细胞均明显较对照组细胞数量少,且有细胞体积增大、甚至细胞破裂、胞质溢出的情况,与相对比生长速率的结果一致。由此可见,量子点暴露会改变细胞形态,促使细胞膨大破裂。
-
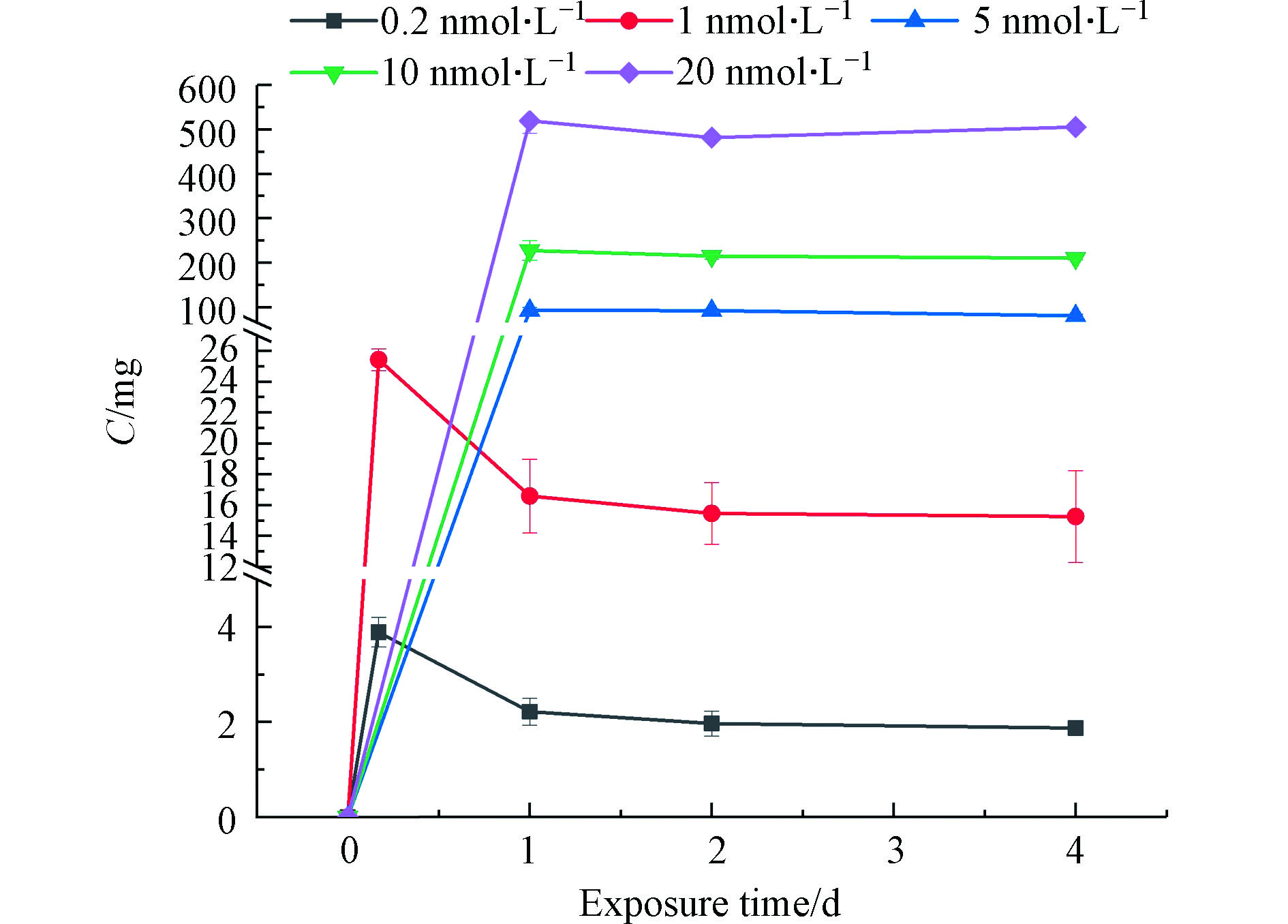
测定了去除了藻细胞后的培养基溶液中Cd的量,即藻细胞对量子点吸收/吸附后剩余在溶液中的量,以暴露Cd的初始总量扣除培养基溶液中Cd的含量,即可计算藻细胞对量子点的吸收/吸附量(图3),再除以暴露Cd总量可得到小球藻对量子点的吸收/吸附率(表3)。对于活跃的藻细胞而言,同时存在对外源污染物的吸收和吸附,但二者在本研究中未能加以区分。如图3和表3所示,0.2 nmol·L−1和1 nmol·L−1暴露组小球藻对量子点的吸收/吸附在暴露后呈先上升后下降的趋势,暴露开始时吸附/吸收量迅速增加,1 d后吸收/吸附量下降,在2 d后趋于稳定(2 d与4 d的Cd吸收/吸附浓度没有显著差异)。这一时间变化趋势表明Cd能够迅速被小球藻吸附/吸收,之后存在量子点吸附后解吸或者吸收后又外排的情况。5、10、20 nmol·L−1暴露组中小球藻细胞生长受到严重抑制,出现大量死亡破碎的现象(图2),使活细胞的吸收过程非常有限,而死细胞或细胞残体对QDs的吸附作用成为主导,这种吸附作用也是在1 d后基本达到平衡。有研究显示,某些藻类的死细胞对重金属的吸附性能甚至强于活细胞[34],死亡细胞因细胞壁、细胞膜破裂,有更多官能团外露,所以虽然细胞死亡后主动转运等富集机制失效,但细胞对金属的吸附能力反而增强[35]。因此即便小球藻细胞增殖受到影响和抑制,甚而在高浓度下发生死亡,但在本研究的暴露浓度范围内,随着暴露浓度的增加,小球藻对量子点的吸收/吸附率还是呈现出随暴露浓度上升而上升的趋势(表3)。
-
荧光素二乙酸盐(FDA)能被活细胞摄取,并在细胞内被酯酶转化为荧光产物,因此FDA处理后小球藻的荧光值可反映其酯酶活性[36],且酯酶活性在毒理学中是比较敏感的指标,酯酶活性越高,新陈代谢越活跃[37]。阴性对照组(0 nmol·L−1)藻细胞的酯酶活性,即代谢强度在研究期间(4 d内)呈现先上升后下降的趋势,这与细胞的生长周期有关,初期,细胞进入指数增长期,细胞活性增强,代谢随之加强;到第4天时,随着培养基的消耗和藻细胞的增殖与竞争,细胞新陈代谢强度下降。为了排除细胞自然生长过程中酯酶活性变化对量子点效应的影响,将量子点对酯酶活性的影响对阴性对照组进行了归一化处理,得到的酯酶活性变化如图4所示。
0.2 nmol·L−1和1 nmol·L−1的低剂量暴露组与5、10、20 nmol·L−1的高剂量暴露组在暴露初期(4 h)对小球藻酯酶活性的影响具有明显差异,受到低剂量量子点胁迫后,酯酶活性显著低于阴性对照组。然而,高剂量暴露组的酯酶活性则高于对照组,特别是20 nmol·L−1的暴露组,酯酶活性显著高于对照组。这种藻细胞经受高剂量量子点胁迫时新陈代谢显著增强的现象一方面可能是小球藻对外界胁迫所采取的应激和修复策略,从而抵抗量子点暴露带来的毒害,有文献发现藻类细胞通过增加代谢活性来实现酶、化合物的合成以及维持基因表达[38]。另一方面也可能是受到严重的毒害作用后,细胞代谢功能紊乱造成的[26]。1 d后,0.2 nmol·L−1暴露组酯酶活性有较大程度的恢复,趋近于对照组,这与前文中细胞数的检测结果相符,适应了暴露环境后藻细胞恢复了一定的数量,藻细胞整体代谢活性也有所上升。但因量子点暴露使小球藻受到一定程度的毒害,新陈代谢活性整体还是略低于对照组。而1、5、10、20 nmol·L−1暴露组中藻细胞的酯酶活性在1 d后均呈现出显著下降,远低于0 nmol·L−1阴性对照组,表明藻细胞新陈代谢已变得极其微弱,几乎都处于衰亡阶段。
量子点对小球藻酯酶活性的半数效应浓度同样可以用抑制率来表征[39],同小球藻生长抑制率的计算方法(式4),其中,μ0表示阴性对照组的相对荧光强度,μz表示各暴露处理的相对荧光强度,得到暴露24 h(1 d)时量子点对小球藻酯酶活性的抑制率(Iea)。用此抑制率对量子点暴露浓度做折线图,采用直线内插法[40-41]得到量子点暴露对小球藻酯酶活性抑制效果的半数效应浓度(EC50ea)为0.55 nmol·L−1.
-
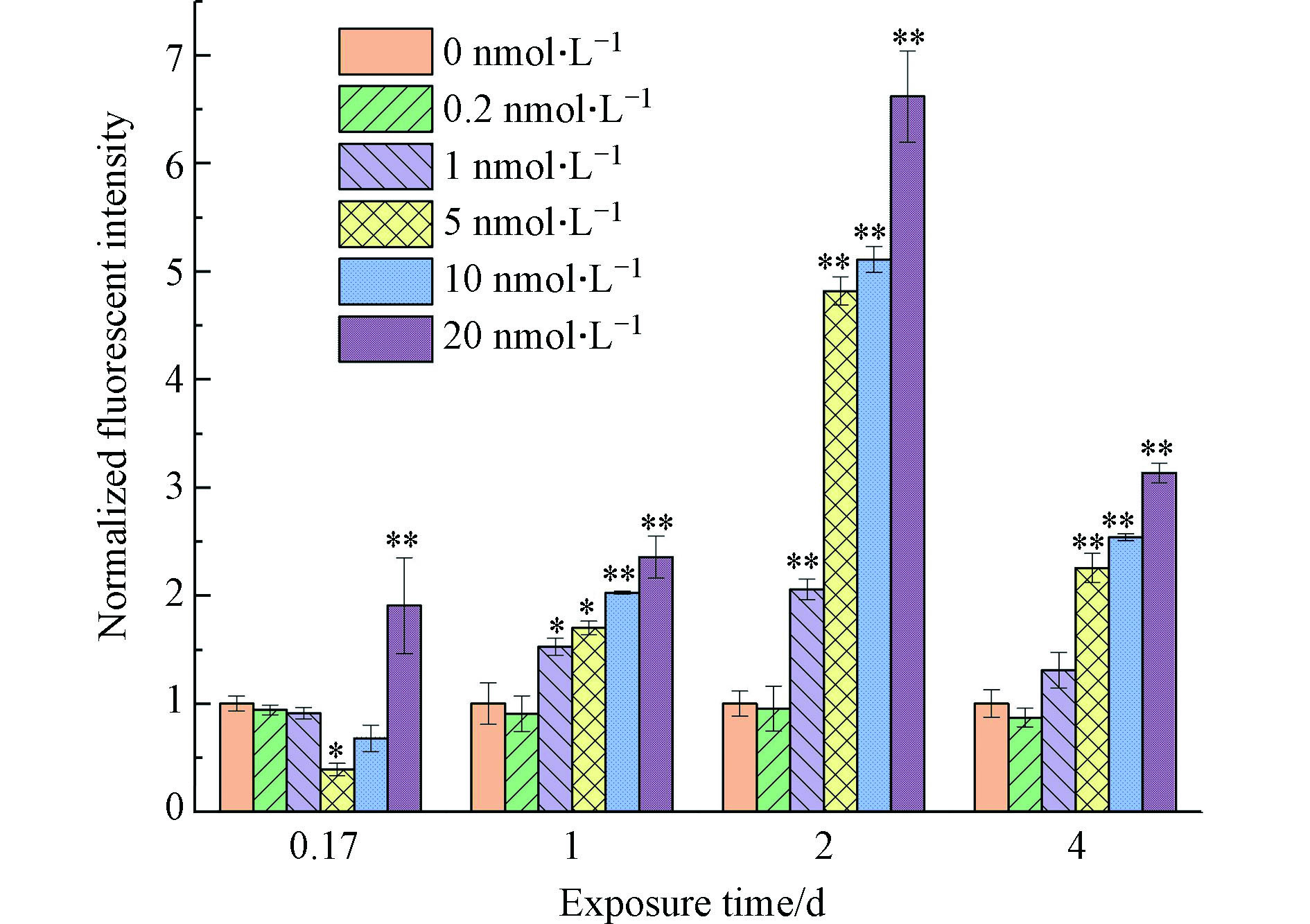
细胞膜是细胞与外界进行物质交换的直接通道,同时也是细胞抵御外界侵扰的一道防线[28]。藻类在污染物暴露下,由毒性胁迫导致的细胞膜损伤经常被用作衡量毒性效应的指标[26, 42-43]。正常情况下,染色剂碘化丙啶(PI)无法进入细胞内,但当细胞膜出现损坏时,PI即可进入细胞内,并使核酸染色,测定核酸染色的荧光水平即可反映普通小球藻的细胞膜完整性[44],因此测得的荧光水平越高,细胞膜完整性越低。本实验用暴露组与对照组的相对荧光强度来表征细胞膜的完整性,如图5所示。0.2 nmol·L−1暴露组小球藻的细胞膜完整性在暴露期间内与阴性对照组相近,表明该暴露浓度对小球藻细胞膜的影响不大。1 nmol·L−1组在暴露初期(4 h)与阴性对照组相近,对细胞膜完整性的影响还不显著,但在1 d后细胞膜完整性比对照组有明显降低,表明该暴露浓度下,量子点对小球藻的细胞膜已经具有较为明显的损坏作用。高浓度暴露组(5—20 nmol·L−1)细胞膜的完整性在暴露1 d至2 d内显著低于对照组,且与暴露浓度呈负相关。即暴露浓度越高,毒性作用越大,细胞膜完整性越低。由于细胞膜完整性不佳的细胞首先被致死,因此4 h时高浓度暴露组细胞膜完整性为5 nmol·L−1组>10 nmol·L−1组>20 nmol·L−1组。而在暴露的最后(4 d),用于表征细胞膜完整性的相对荧光强度值对1—20 nmol·L−1暴露组都有所下降,则是因为在该时间点这些暴露组的荧光强度测得值与2 d的测定值相近,但对对照组而言,由于培养基的消耗和藻细胞的增殖与竞争致使其细胞膜完整性下降,即计算相对荧光强度时,分母增大,从而使该时间点的相对荧光强度降低。
-
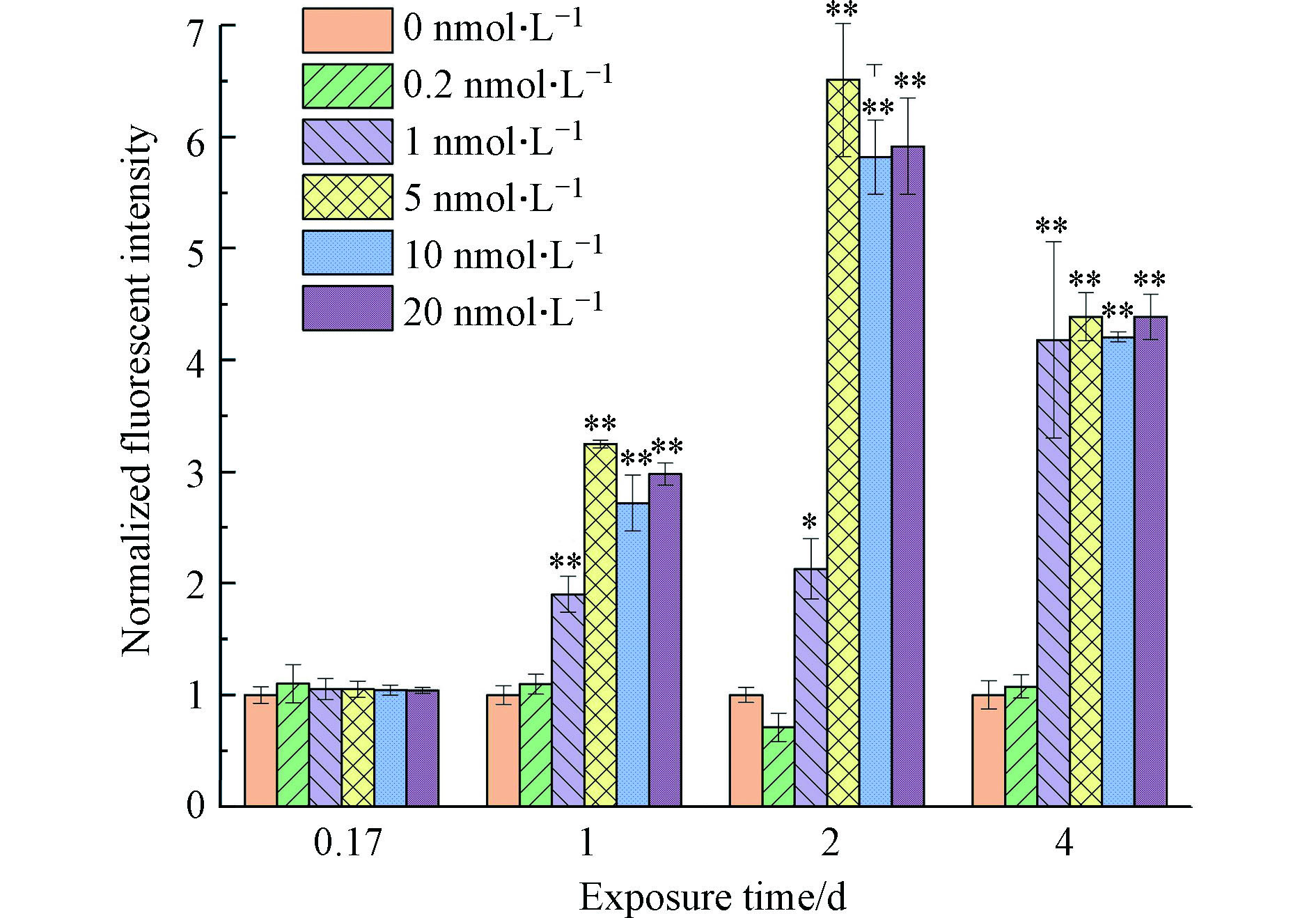
罗丹明123(Rh123)是一种线粒体跨膜阳离子荧光染剂,正常功能的线粒体能使其留在线粒体基质内,进而使其荧光消失或减弱,但当线粒体膜完整性受损时,Rh123会通过转运孔从线粒体内释放,发出黄绿色荧光[45]。所以Rh123染色荧光值可反映普通小球藻的线粒体膜电位的高低,荧光值越高,线粒体膜电位越高。线粒体作为细胞中具高负电性的膜系统,80%以上的ATP是由线粒体合成的,其膜电位变化可反映细胞的生理状态[45]。如图6所示,0.2 nmol·L−1组线粒体膜电位时间变化趋势与阴性对照组相近,该暴露浓度对线粒体膜电位没有显著影响。1—20 nmol·L−1暴露组线粒体膜电位在4 h时均与对照组持平,表明线粒体功能在暴露初期(4 h内)未受到明显影响,但1 d后线粒体膜电位均明显高于对照组,表明藻细胞因量子点的毒性引起应激反应,随着暴露时间的增长,所受的毒害逐渐超过细胞自身的调节能力,线粒体功能发生紊乱,ATP所主导的能量代谢受阻或停滞。相似的现象在金属离子对假单胞菌的毒性胁迫[43]以及全氟磺酸和全氟羧酸对淡水藻膜的影响[28]中都有报道。
-
活性氧(ROS)会在正常细胞代谢中产生,并有抗氧化系统不断去除ROS,使生物体内的ROS始终保持一种动态平衡。但在受到胁迫时,ROS会增多,超过细胞本身能去除的水平,导致细胞受损[46]。2',7'-二氯荧光素二乙酸酯(H2DCFDA)在穿透细胞后易脱掉乙酰基转为活性形式,然后被ROS氧化形成荧光,可反映普通小球藻细胞内ROS含量[47],荧光值越高,胞内活性氧含量越高,氧化应激反应越严重。图7显示0.2 nmol·L−1暴露组在4 h至2 d内与阴性对照组小球藻的氧化应激没有显著差异,但在暴露4 d时,胞内ROS水平显著高于阴性对照组,推测0.2 nmol·L−1暴露组的小球藻除了增殖引起的轻微胁迫,还经受了量子点的毒害,致使其胞内ROS含量激增。1—20 nmol·L−1暴露组细胞内ROS含量在4 h时显著高于对照组,表明细胞出现严重的氧化应激反应,而ROS过多会导致酶的失活和DNA损伤,进而导致细胞受损,甚至死亡。1 d后这几个暴露组藻细胞内ROS含量逐渐降低,甚至低于对照组,推测一方面由于藻细胞在量子点毒害作用下破损致死,使其无法进行正常应激反应,另一方面对照细胞增殖导致的轻微胁迫,使胞内ROS上升,导致表征结果值(即相对荧光强度)下降。Morelli等研究也发现在海水中CdSe/ZnS QD暴露导致硅藻ROS增加[48]。这一结果也在一定程度上解释了藻细胞凋亡受损的分子机制。
-
小球藻作为光合自养生物,会产生多种吸收可见光的色素。这些色素在光合作用中捕获光子的同时,会有一部分能量以荧光的形式放出。小球藻的主要色素是叶绿素a和叶绿素b,其中叶绿素a荧光峰值在676 nm[49],FL3通道能检测叶绿素a的荧光强度[39-40]。叶绿素荧光强度能反映小球藻叶绿素含量,进而反映光合作用情况。图8显示0.2 nmol·L−1组叶绿素含量在暴露期间与对照组相近。
1、5、10、20 nmol·L−1组叶绿素含量在4 h时与对照组相近,说明叶绿体功能在暴露初期(4 h内)未受到明显影响。高浓度组在1 d后叶绿素含量持续下降,极显著低于阴性对照组,这可能与量子点的毒害作用使叶绿体受创程度随着时间的延长而加重有关,叶绿体功能紊乱,致使叶绿素含量下降。Ouyang等[50]发现氧化石墨烯暴露会抑制普通小球藻的叶绿素a合成,并且通过代谢组学证明其抑制作用可能与叶绿素a的前体丝氨酸的减少有关。Zhang等[51]发现碳量子点暴露降低了小球藻二磷酸核酮糖羧化酶(Rubisco)活性并抑制了光合相关基因的转录。叶绿素a含量减少也可能与量子点在细胞表面的吸附有关,Oukarroum等[52]研究发现,氧化镍纳米粒子(NiO-NPs)暴露时,NiO-NPs会在藻类细胞表面吸附聚集,将藻细胞包围,从而导致光合作用所需的光和营养物质的有效性降低。1 nmol·L−1组在1 d至2 d内同样叶绿素含量下降明显,但4 d时,叶绿素含量有所回升,这与细胞数的检测结果相符,随着藻细胞的恢复,藻细胞整体光合作用有所回升。量子点对小球藻光合作用的半数效应浓度同样可以用抑制率来表征[39],计算方法同上,结果显示,暴露24 h(1 d)时量子点抑制小球藻光合作用的半数效应浓度(EC50p)为0.70 nmol·L−1。
-
从各生化指标和细胞数量、形态的检测可以看出,高浓度暴露组间各指标差异不明显,主要是由于暴露浓度超出了小球藻能承受的浓度范围,致使大量细胞死亡,无法观测生化指标的时间变化。但在低浓度组中,可以明显观测到普通小球藻在量子点胁迫下的剂量-效应关系,CdSe(ZnS-CA QDs)对小球藻新陈代谢、细胞膜、线粒体、叶绿体均有不同程度的毒害,导致藻细胞的膜系统,随暴露时间延长和暴露浓度的增加毒性效应增强。这与其他文献报道的硒化镉量子点对蛋白核小球藻的膜系统有着明显的破坏作用是一致的[53]。且不同检测指标对毒性的响应速度不同,暴露24 h(1 d)的EC50ea和EC50p分别为0.55 nmol·L−1和0.70 nmol·L−1,表明酯酶活性和光合作用这两项检测指标在暴露早期就表现出高敏感性,且酯酶活性表现出更高的敏感性,但对于细胞生长的抑制情况则要到暴露96 h(4 d)才能显露;线粒体膜电位和叶绿素含量在暴露4 h时响应并不明显,显著的毒性效应出现在暴露1 d后,而其他的生化指标则在暴露初期(4 h)就有明显毒性效应,这表明硒化镉量子点首先对细胞膜、细胞质内无膜包被的系统和代谢产生影响,然后进一步影响胞内相对独立的细胞器。
本文所选取的硒化镉量子点对小球藻的毒性明显大于Yan等[53]文献中报道的毒性。推测这主要与研究的量子点和植物种类不同有关。Yan等[53]使用的是蛋白核小球藻(Chlorella pyrenoidosa)和巯基乙酸(TGA)包被的CdSe QDs;而本研究选用的是普通小球藻(Chlorella vulgaris)和巯基乙胺(CA)包被的CdSe QDs。除不同种类小球藻对量子点耐受性的差异外,更大的可能是CdSe QDs包被材料的不同所带来的毒性差异。巯基乙酸(TGA)包被膜材料呈酸性,使量子点带负电;而巯基乙胺(CA)包被材料呈碱性,使量子点带正电。研究发现表面带正电的纳米材料更容易引发毒性效应[15],同时也有研究显示[54],植物根系对带电不同的污染物存在差异吸收,这种情况也很可能发生在藻细胞上。小球藻表面因存在磷酸基团和羧基而带负电,对阳离子有更强的吸附作用[55-56]因此带正电的CdSe(ZnS-CA QDs)更容易被小球藻吸附和吸收,进入细胞内,破坏细胞的选择透性,从而进一步扩大进入细胞的外来污染物数量,导致蛋白质变性,酶失活,最终导致细胞死亡。所以带正电的巯基乙胺(CA)包被的硒化镉量子点比巯基乙酸(TGA)包被的CdSe毒性更强,其所带来的生态与健康风险也更高。
此外,研究结果还显示在较低的浓度水平下,1 nmol·L−1硒化镉量子点即可使小球藻群体生物量增长停滞,进而导致整个生态系统的物质能量循环出现问题。若水生态系统内以小球藻为代表的生产者们难以为继,不充足的能量物质转化将会使更高营养级的生物难以生存,生态系统的物质循环和能量传递平衡被打破,将导致生态系统内种群数量减少和生物多样性退化,最终使环境恶化甚至崩坏。
-
本论文研究了CdSe(ZnS-CA QDs)对普通小球藻生长和生化指标的影响,发现该硒化镉量子点表面带有正电荷,能被表面带负电的小球藻吸附/吸收,从而使小球藻的新陈代谢受到干扰,细胞膜破碎,线粒体产能下降、氧化应激加剧。该材料在极低水平(1 nmol·L−1)即可对小球藻生长繁殖造成巨大影响,进而可能影响整个生态系统的物质能量循环。本研究为纳米材料对小球藻的毒性研究提供了一些初步的基础数据,也为进一步深入研究水体环境中硒化镉量子点的生态毒理效应奠定了基础。
硒化镉量子点对普通小球藻生长和生化指标的影响
Toxic effects of cadmium selenide quantum dots CdSe (ZnS-CA QDs) on the growth and biochemical indices of Chlorella vulgaris
-
摘要: 新型纳米材料——量子点在基因组学、蛋白质组学、高通量筛选以及半导体等方面应用十分广泛,但人们对其生物毒性效应和生态环境风险的了解并不充分。本文研究了硒化镉量子点CdSe(ZnS-CA QDs)对普通小球藻生长和生化指标的影响,对细胞数、酯酶活性、细胞膜完整性、线粒体膜电位、细胞内活性氧含量及培养基内量子点含量及其随时间的变化趋势进行了测定,表征了量子点的毒性效应。发现硒化镉量子点表面带有正电荷,能被小球藻(因表面存在磷酸和羧基基团而带负电)吸附/吸收,从而使小球藻的新陈代谢受到干扰,细胞膜破碎,线粒体产能下降,氧化应激加剧,叶绿素含量下降。该材料在极低水平(1 nmol·L−1)即可对小球藻生长繁殖造成巨大影响,进而可能影响整个生态系统的物质循环和能量流动。Abstract: Nanomaterials—quantum dots are widely used in various areas, including genomics, proteomics, high throughput screening and semiconductors. Their environmental and ecological risks are not fully understood. In this paper, the toxic effects of cadmium selenide quantum dots CdSe (ZnS-CA QDs) on Chlorella vulgaris were studied. The cell growth, esterase activity, cell membrane integrity, mitochondrial membrane potential, intracellular reactive oxygen and variation of cadmium concentration over time were systematically evaluated. It was found that the positively charged CdSe(ZnS-CA) QDs could be adsorbed/absorbed by chlorella. It could possibly be attributed to the negatively charged cell wall for the presence of phosphate and carboxyl groups on cell surface. QDs interfered with the metabolism of chlorella, damaged the cell membrane, declined the mitochondrial productivity, intensified the oxidative stress and reduced chlorophyll content. The QDs had intensively adverse impacts on the growth and reproduction of chlorella at very low levels (1 nmol·L−1), which may further influence the material circulation and the energy flow of the entire ecosystem.
-
Key words:
- Chlorella vulgaris /
- novel nanoparticle material /
- toxic effects /
- impact assessment
-

-
表 1 小球藻各生化指标的测定方法
Table 1. Methods for the determination of biochemical indices of Chlorella vulgaris
染色剂
Reagents用量/µL
Dosage避光孵育时间/min
Incubation time in the dack对应荧光通道
Fluorescence filtersFDA 25 8 FL1 PI 60 20 FL2 Rh123 26 30 FL1 H2DCFDA 100 60 FL1 表 2 CdSe(ZnS-CA QDs)对小球藻生长的影响(暴露4 d)
Table 2. Effects of CdSe(ZnS-CA QDs) on growth of Chlorella vulgaris (Exposure to 4 d)
量子点初始浓度/(nmol·L−1)
CdSe QDs dose生长抑制率/%
Growth inhibiting rate0.2 10.2±2.7 1 61.5±10.1 5 73.3±6.2 10 74.8±27.6 20 82.9±10.1 表 3 小球藻在不同CdSe(ZnS-CA QDs)初始暴露浓度下,对量子点的吸收/吸附率
Table 3. Absorption/adsorption rates of CdSe(ZnS-CA QDs) at different initial exposure concentrations
量子点初始浓度/(nmol·L−1)
CdSe QDs dose量子点吸收/吸附率/%
Absorption/adsorption rates of CdSe QDs0.17 d 1 d 2 d 4 d 0.2 58±5 33±5 30±5 28±3 1 78±2 52±7 48±6 48±9 5 No data 67±4 67±2 58±3 10 No data 79±8 75±2 73±1 20 No data 92±5 85±1 89±1 -
[1] ROSENTHAL S J. Bar-coding biomolecules with fluorescent nanocrystals [J]. Nature Biotechnology, 2001, 19(7): 621-622. doi: 10.1038/90213 [2] CHAN W C, NIE S. Quantum dot bioconjugates for ultrasensitive nonisotopic detection[J]. Science, 1998, 281(5385): 2016-2018. [3] BRUCHEZ M, MORONNE M, GIN P, et al. Semiconductor nanocrystals as fluorescent biological labels [J]. Science, 1998, 281(5385): 2013-2016. doi: 10.1126/science.281.5385.2013 [4] INSTITUTE Y R. Global Markets of quantum dot displays/components: Key research findings 2018[EB/OL].[2019-5-27]. Tokyo: Yano Research Institute Ltd, 2018(2018-3-28).https://www.yanoresearch.com/en/press-release/show/press_id/1813. [5] 章晨. 硒化镉量子点对人成纤维上皮细胞的毒理学研究[D]. 杭州: 浙江大学, 2011. ZHANG C. The cytotoxic and genotoxic effects of CdSe quantum dots on human skin fibroblasts cell(HSF-42)[D]. Hangzhou: Zhejiang University, 2011 (in Chinese).
[6] 宋方茗. 硒化镉量子点对人皮肤细胞的毒性效应研究[D]. 上海: 第二军医大学, 2010. SONG F M. Study on the toxicity of CdSe/ZnS quantum dots to the human skin cells[D]. Shanghai: The Second Military Medical University, 2010 (in Chinese).
[7] CHEN M, HUANG C, PU D, et al. Toxic effects of CdSe/ZnS QDs to zebrafish embryos [J]. Environmental Science, 2015, 2(36): 719-726. [8] WERLIN R, PRIESTER J H, MIELKE R E, et al. Biomagnification of cadmium selenide quantum dots in a simple experimental microbial food chain [J]. Nature Nanotechnology, 2010, 6: 65. [9] BOULDIN J L, INGLE T M, SENGUPTA A, et al. Aqueous toxicity and food chain transfer of Quantum DOTs in freshwater algae and Ceriodaphnia dubia [J]. Environmental Toxicology and Chemistry, 2008, 27(9): 1958-1963. doi: 10.1897/07-637.1 [10] NAVARRO D A, BISSON M A, AGA D S. Investigating uptake of water-dispersible CdSe/ZnS quantum dot nanoparticles by Arabidopsis thaliana plants [J]. Journal of Hazardous Materials, 2012, 211-212: 427-435. doi: 10.1016/j.jhazmat.2011.12.012 [11] KLAINE S J, ALVAREZ P J J, BATLEY G E, et al. Nanomaterials in the environment: Behavior, fate, bioavailability, and effects [J]. Environmental Toxicology and Chemistry, 2008, 27(9): 1825-1851. doi: 10.1897/08-090.1 [12] 徐冬梅, 王艳花, 饶桂维. 四环素类抗生素对淡水绿藻的毒性作用 [J]. 环境科学, 2013, 34(9): 3386-3390. XU D M, WANG Y H, RAO G W. Cellular response of freshwater green algae to the toxicity of tetracycline antibiotics [J]. Environmental Science, 2013, 34(9): 3386-3390(in Chinese).
[13] 梁长华. 纳米NiO对小球藻的生物毒性及致毒机制研究[D]. 大连: 大连海事大学, 2010. LIANG C H. Research on biotoxicity and toxic mechanism of NiO nanoparticles on Chlorella vulgaris[D]. Dalian: Dalian Maritime University, 2010 (in Chinese).
[14] LIU J, SUN Z, LAVOIE M, et al. Ammonium reduces chromium toxicity in the freshwater alga Chlorella vulgaris [J]. Applied Microbiology and Biotechnology, 2015(7): 3249-3258. [15] LIBRALATO G, GALDIERO E, FALANGA A, et al. Toxicity effects of functionalized quantum dots, gold and polystyrene nanoparticles on target aquatic biological models: A review [J]. Molecules (Basel, Switzerland), 2017, 22(9): 1439. doi: 10.3390/molecules22091439 [16] FARRÉ M, GAJDA-SCHRANTZ K, KANTIANI L, et al. Ecotoxicity and analysis of nanomaterials in the aquatic environment [J]. Analytical and Bioanalytical Chemistry, 2009, 393(1): 81-95. doi: 10.1007/s00216-008-2458-1 [17] 雷静静, 冯佳, 谢树莲. 纳米氧化镍对3种绿藻的毒性效应 [J]. 中国环境科学, 2013, 33(10): 1842-1849. LEI J J, FENG J, XIE S L. Toxic effects of nNiO on three species of green algae [J]. China Environmental Science, 2013, 33(10): 1842-1849(in Chinese).
[18] ZHOU H, WANG X, ZHOU Y, et al. Evaluation of the toxicity of ZnO nanoparticles to Chlorella vulgaris by use of the chiral perturbation approach [J]. Anal Bioanal Chem, 2014, 406(15): 3689-3695. doi: 10.1007/s00216-014-7773-0 [19] SUMAN T Y, RAJASREE S R R, KIRUBAGARAN R. Evaluation of zinc oxide nanoparticles toxicity on marine algae chlorella vulgaris through flow cytometric, cytotoxicity and oxidative stress analysis [J]. Ecotoxicology and Environmental Safety, 2015, 113: 23-30. doi: 10.1016/j.ecoenv.2014.11.015 [20] DA ROCHA A, MENGUY N, YÉPRÉMIAN C, et al. Ecotoxicological studies of ZnO and CdS nanoparticles on Chlorella vulgaris photosynthetic microorganism in Seine River water [J]. Nanomaterials, 2020, 10(2): 227. doi: 10.3390/nano10020227 [21] MIDDEPOGU A, HOU J, GAO X, et al. Effect and mechanism of TiO2 nanoparticles on the photosynthesis of Chlorella pyrenoidosa [J]. Ecotoxicology and Environmental Safety, 2018, 161: 497-506. doi: 10.1016/j.ecoenv.2018.06.027 [22] JI J, LONG Z, LIN D. Toxicity of oxide nanoparticles to the green algae Chlorella sp. [J]. Chemical Engineering Journal, 2011, 170(2-3): 525-530. doi: 10.1016/j.cej.2010.11.026 [23] ZHAO J, CAO X, WANG Z, et al. Mechanistic understanding toward the toxicity of graphene-family materials to freshwater algae [J]. Water Research, 2017, 111: 18-27. doi: 10.1016/j.watres.2016.12.037 [24] 姜慧, 丁婷婷, 张瑾, 等. 3种有机溶剂及其混合物对蛋白核小球藻时间毒性的探究 [J]. 安徽农业大学学报, 2018, 45(3): 480-486. JIANG H, DING T T, ZHANG J, et al. The time-dependent toxicity of three organic solvents and their mixtures towards Chlorella pyrenoidosa [J]. Journal of Anhui Agricultural University, 2018, 45(3): 480-486(in Chinese).
[25] 熊忠亮, 乔军晶. 流式细胞仪在活体微藻计数中的应用 [J]. 山东化工, 2018, 47(1): 143-145. doi: 10.3969/j.issn.1008-021X.2018.01.064 XIONG Z L, QIAO J J. Application of flow cytometry in living microalgae count [J]. Shandong Chemical Industry, 2018, 47(1): 143-145(in Chinese). doi: 10.3969/j.issn.1008-021X.2018.01.064
[26] 王执伟, 刘冬梅, 张文娟, 等. 溴酸盐对普通小球藻的生长以及生理特性的影响 [J]. 环境科学, 2016, 37(6): 2158-2163. WANG Z W, LIU D M, ZHANG W J, et al. Effects of bromate on the growth and physiological characteristics of Chlorella vulgaris [J]. Environmental Science, 2016, 37(6): 2158-2163(in Chinese).
[27] YU Y, KONG F, WANG M, et al. Determination of short-term copper toxicity in a multispecies microalgal population using flow cytometry [J]. Ecotoxicology and Environmental Safety, 2007, 66(1): 49-56. doi: 10.1016/j.ecoenv.2005.10.014 [28] LIU W, CHEN S, QUAN X, et al. Toxic effect of serial perfluorosulfonic and perfluorocarboxylic acids on the membrane system of a freshwater alga measured by flow cytometry [J]. Environmental Toxicology and Chemistry, 2008, 27(7): 1597-1604. doi: 10.1897/07-459.1 [29] NYHOLM N. Response variable in algal growth inhibition tests—Biomass or growth rate? [J]. Water Research, 1985, 19(3): 273-279. doi: 10.1016/0043-1354(85)90085-5 [30] ISO. 8692-1989-11-15 Water quality-fresh water water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum[S]. 1989. [31] OECD. Guideline for testing of chemicals; No. 201: "Freshwater alga and cyanobacteria, growth inhibition[S]. Sophia University, 2006. [32] 孙红羽, 张思玉, 赵冰, 等. 纳米硫酸铅对小球藻的毒性 [J]. 生态学杂志, 2019, 38(9): 2734-2740. SUN H Y, ZHANG S Y, ZHAO B, et al. Toxicity of lead sulfate nanoparticles to Chlorella vulgaris [J]. Chinese Journal of Ecology, 2019, 38(9): 2734-2740(in Chinese).
[33] 巩宁, 邵魁双, 王阳, 等. 两种粒径氧化镍纳米颗粒对小球藻(Chlorella vulgaris)的生物毒性 [J]. 海洋环境科学, 2011, 30(4): 457-460. doi: 10.3969/j.issn.1007-6336.2011.04.001 GONG N, SHAO K S, WANG Y, et al. Biotoxicity of two-size nickel oxide nanoparticles on Chlorella vulgaris [J]. Marine Environmental Science, 2011, 30(4): 457-460(in Chinese). doi: 10.3969/j.issn.1007-6336.2011.04.001
[34] TSEZOS M, VOLESKY B. Biosorption of uranium and thorium [J]. Biotechnology and Bioengineering, 1981, 23(3): 583-604. doi: 10.1002/bit.260230309 [35] 郑昊. 莱茵衣藻对纳米氧化铜在水环境中的分布规律及去除效能的影响[D]. 泰安: 山东农业大学, 2016. ZHENG H. Effects of Chlamydomonas reinhardtii on removal and distribution of CuO nanoparticle[D]. Taian: Shandong Agricultural University, 2016 (in Chinese).
[36] VIGNEAULT B, PERCOT A, LAFLEUR M, et al. Permeability changes in model and phytoplankton membranes in the presence of aquatic humic substances [J]. Environmental Science & Technology, 2000, 34(18): 3907-3913. [37] SHI X L K F. Survival of Microcystis aeruginosa and Scenedesmus obliquus under dark anaerobic conditions [J]. Marine and Freshwater Research, 2007, 7(58): 634-639. [38] HONG Y, HU H, LI F. Physiological and biochemical effects of allelochemical ethyl 2-methyl acetoacetate (EMA) on cyanobacterium Microcystis aeruginosa [J]. Ecotoxicology and Environmental Safety, 2008, 71(2): 527-534. doi: 10.1016/j.ecoenv.2007.10.010 [39] STAUBER J L, FRANKLIN N M, ADAMS M S. Applications of flow cytometry to ecotoxicity testing using microalgae [J]. Trends in Biotechnology, 2002, 20(4): 141-143. doi: 10.1016/S0167-7799(01)01924-2 [40] 于洋, 孔繁翔, 钱蕾蕾, 等. 流式细胞术在铜对藻类生态毒理研究中的应用 [J]. 环境化学, 2004(5): 525-528. doi: 10.3321/j.issn:0254-6108.2004.05.009 YU Y, KONG F X, QIAN L L, et al. The application of flow cytometry in the study of copper-to-algae ecotoxicology [J]. Environmental Chemistry, 2004(5): 525-528(in Chinese). doi: 10.3321/j.issn:0254-6108.2004.05.009
[41] KOTTUPARAMBIL S, PARK J. Anthracene phytotoxicity in the freshwater flagellate alga Euglena agilis Carter [J]. Scientific Reports, 2019, 9(1): 1-11. [42] XIA B, CHEN B, SUN X, et al. Interaction of TiO2 nanoparticles with the marine microalga Nitzschia closterium: Growth inhibition, oxidative stress and internalization [J]. Science of the Total Environment, 2015, 508: 525-533. doi: 10.1016/j.scitotenv.2014.11.066 [43] MACHADO M D, LOPES A R, SOARES E V. Responses of the alga Pseudokirchneriella subcapitata to long-term exposure to metal stress [J]. Journal of Hazardous Materials, 2015, 296: 82-92. doi: 10.1016/j.jhazmat.2015.04.022 [44] 苏文, 孔繁翔, 于洋, 等. 水稻秸秆浸泡液对铜绿微囊藻生理特性的影响 [J]. 环境科学, 2013, 34(1): 150-155. SU W, KONG F X, YU Y, et al. Effects of the rice straw on Microcystis aeruginosa analyzed by different physiological parameters [J]. Environmental Science, 2013, 34(1): 150-155(in Chinese).
[45] 岳磊, 张垚, 张楠曦. 流式细胞仪检测线粒体膜电位方法的研究 [J]. 哈尔滨商业大学学报(自然科学版), 2015, 31(4): 393-397. YUE L, ZHANG Y, ZHANG N X. Study on methods for detecting mitochondrial membrane potential by flow cytometry [J]. Journal of Harbin University of Commerce(Natural Sciences Edition), 2015, 31(4): 393-397(in Chinese).
[46] LIU W, AU D W T, ANDERSON D M, et al. Effects of nutrients, salinity, pH and light: Dark cycle on the production of reactive oxygen species in the alga Chattonella marina [J]. Journal of Experimental Marine Biology and Ecology, 2007, 346(1-2): 76-86. doi: 10.1016/j.jembe.2007.03.007 [47] SAISON C, PERREAULT F, DAIGLE J, et al. Effect of core–shell copper oxide nanoparticles on cell culture morphology and photosynthesis (photosystem Ⅱ energy distribution) in the green alga, Chlamydomonas reinhardtii [J]. Aquatic Toxicology, 2010, 96(2): 109-114. doi: 10.1016/j.aquatox.2009.10.002 [48] MORELLI E, CIONI P, POSARELLI M, et al. Chemical stability of CdSe quantum dots in seawater and their effects on a marine microalga [J]. Aquat Toxicol, 2012(122-123): 153-162. [49] 范陈清. 叶绿素a荧光计设计与开发[D]. 青岛: 中国石油大学, 2009. FAN C Q. Design and development of chlorophyll a fluorometer[D]. Qingdao: China University of Petroleum, 2009 (in Chinese).
[50] OUYANG S, HU X, ZHOU Q. Envelopment–internalization synergistic effects and metabolic mechanisms of graphene oxide on single-cell Chlorella vulgaris are dependent on the nanomaterial particle size [J]. ACS Applied Materials & Interfaces, 2015, 7(32): 18104-18112. [51] ZHANG M, WANG H, LIU P, et al. Biotoxicity of degradable carbon dots towards microalgae Chlorella vulgaris [J]. Environmental Science:Nano, 2019(11): 3316-3323. [52] OUKARROUM A, ZAIDI W, SAMADANI M, et al. Toxicity of nickel oxide nanoparticles on a freshwater green algal strain of Chlorella vulgaris [J]. Biomed Res Int, 2017, 2017: 9528180. [53] YAN K, LIU Y, YANG Q, et al. Evaluation of the novel nanoparticle material: CdSe quantum dots on Chlorella pyrenoidosa and Scenedesmus obliquus: Concentration-time-dependent responses [J]. Ecotoxicology and Environmental Safety, 2019, 171: 728-736. doi: 10.1016/j.ecoenv.2019.01.018 [54] NASON S L, MILLER E L, KARTHIKEYAN K G, et al. Plant-induced changes to rhizosphere pH impact leaf accumulation of lamotrigine but not carbamazepine [J]. Environmental Science & Technology Letters, 2018, 5(6): 377-381. [55] 许银, 葛飞, 陶能国, 等. 十六烷基三甲基氯化铵抑制小球藻生长的效应及作用机制 [J]. 环境科学, 2009, 30(6): 1767-1772. doi: 10.3321/j.issn:0250-3301.2009.06.036 XU Y, GE F, TAO N G, et al. Growth inhibition and mechanism of cetyltrimethyl ammonium chloride on Chlorella vulgaris [J]. Environmental Science, 2009, 30(6): 1767-1772(in Chinese). doi: 10.3321/j.issn:0250-3301.2009.06.036
[56] 傅佳骏, 严莲荷, 王瑛. 季鏻盐类杀菌剂的研究进展 [J]. 江苏化工, 2003, 31(6): 12-16. FU J J, YAN L H, WANG Y. Development of quaternary phosphonium salts as fungicides [J]. Jiangsu Chemical Industry, 2003, 31(6): 12-16(in Chinese).
-




 下载:
下载: