-
随着采矿、冶金、电镀及电池制造等行业的快速发展,重金属离子已成为污染水体的重要组分[1]。重金属离子具有生物体内难降解、高毒及致癌等特性严重威胁人类健康与生态环境[1]。因此,高效去除污染水体中重金属的技术已成全球研究的热点。当前去除与回收水体重金属离子的主要方法有化学共沉淀、离子交换、膜过滤、吸附和电沉积等,而具有低成本、易操作等优势的吸附法应用前景看好[1-3]。
锰氧化物以其零电荷点低、资源丰富且环境友好等特点被广泛用于吸附去除水体重金属[4-6]。常见的锰氧化物有水钠锰矿、锰钾矿、钙锰矿和黑锰矿等。不同锰氧化物的零电荷点、微观形貌、比表面积等特性存在差异,相应的重金属吸附容量也不尽相同,如对Zn2+、Pb2+和Cd2+的吸附容量顺序为水钠锰矿>锰钾矿>钙锰矿>黑锰矿[6]。此外,同一晶体结构类型的锰氧化物化学组成不同,其对重金属离子吸附容量也存在差异,如锰平均氧化度越高的水钠锰矿吸附重金属容量越高[7]。在pH 7.5的厌氧条件下,Mn2+诱导水钠锰矿还原为水锰矿(β-MnOOH)和黑锰矿(Mn3O4)等低价锰氧化物的过程可显著提升其对Ni2+和Zn2+的吸附容量[8-9]。因此,通过氧化还原反应改变锰氧化物组成及特性可望提高其重金属吸附容量。
水钠锰矿是由共边的MnO6八面体层与水分子相互交错堆叠而成,独特的结构使其具有较好阳离子交换量、氧化还原特性及重金属吸附容量[7,10-11]。我们前期工作中发现电化学驱动的氧化还原过程中,水钠锰矿形貌、化学组成及锰平均氧化度等特性的改变显著提高了其重金属离子吸附容量,如在多周循环氧化还原过程中,水钠锰矿对Zn2+、Cd2+和Cu2+的最大电化学吸附容量分别高达530.0、900.7、372.3 mg·g−1,约为等温吸附容量的8—10倍[12-14]。污染水体中通常含有多种重金属离子,在吸附过程中需考虑它们之间的相互影响。研究表明碱性钙基膨润土吸附多种重金属容量为Pb2+>Cu2+>Zn2+,且重金属间的吸附会相互抑制[15]。不同重金属在水钠锰矿上吸附作用力的强弱及位点差异也使其吸附容量不同[7]。在锰氧化物电化学吸附重金属过程中,多种重金属离子吸附容量及其相互作用机制尚不清楚。
本文以水钠锰矿为电极材料,在含有Cd2+、Zn2+、Pb2+与Ni2+的溶液体系中,系统考察了恒流充放电控制的电化学氧化还原过程中重金属离子间的相互作用对其在水钠锰矿上电化学吸附容量及机理的影响。
-
采用浓盐酸还原煮沸的高锰酸钾制备水钠锰矿[16]。将300 mL浓度为0.667 mol·L−1高锰酸钾溶液搅拌并加热至100 ℃,用恒流泵将45 mL浓度6.0 mol·L−1盐酸溶液以0.7 mL·min−1速率逐滴加入高锰酸钾溶液,滴加完毕后继续反应30 min。将反应获得的悬浊液置于60 ℃恒温烘箱静置12 h后用去离子水清洗至滤液电导小于10 μS·cm−1,再用乙醇洗涤3次后在鼓风烘箱中干燥。获得的水钠锰矿经研磨过100目筛后备用。
-
电化学去除重金属离子实验在三电极体系中进行,温度为25 ℃。将合成水钠锰矿、导电剂乙炔黑及粘合剂聚偏氟乙烯按质量比75∶15∶10称量。水钠锰矿先与乙炔黑混合研磨30 min后转移至离心管,随后向其中加入聚偏氟乙烯及溶剂N-甲基吡咯烷酮超声混合形成均匀的浆料。将一定质量的浆料涂布于尺寸为3.5 cm×2.5 cm的碳纸上,在40 ℃下真空干燥12 h制得工作电极。工作电极上水钠锰矿的质量约为5.0 mg,相同尺寸的空白碳纸作为对电极,饱和甘汞电极作为(SCE)参比电极。重金属离子的电化学去除实验在深圳市新威尔电子有限公司的CT-3008W-5V1A型电池性能测试系统上以多周循环恒流充放电方式进行,循环周数设定为50周,电流密度和电位窗口(vs. SCE)分别为0.1 A·g−1和0—0.9 V。
分别采用Cd(NO3)2、Zn(NO3)2、Pb(NO3)2以及Ni(NO3)2配制含重金属Cd2+、Zn2+、Pb2+与Ni2+的溶液,NaNO3作为背景电解质,浓度为0.1 mol·L−1。采用0.1 mol·L−1 H2SO4和NaOH调节重金属溶液初始pH值为5.0,电化学去除过程中重金属溶液体积为30 mL。单独含0.5 mmol·L−1的Cd2+、Zn2+、Pb2+与Ni2+溶液用于考察不同重金属离子的电化学吸附容量,而浓度均为0.5 mmol·L−1的Cd2+、Zn2+、Pb2+与Ni2+混合溶液用于考察电化学吸附过程中共存重金属离子相互影响。不加电场的断路条件下48 h物理化学吸附实验用于与电化学吸附对比。分别配制0.5 mmol ·L−1的Cd2+与Zn2+、Cd2+与Pb2+、Cd2+与Ni2+、Zn2+与Ni2+的4种混合溶液用于进一步考察不同重金属离子电化学去除过程中竞争作用。为比较水钠锰矿对不同重金属离子的去除速率,控制其在Cd2+、Zn2+、Pb2+与Ni2+的混合溶液中充放电1—65 周。为考察电化学氧化还原程度对重金属离子吸附的影响,在单独和混合重金属离子溶液中分别控制电位窗口为0—0.3 V和0—0.6 V进行50周充放电实验。
-
采用Bruker公司配备铜靶的D8 Advance型X-射线衍射仪(XRD)表征水钠锰矿及电极上产物的晶体结构。采用Hitachi公司的SU8010型场发射扫描电镜(FESEM)观察产物微观形貌。采用Thermo Scientific公司傅里叶变换红外光谱仪(FTIR,Nicolet 8700)分析样品特征官能团。电化学氧化还原反应结束后取出电极并用去离子水冲洗以去除残留溶液。采用Agilent公司原子吸收光谱仪(AAS240FS)测定溶液中重金属离子浓度。采用上海辰华仪器有限公司CHI660E电化学工作站测试水钠锰矿电极在不同重金属溶液中的循环伏安曲线,扫速为0.5 mV·s−1。水钠锰矿的电化学比容量及对重金属的电化学去除能力分别通过公式(1)和(2)计算:
式中,I(A)为放电电流,t(s)为放电时间,m(mg)为电极上水钠锰矿质量,ΔV(V)为电位窗口,Qe(mg·g−1)为电吸附比容量,C0(mg·L−1)为体系中重金属离子初始浓度,Ce(mg·L−1)为电化学吸附反应后重金属浓度,V(mL)为溶液体积。
-
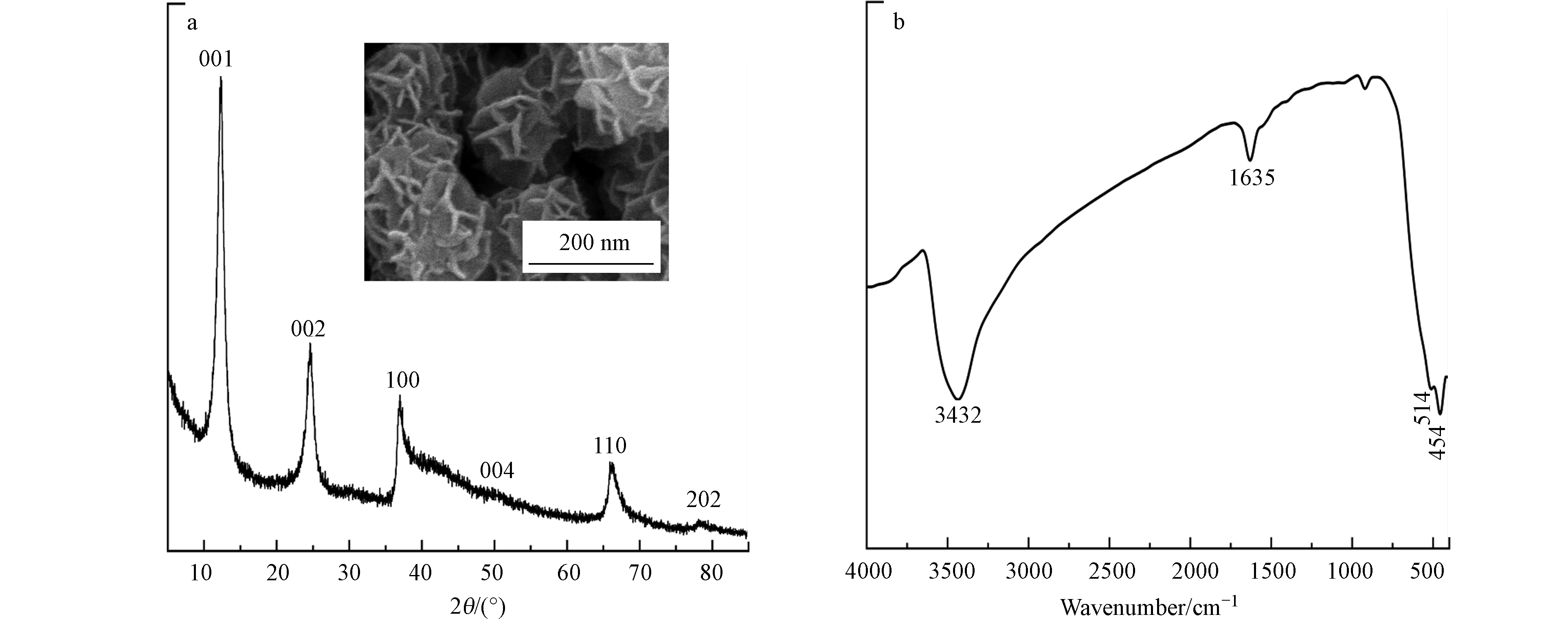
图1a为浓盐酸还原煮沸高锰酸钾所得产物的XRD图谱及FESEM照片。XRD图谱中d值为0.719、0.361、0.242、0.183、0.141、0.122 nm处的衍射峰分别对应水钠锰矿(JCPDS No. 86-0666)的(001)、(002)、(100)、(004)、(110)及(202)晶面。FESEM照片表明,合成水钠锰矿微观形貌为花球状。采用FTIR表征产物特征官能团(图1b),位于454 cm−1和514 cm−1波数处的吸收峰为水钠锰矿的特征吸收峰,主要归因于Mn—O晶格振动,位于1635 cm−1和3432 cm−1处的吸收峰分别可归属为吸附水或结晶水的弯曲振动和伸缩振动[17],这些结果表明合成产物为纯相水钠锰矿。
-
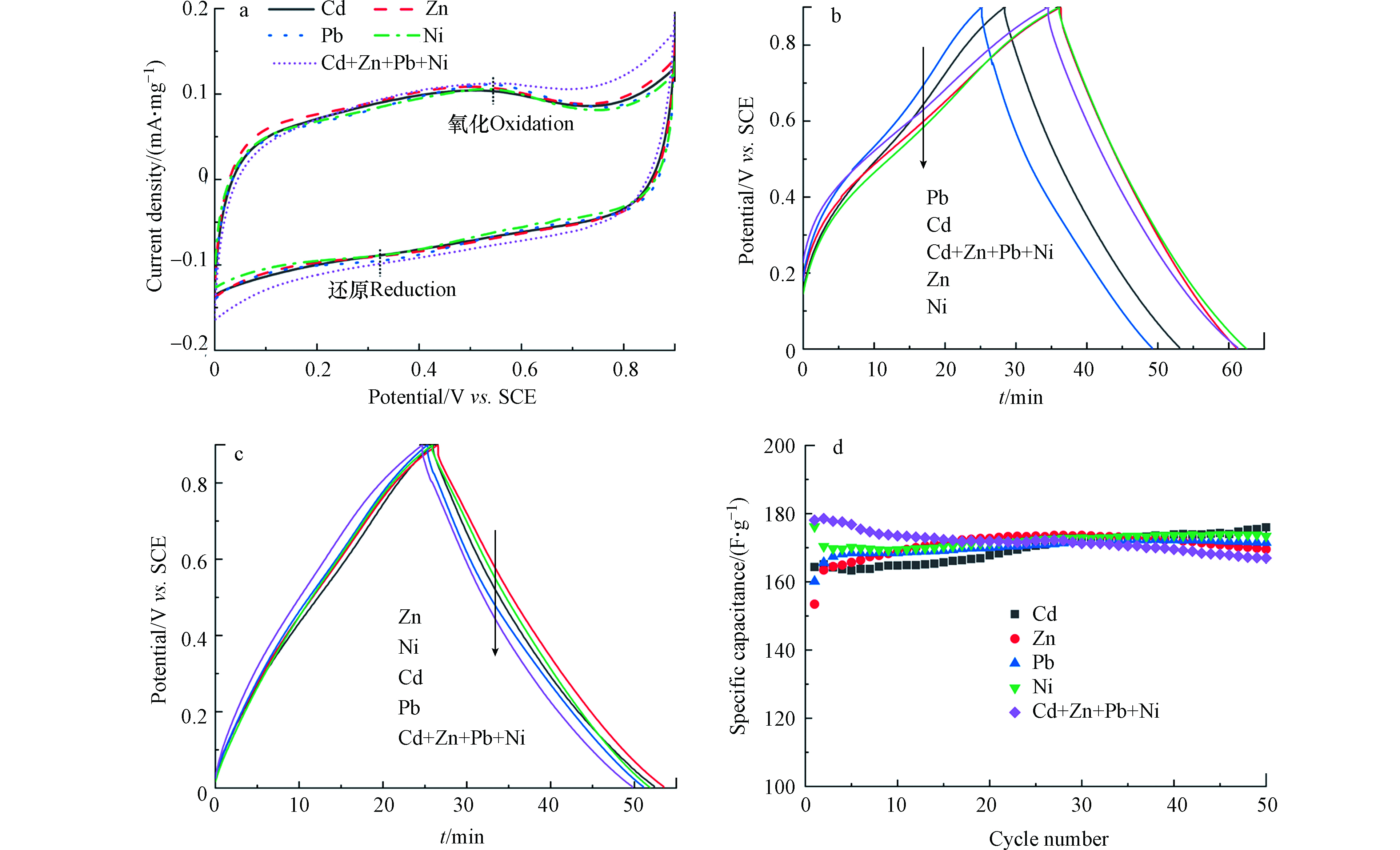
循环伏安法考察重金属离子在水钠锰矿表面的电化学行为(图2a)。在单一重金属离子溶液中,循环伏安曲线基本重合,表明水钠锰矿电化学活性较接近。在重金属离子混合溶液中,循环伏安曲线围成面积较大且偏离矩形,表明水钠锰矿电化学活性增强但氧化还原可逆性降低。循环伏安曲线上出现一对氧化还原峰,位于约0.55 V的氧化电流峰对应Mn(Ⅱ/Ⅲ)到Mn(Ⅳ)的氧化过程,而位于约0.32 V的还原电流峰则对应Mn(Ⅳ)到Mn(Ⅱ/Ⅲ)的还原过程[4]。水钠锰矿电极分别在0.5 mmol·L−1的Cd2+、Zn2+、Pb2+、Ni2+及其混合溶液中进行恒流充放电考察其对单一及多种重金属的去除性能。水钠锰矿电极在含Cd2+、Zn2+、Pb2+与Ni2+单一及混合重金属溶液中首周充放电曲线对称性较差,进一步表明了充放电的不完全可逆性,与循环伏安结果一致;随着充放电进行,充放电曲线较为对称,表明重金属的吸脱附接近平衡(图2b-c)。图2d为不同循环周数放电比容量,水钠锰矿电极在含Cd2+、Zn2+、Pb2+、Ni2+单一重金属溶液中放电比容量相差不大,且稳定在约170 F·g−1;在4种重金属离子混合溶液中初始放电比容量高于单一重金属溶液中的放电比容量,但随着循环周数增加比容量逐渐降低。
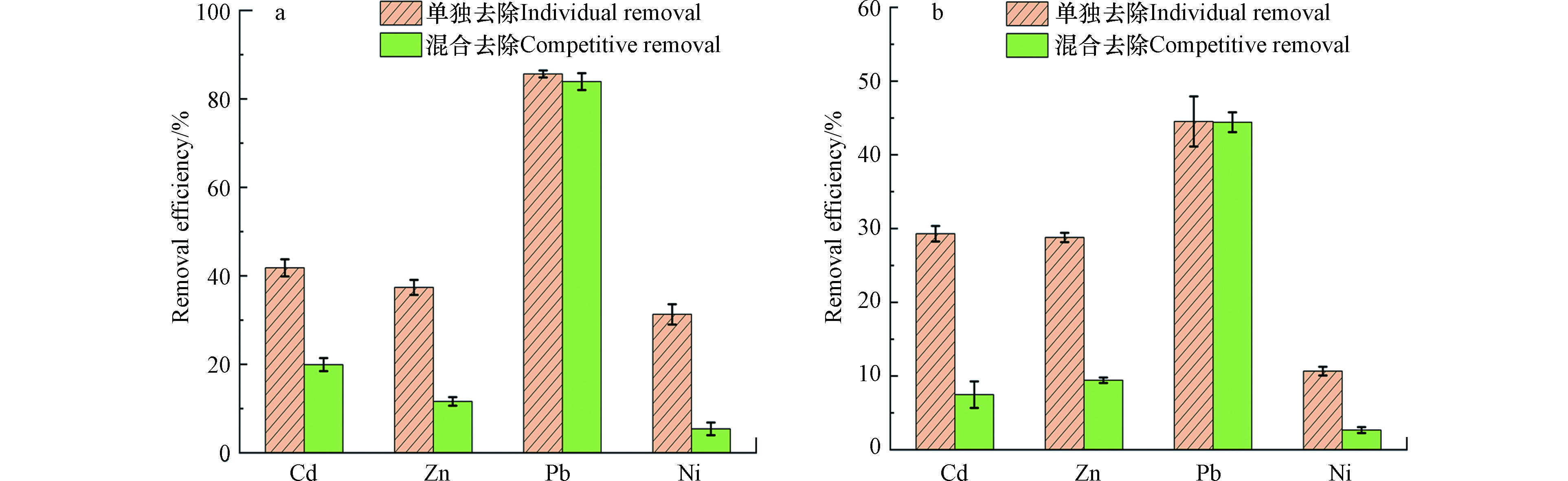
图3为水钠锰矿电极在不同溶液中充放电50周及断路条件下吸附48 h后重金属离子的去除率。在单一重金属溶液中,Cd2+、Zn2+、Pb2+、Ni2+的去除率分别为41.8%、37.2%、85.6%、31.3%。在含有四种重金属离子的混合溶液中,Cd2+、Zn2+、Ni2+的去除率分别下降至19.9%、11.6%、5.4%,而Pb2+的去除效率(83.9%)无明显降低。断路条件下,在单一重金属溶液中,Cd2+、Zn2+、Pb2+、Ni2+的去除率分别为29.3%、28.9%、44.5%、10.7%,在混合重金属溶液中,Cd2+、Zn2+、Ni2+的去除效率分别降低至7.5%、9.4%、2.8%,而Pb2+的去除效率(44.4%)无明显变化。这些结果表明,电化学氧化还原可显著增加水钠锰矿对重金属离子的去除率。水钠锰矿对这几种重金属的电化学吸附去除能力大小顺序为:Pb2+>Cd2+>Zn2+>Ni2+,且它们的电化学吸附过程会相互影响,特别是Pb2+会明显抑制水钠锰矿对Cd2+、Zn2+与Ni2+的吸附。在水钠锰矿吸附重金属过程中同时检测了溶液中Mn2+浓度。电化学吸附时,在含Cd2+、Zn2+、Pb2+或Ni2+的单一溶液中Mn2+释放量分别为29.7、49.6、26.9、35.7 mg·g−1,在混合重金属溶液中Mn2+释放量为69.7 mg·g−1。断路下物理化学吸附时,在含Cd2+、Zn2+、Pb2+、Ni2+的单一溶液中Mn2+释放量分别为7.4、2.5、4.1、0.3 mg·g−1,混合重金属溶液中Mn2+释放量为16.2 mg·g−1。
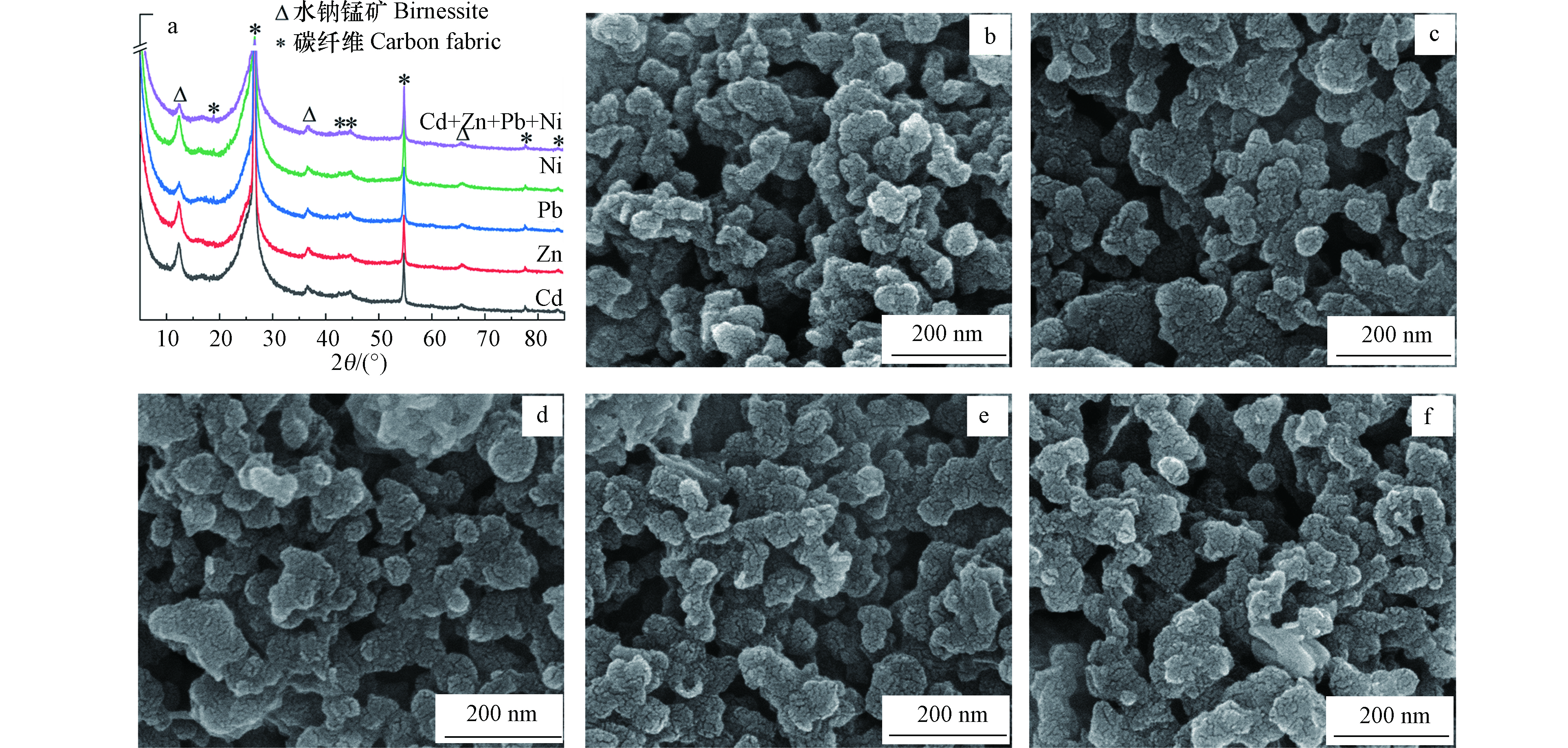
为分析充放电过程中重金属离子富集对水钠锰矿晶体结构的影响,对电化学吸附后的工作电极进行XRD表征(图4a)。XRD图谱显示没有新矿物生成。在含Cd2+、Zn2+、Ni2+的单一重金属溶液中电化学吸附后,水钠锰矿衍射峰强差异不大,而在含Pb2+的单一溶液及混合溶液中电化学吸附后,水钠锰矿(001)晶面衍射峰强度显著降低,表明矿物结晶度减弱。进一步采用FESEM分析重金属离子吸附对水钠锰矿微观形貌的影响(图4b-f)。在不同重金属溶液体系中充放电后,水钠锰矿颗粒有一定程度的溶解,花球状形貌消失。这些结果表明电化学吸附过程中多周循环氧化还原反应伴随着水钠锰矿的溶解再结晶过程。尽管电化学氧化还原过程中水钠锰矿结晶度降低且花球状形貌消失,但其并未转变为其他锰氧化物,这表明其晶体结构稳定性好。
将水钠锰矿电极置于含有Cd2+、Zn2+、Pb2+、Ni2+混合溶液中进行不同周数充放电以比较重金属的电化学去除速率(图5)。在初始阶段,重金属离子的去除率均随充放电循环周数的增加而增加,随后Cd2+、Zn2+、Pb2+、Ni2+的去除率分别在约第10、10、50、5周达到平衡。结果表明水钠锰矿对重金属去除速率有如下顺序:Pb2+>Cd2+≈Zn2+>Ni2+,与电化学去除容量大小顺序基本一致。
重金属阳离子一般以水合离子形式吸附在锰氧化物表面[6]。不同重金属阳离子在水钠锰矿表面的吸附容量主要与它们的一级水解常数有关。一般而言,重金属阳离子的一级水解常数越大,水钠锰矿对其吸附容量越高[6]。因此,水钠锰矿对重金属离子的等温吸附顺序为Pb2+>Zn2+>Cd2+>Ni2+[7,18]。在本工作中,断路条件下水钠锰矿电极对重金属离子的去除率大小顺序为Pb2+>Zn2+≈Cd2+>Ni2+(图3),这可能由于本实验中重金属浓度不高,吸附未达到饱和,导致断路条件下Zn与Cd的去除率相近。氧化锰(MnO2)充放电过程中,可发生可逆氧化还原反应:
$\mathrm{MnO}_{2}+\mathrm{A}^{+}+e^{-} \rightleftharpoons \mathrm{MnO}_{2} \mathrm{A} $ ,A+代表碱金属离子或质子[19]。我们先前研究已发现当溶液中存在重金属离子时,其氧化还原反应将变得不完全可逆,即放电过程中嵌入到水钠锰矿中的重金属离子在随后的充电过程中不能完全被脱附[4,12,14]。在本工作中,溶液中也检测到Mn2+,即有不完全可逆氧化还原反应发生。此外,多周氧化还原过程中,循环溶解再结晶过程也有利于水钠锰矿与重金属离子充分接触(图4),进一步提高吸附去除率。因此,随着充放电周数增加,重金属离子会在电极表面富集(图5)。将水钠锰矿电极置于含两种不同重金属的混合溶液中分别充放电以进一步探究电化学吸附过程中重金属离子之间的相互影响(图6a)。在Cd2+与Zn2+、Cd2+与Pb2+、Cd2+与Ni2+、Zn2+与Ni2+混合溶液中,水钠锰矿电极对相应重金属离子的去除率分别为:38.1%(Cd2+)和21.1%(Zn2+)、27.3%(Cd2+)和81.6%(Pb2+)、41.1%(Cd2+)和10.4%(Ni2+)、25.3%(Zn2+)和12.2%(Ni2+)。由此可知Pb2+对其它3种重金属离子的电化学吸附均有抑制,Cd2+对Zn2+与Ni2+的电化学吸附有抑制,而Zn2+与Ni2+对Cd2+的电化学吸附影响较小;Zn2+与Ni2+之间的电化学吸附会相互抑制。这些结果也证明了水钠锰矿对重金属离子电化学吸附的亲和能力顺序为Pb2+>Cd2+>Zn2+>Ni2+。电化学吸附过程中Mn2+释放量差异不大(图6b)。
不同重金属离子的电化学吸附容量存在差异,其中电化学氧化还原对Pb2+与Ni2+吸附容量提升最显著,它们的去除率分别提高至约无机吸附容量的2倍和3倍。吸附位点也影响重金属阳离子在水钠锰矿上的吸附容量[7]。研究表明重金属阳离子可以三齿共边络合物、三齿共角络合物及嵌入到空位中三种形式吸附在水钠锰矿上,且不同重金属阳离子的吸附位点存在差异[20]。Pb2+可以三齿共角及三齿共边形式吸附在空位上下方,还可以双齿共边形式吸附在水钠锰矿锰氧八面体层边面位点[21],这也导致了水钠锰矿对Pb2+的去除率远高于其它重金属阳离子。Zn2+不能嵌入到水钠锰矿空位中,但可以三齿共角及三齿共边的形式吸附在空位上下方[22]。在pH高于8.0时,Ni2+除了可以吸附在八面体空位上下方,还可进入空位中[23]。我们先前研究发现在一定电位条件下,Ni2+可能会进入水钠锰矿空位中,使其吸附容量增加[18],在充放电条件下也可能存在此反应,使Ni2+的去除率显著增加。因此,水钠锰矿对这几种重金属离子的电化学去除率大小顺序表现为Pb2+>Cd2+>Zn2+>Ni2+。
电化学吸附过程中,Cd2+、Zn2+、Pb2+、Ni2+均可吸附在水钠锰矿空位上下方[20],由于Pb2+的吸附活性最高,导致其吸附在水钠锰矿上后抑制了其他重金属离子的吸附。此外,其他重金属不能吸附在水钠锰矿锰氧八面体层的边面位点[21]。因此,它们的存在对Pb2+去除率影响不大。电化学与等温吸附过程中,水钠锰矿对重金属离子亲和力略有差异。这可能由于在充放电过程中离子的嵌入脱出活性也影响着吸附效果,Cd2+水合离子半径(0.426 nm)小于Zn2+的水合离子半径(0.430 nm)[24],进而Cd2+比Zn2+更易嵌入水钠锰矿层间。
-
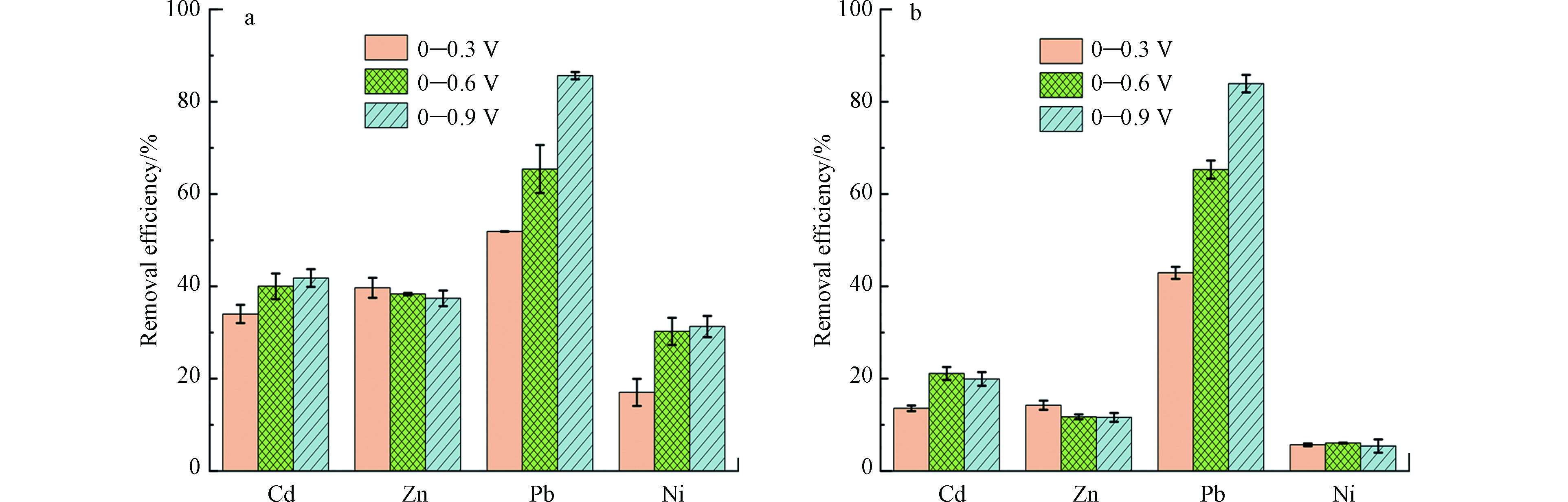
为探究氧化还原程度对水钠锰矿重金属去除率的影响,在0.5 mmol·L−1含单一及混合重金属溶液中恒流充放电50周,电位窗口分别调节为0—0.3、0—0.6 V(vs. SCE)。单独和竞争去除Cd2+、Zn2+和Ni2+时,电位窗口变化对重金属去除率影响不大(图7)。随着电位窗口最大值从0.9降低到0.3 V(vs. SCE),水钠锰矿对Pb2+单独与竞争去除率分别从85.6%和83.9%降低到51.9%和42.9%。
氧化还原程度影响水钠锰矿电化学吸附重金属性能。水钠锰矿在单一及混合重金属溶液中发生Mn(Ⅲ)/Mn(Ⅳ)的氧化与还原电位分别约为0.55 V与0.32 V(图2)。随着电位窗口最大值由0.3 V增加到0.9 V,水钠锰矿充放电反应时间延长,吸附位点较多的Pb2+可充分的吸附在水钠锰矿上,而其它金属离子在短时间就达到饱和(图5),故Pb2+去除效率随电位窗口增大而增加(图7)。在高电位窗口时,水钠锰矿电化学氧化还原反应发生程度加剧,可使Ni2+更容易嵌入到水钠锰矿八面体空位中,增加其去除率。因此,随着电位窗口减小到0—0.3 V,Ni2+去除率明显降低(图7)。
常规物理化学吸附过程中,吸附剂吸附饱和后需进行固液分离及吸附剂的脱附再生。电化学吸附过程中,重金属离子可直接被吸附在电极上,同时可通过电化学方式进行脱附再生;因此,较无机吸附反应,电化学吸附过程具有操作简单的优势[18]。本工作利用锰氧化物中Mn(Ⅳ)与Mn(Ⅱ/Ⅲ)之间的氧化还原反应提高了重金属离子去除容量。在充电过程中吸附的重金属离子可被脱附,尽管该过程需要消耗电能,但重金属离子在放电过程中被去除,这一过程同时可为外界提供电能,也即利用锰氧化物电化学循环氧化还原反应去除重金属离子的部分能耗是可回收的。因此,该研究可望用于废水中重金属的选择性去除及能量回收。
-
电化学吸附过程中,多周不完全可逆的氧化还原反应可显著提升水钠锰矿对单一及混合重金属离子Pb2+、Cd2+、Zn2+和Ni2+的去除容量。电化学去除率大小顺序为Pb2+>Cd2+>Zn2+>Ni2+,与断路条件下水钠锰矿物理化学吸附去除率顺序基本一致。重金属阳离子的水解常数,吸附位点及水合离子半径均可影响其在水钠锰矿上的吸附容量。Pb2+优先被水钠锰矿电化学吸附,使Cd2+、Zn2+、Ni2+的去除率降低。Cd2+对Zn2+和Ni2+吸附有抑制作用,而Zn2+与Ni2+之间互相抑制且Zn2+对Ni2+抑制作用较强。氧化还原程度影响水钠锰矿的对重金属离子的电化学吸附性能。随着电位窗口增加,氧化还原程度加剧,吸附活性高的Pb2+去除率随电位窗口增加而显著提高。
电化学驱动水钠锰矿高效吸附去除混合重金属离子
High-efficiency adsorption removal for multiple heavy metal ions using birnessite under electrochemical drive
-
摘要: 锰氧化物被广泛用作重金属离子吸附剂,电化学调控其氧化还原反应程度可提高重金属吸附容量。然而,多种重金属离子共存时的电化学吸附过程及相互影响机理尚不清楚。本工作采用多周恒流充放电方式研究了水钠锰矿对Cd2+、Zn2+、Pb2+与Ni2+单独及共存时的电化学吸附性能及机理,同时考察了氧化还原程度对吸附性能的影响。结果表明,重金属离子的电化学吸附容量明显高于断路条件下的物理化学吸附容量。在0.5 mmol·L−1单一及多种重金属离子混合溶液中,水钠锰矿电化学吸附容量大小顺序均为Pb2+>Cd2+>Zn2+>Ni2+。在单一重金属离子溶液中,Cd2+、Zn2+、Pb2+和Ni2+的去除率分别为41.8%、37.2%、85.6%与31.3%。多重金属离子共存时,Pb2+的去除率受其他重金属离子影响较小。Pb2+优先占据水钠锰矿上吸附位点阻碍了Cd2+、Zn2+与Ni2+的吸附,导致相应去除率分别降至19.9%、11.6%和5.4%。共吸附过程中,Cd2+对Zn2+与Ni2+有抑制作用,Zn2+与Ni2+互相抑制且Zn2+对Ni2+抑制作用较强。随着水钠锰矿氧化还原程度加剧,Pb2+去除率明显增加,Cd2+、Zn2+和Ni2+的去除率变化不大。该研究可为锰氧化物用于电化学吸附处理重金属污染废水提供基础数据和参考。Abstract: Manganese oxides are widely used as adsorbents for heavy metal ions, and their adsorption performance can be enhanced by the electrochemical control of the redox degree. However, the electrochemical adsorption process and interaction mechanism are still enigmatic at the co-existence of multiple heavy metal ions. In this work, the individual and competitive electrochemical adsorption performance and mechanism of birnessite for Cd2+, Zn2+, Pb2+ and Ni2+ were investigated by multi-cycle galvanostatic charge–discharge, and the effect of redox degree on the electrochemical adsorption performance was also studied. The results indicated that the electrochemical adsorption capacity was much higher than the physicochemical adsorption capacity of birnessite for these heavy metal ions. In the solutions containing 0.5 mmol·L−1 individual or mixed heavy metal ions, the electrochemical adsorption capacity follows the order of Pb2+ > Cd2+ > Zn2+ > Ni2+. The individual electrochemical removal efficiency was 41.8%, 37.2%, 85.6% and 31.3% for Cd2+, Zn2+, Pb2+ and Ni2+, respectively. In the solutions containing mixed heavy metal ions, the electrochemical removal efficiency of Pb2+ seemed not to be remarkably affected by the presence of other heavy mental ions. The preferential occupation of adsorption sites by Pb2+ obviously impended the electrochemical adsorption of Cd2+, Zn2+ and Ni2+ on birnessite, leading to decreases of their removal efficiency to 19.9%, 11.6% and 5.4%, respectively. The presence of Cd2+ inhibited the adsorption of Zn2+ and Ni2+, and the adsorption of Zn2+ and Ni2+ inhibited each other, with Zn2+ exhibiting a stronger inhibitory effect on Ni2+. With increasing redox degree of birnessite, the removal efficiency of Pb2+ significantly increased, while that of Cd2+, Zn2+ and Ni2+ showed little change. This study provides basic data and reference for the application of manganese oxides in electrochemical adsorption of heavy metal contaminated wastewaters.
-
Key words:
- heavy metals /
- manganese oxides /
- electrochemical adsorption /
- redox /
- competitive adsorption
-

-
图 2 水钠锰矿在含有0.5 mmol·L−1单独及混合重金属离子溶液中的循环伏安曲线(a),第1周(b)和第50周(c)的充放电曲线及不同周数的放电比容量(d)
Figure 2. Cyclic voltammograms (a), galvanostatic charge−discharge curves for the first (b) and fiftieth (c) cycle and discharge specific capacitance (d) for birnessite electrode in the solutions containing 0.5 mmol·L−1 individual and mixed heavy metal ions.
图 4 不同重金属溶液中水钠锰矿在电位窗口0—0.9 V(vs. SCE)经50周充放电50周后的XRD图(a)及在含Cd2+(b),Zn2+(c),Pb2+(d),Ni2+(e)的单一溶液和混合溶液(f)中充放电后的FESEM照片
Figure 4. XRD patterns (a) and FESEM images of birnessite electrodes after 50 cycles of charge−discharge at the potential window of 0—0.9 V (vs. SCE) in the solutions containing individual Cd2+ (b), Zn2+ (c), Pb2+ (d), Ni2+ (e) and mixed Cd2+, Zn2+, Pb2+ and Ni2+ (f).
图 6 不同重金属混合溶液中水钠锰矿在电位窗口0—0.9 V(vs. SCE)下经50周充放电后去除效率(a)及释放的Mn2+(b)
Figure 6. Removal efficiency for heavy metal ions (a) and released Mn2+ (b) of birnessite electrodes after adsorption by 50 cycles of charge−discharge at the potential window of 0—0.9 V (vs. SCE) in the solutions containing mixed heavy metal ions.
-
[1] 刘金燕, 刘立华, 薛建荣, 等. 重金属废水吸附处理的研究进展 [J]. 环境化学, 2018, 37(9): 2016-2024. doi: 10.7524/j.issn.0254-6108.2017110105 LIU J Y, LIU L H, XUE J R, et al. Research progress on treatment of heavy metal wastewater by adsorption [J]. Environmental Chemistry, 2018, 37(9): 2016-2024(in Chinese). doi: 10.7524/j.issn.0254-6108.2017110105
[2] ZHOU G, LUO J, LIU C, et al. A highly efficient polyampholyte hydrogel sorbent based fixed-bed process for heavy metal removal in actual industrial effluent [J]. Water Research, 2016, 89: 151-160. doi: 10.1016/j.watres.2015.11.053 [3] 谢厦, 徐应明, 闫翠侠, 等. 酸碱复合改性海泡石亚结构特征及其对Cd(II)吸附性能 [J]. 环境科学, 2020, 41(1): 293-303. XIE X, XU Y M, YAN C X, et al. Substructure characteristics of combined acid-base modified sepiolite and its adsorption for Cd(II) [J]. Environmental Science, 2020, 41(1): 293-303(in Chinese).
[4] LIU L H, TAN W F, SUIB S L, et al. Effective zinc adsorption driven by electrochemical redox reactions of birnessite nanosheets generated by solar photochemistry [J]. ACS Sustainable Chemistry & Engineering, 2018, 6(11): 13907-13914. [5] 马俊平, 赵秋宇, 王晨, 等. 二氧化锰基纳米材料对重金属离子的去除及机理研究进展 [J]. 环境化学, 2020, 39(3): 687-703. doi: 10.7524/j.issn.0254-6108.2019090207 MA J P, ZHAO Q Y, WANG C, et al. Removal of heavy metal ions by manganese dioxide-based nanomaterials and mechanism research: A review [J]. Environmental Chemistry, 2020, 39(3): 687-703(in Chinese). doi: 10.7524/j.issn.0254-6108.2019090207
[6] FENG X H, ZHAI L M, TAN W F, et al. Adsorption and redox reactions of heavy metals on synthesized Mn oxide minerals [J]. Environmental Pollution, 2007, 147(2): 366-373. doi: 10.1016/j.envpol.2006.05.028 [7] WANG Y, FENG X H, VILLALOBOS M, et al. Sorption behavior of heavy metals on birnessite: Relationship with its Mn average oxidation state and implications for types of sorption sites [J]. Chemical Geology, 2012, 292/293: 25-34. doi: 10.1016/j.chemgeo.2011.11.001 [8] LEFKOWITZ J P, ELZINGA, E J. Impacts of aqueous Mn(Ⅱ) on the sorption of Zn(Ⅱ) by hexagonal birnessite [J]. Environmental Science & Technology, 2015, 49(8): 4886-4893. [9] LEFKOWITZ J P, ELZINGA E J. Structural alteration of hexagonal birnessite by aqueous Mn(Ⅱ): Impacts on Ni(Ⅱ) sorption [J]. Chemical Geology, 2017, 466: 524-532. doi: 10.1016/j.chemgeo.2017.07.002 [10] LIU J T, GE X, YE X X, et al. 3D graphene/δ-MnO2 aerogels for highly efficient and reversible removal of heavy metal ions [J]. Journal of Materials Chemistry A, 2016, 4(5): 1970-1979. doi: 10.1039/C5TA08106H [11] 费杨, 阎秀兰, 李永华. 铁锰双金属材料在不同pH条件下对土壤As和重金属的稳定化作用[J]. 环境科学, 2018, 39(3)∶1430–1437, 1435–1437. FEI Y, YAN X L, LI Y H, Stabilization effects of Fe-Mn binary oxide on arsenic and heavy metal cocontaminated soils under different pH conditions[J]. Environmental Science, 2018, 39(3): 1430–1433, 1435–1437 (in Chinese).
[12] LIU L H, LUO Y, TAN W F, et al. Zinc removal from aqueous solution using a deionization pseudocapacitor with a high-performance nanostructured birnessite electrode [J]. Environmental Science:Nano, 2017, 4: 811-823. doi: 10.1039/C6EN00671J [13] YANG X, LIU L H, TAN W F, et al. High-performance Cu2+ adsorption of birnessite using electrochemically controlled redox reactions [J]. Journal of Hazardous Materials, 2018, 354: 107-115. doi: 10.1016/j.jhazmat.2018.04.069 [14] PENG Q C, LIU L H, LUO Y, et al. Cadmium removal from aqueous solution by a deionization supercapacitor with a birnessite electrode [J]. ACS Applied Materials & Interfaces, 2016, 8(50): 34405-34413. [15] 刘坤, 閤明勇, 汤睿, 等. Pb(Ⅱ)、Zn(Ⅱ)、Cu(Ⅱ)在碱性钙基膨润土上的竞争吸附 [J]. 非金属矿, 2019, 42(1): 17-20. doi: 10.3969/j.issn.1000-8098.2019.01.006 LIU K, HE M Y, TANG R, et al. Competitive adsorption of Pb(Ⅱ), Zn(Ⅱ) and Cu(Ⅱ) on alkaline Ca-bentonite [J]. Non-Metallic Mines, 2019, 42(1): 17-20(in Chinese). doi: 10.3969/j.issn.1000-8098.2019.01.006
[16] MCKENZIE R M. The synthesis of birnessite, cryptomelane, and some other oxides and hydroxides of manganese [J]. Mineralogical Magazine, 1971, 38(296): 493-502. doi: 10.1180/minmag.1971.038.296.12 [17] ZHAO W, LIU F, FENG X H, et al. Fourier transform infrared spectroscopy study of acid birnessites before and after Pb2+ adsorption [J]. Clay Minerals, 2012, 47(2): 191-204. doi: 10.1180/claymin.2012.047.2.04 [18] LIU L H, QIU G H, SUIB S L, et al. Enhancement of Zn2+ and Ni2+ removal performance using a deionization pseudocapacitor with nanostructured birnessite and its carbon nanotube composite electrodes [J]. Chemical Engineering Journal, 2017, 328: 464-473. doi: 10.1016/j.cej.2017.07.066 [19] LIU L H, LUO Y, TAN W F, et al. Facile synthesis of birnessite-type manganese oxide nanoparticles as supercapacitor electrode materials [J]. Journal of Colloid and Interface Science, 2016, 482: 183-192. doi: 10.1016/j.jcis.2016.07.077 [20] KWON K D, REFSON K, SPOSITO G. Understanding the trends in transition metal sorption by vacancy sites in birnessite [J]. Geochimica et Cosmochimica Acta, 2013, 101: 222-232. doi: 10.1016/j.gca.2012.08.038 [21] KWON K D, REFSON K, SPOSITO G. Surface complexation of Pb(Ⅱ) by hexagonal birnessite nanoparticles [J]. Geochimica et Cosmochimica Acta, 2010, 74(23): 6731-6740. doi: 10.1016/j.gca.2010.09.002 [22] KWON K D, REFSON K, SPOSITO G. Zinc surface complexes on birnessite: A density functional theory study [J]. Geochimica et Cosmochimica Acta, 2009, 73(5): 1273-1284. doi: 10.1016/j.gca.2008.11.033 [23] PEÑA J, KWON K D, REFSON K, et al. Mechanisms of nickel sorption by a bacteriogenic birnessite [J]. Geochimica et Cosmochimica Acta, 2010, 74(11): 3076-3089. doi: 10.1016/j.gca.2010.02.035 [24] VOLKOV A G, PAULA S, DEAMER D W. Two mechanisms of permeation of small neutral molecules and hydrated ions across phospholipid bilayers [J]. Bioelectrochemistry and Bioenergetics, 1997, 42(2): 153-160. doi: 10.1016/S0302-4598(96)05097-0 -



 下载:
下载: