-
氟喹诺酮类抗生素(fluoroquinolones,FQs)是目前使用量较大的一类合成抗菌药,基本结构为4-氟喹诺酮酸[1]。FQs具有抗菌谱广、杀菌能力强、口服效果吸收率好、与其他抗菌药无交叉耐药性等特点,已成为治疗细菌性疾病最常用药物之一[2-3]。目前,我国每年生产的喹诺酮类抗生素约为3.57×104 t,是应用最广泛的抗生素之一,尤其在畜牧养殖和水产养殖行业的应用更为广泛[4-8]。近年来,随着FQs生产量和使用量的不断增加,环境中检出FQs的报道越来越多。胶州湾海洋沉积物中检测出8种FQs残留,质量分数为0.478~47.545 ng·g−1[9];白洋淀沉积物中检出6种FQs残留,质量分数为nd~52.90 ng·g−1[10];闽江河口区域沉积物中检出6种FQs残留,质量分数为0.03~15.60 ng·g−1[11]。FQs已逐渐成为海洋沉积物中重要的污染物之一[7]。海洋沉积物中残留的FQs通过迁移转化进入到生态系统中,对生态环境及人体健康构成严重威胁[12-13]。因此,FQs在环境中的残留及潜在风险受到国内外专家学者的广泛关注[14-15]。
随着海水养殖技术的日益进步及海水养殖产品需求的不断上涨,我国海水养殖产业得到了迅猛发展。2020年我国海水养殖面积为1.99×106 hm2,海水养殖产品年产量达2.14×107 t,稳居世界第一[16]。随着海产品年产量的不断增加,FQs的投放量不断增加,仅有20%~30%的FQs被利用或吸收,其余均以原形或代谢物的形式排入海洋环境中,通过吸附、沉降作用汇集于底部沉积物[15],造成海洋 FQs 污染[17-19]。目前,已有很多学者对环境中 FQs 开展了研究。这些研究主要集中在水环境[20-28]、饲料[29-30]、食品[31-32]、水产品[33-34]等领域,而对海洋沉积物中FQs及相关化合物的研究较少,很难满足监测监管的需求。
本研究针对海水养殖沉积物中可能存在的13种 FQs,基于SPE-LC-MS/MS技术,建立了一种快速、准确的测定方法,实现了海洋沉积物中13种FQs的同时检测;并对广州某湾区海洋沉积物进行实地检测,以期揭示该地区海水养殖业FQs污染的分布规律,为维护海水安全提供基础数据,为渔用FQs的监管提供参考。
-
标准贮备液包括氟罗沙星(fleroxacin,FLE)、氧氟沙星(ofloxacin,OFL)、培氟沙星(pefloxacin,PEF)、依诺沙星(enoxacin,ENO)、诺氟沙星(norfloxacin,NOR)、环丙沙星(ciprofloxacin,CIP)、恩诺沙星(enrofloxacin,ENR)、达氟沙星(danofloxacin,DAN)、马波沙星(marbofloxacin,MAR)、二氟沙星(difloxacin,DIF)、沙拉沙星(sarafloxacin,SAR)、氟甲喹(flumequine,FLU)和那氟沙星(nadifloxacin,NAD)13种FQs目标物。1种替代物(诺氟沙星-d5)及3种进样内标(恩诺沙星-d5、环丙沙星-d8和13C3-氟甲喹)均购自天津阿尔塔公司,溶剂为甲醇,质量浓度均为100 mg·L−1,在−20 ℃下避光保存。使用5%甲酸−0.05 mmol·L−1甲酸铵和甲醇混合溶液(体积比为 1∶1)稀释成不同浓度的标准工作液。
溶剂耗材包括甲酸(中国北京,迪马科技有限公司)、甲醇(中国上海,霍尼韦尔贸易有限公司)、乙腈(中国上海,霍尼韦尔贸易有限公司)、盐酸(中国衡阳,凯信化工试剂有限公司)、Oasis HLB 固相萃取柱(6 mL, 200 mg,美国,Water公司)、C18液相色谱柱(4.6 mm×100 mm,粒径2.7 μm,中国广州,太伟科技有限公司)、柠檬酸(中国天津,科密欧化学试剂有限公司)、磷酸氢二钠(中国广州,远达新材料有限公司)、乙二胺四乙酸二钠(中国天津,科密欧化学试剂有限公司)、甲酸铵(中国上海,泰坦科技股份有限公司)、0.45 μm 的玻璃纤维膜、注射器及0.22 μm聚醚砜滤膜(中国广州,国凌仪器有限公司)。
-
仪器及设备包括纯水仪(上海,默克)、恒温振荡仪(上海,江星)、离心机(上海,默克)、Fotector plus(PFCs)高通量全自动固相萃取仪(中国,睿科)、MGS-2200氮吹浓缩仪(日本,EYELA公司)、高效液相色谱-三重四极杆串联质谱联用仪(美国,Water公司)、SCQ-1000C超声波清洗仪(上海,声彦)。
-
以前期研究为基础[10],对沉积物中13种FQs检测方法进行优化,建立一种快速准确检测FQs的方法。
称取1.0 g经冷冻干燥(冷冻干燥后沉积物的含水率一般为1% 以下,对后续提取效率影响甚微,故可忽略不计) 研磨过筛后的样品,置于50 mL离心管中,加入 50 ng 替代物混标(诺氟沙星-d5),避光静置老化12 h后,加入10 mL的乙腈和柠檬酸缓冲溶液混合溶液(体积比为 1:1)。在25 ℃恒温条件下,以200 r·min−1的速度振荡10 min,取出离心管,放入低速离心机中,以2 500 r·min−1的速度离心5 min,取上清液,重复萃取1次,合并上清液。然后用超纯水将上清液稀释至500 mL。稀释液经活化后的 HLB 固相萃取柱,富集净化。HLB 柱依次用 6 mL 甲醇、6 mL 水及 6 mL 盐酸水溶液(pH=2) 淋洗活化,样品富集完成后,用 10 mL 0.1% 甲酸甲醇,以 1 mL·min−1 的速度洗脱小柱,将洗脱液收集于试管中。洗脱液经浓缩装置浓缩至尽干,加入 20 ng 进样内标(恩诺沙星-d5、环丙沙星-d8 和13C3-氟甲喹),最后用 0.5%甲酸-5 mmol·L−1 甲酸铵水溶液和甲醇混合溶液(体积比为 1:1)定容至 1.0 mL,涡旋混匀,过 0.22 μm 聚醚砜滤膜,待测。
-
1)色谱条件。色谱柱使用CORTECS® C18柱(4.6 mm×100 mm,粒径2.7 µm,美国,Waters 公司),流动相为0.5%甲酸-5 mmol·L−1甲酸铵水溶液(A相)和甲醇(B相),流速为0.5 mL·min−1,柱温为40 ℃,进样体积为1 μL。梯度洗脱程序为:0~1 min为20%B相;1~11 min为20%~40%B相;11~14 min为40%~95% B相;14~17 min为95%B相;17.0~17.1 min为95%~20% B相。每个梯度完成后平衡2.9 min。
2)质谱条件。离子源为电喷雾电离源;离子源电压为5 500 V;气帘气压力为0.18 MPa;雾化气压力为0.45 MPa;辅助气压力为0.45 MPa;去溶剂温度为550 ℃;检测方式为正离子模式下多反应离子扫描模式。
-
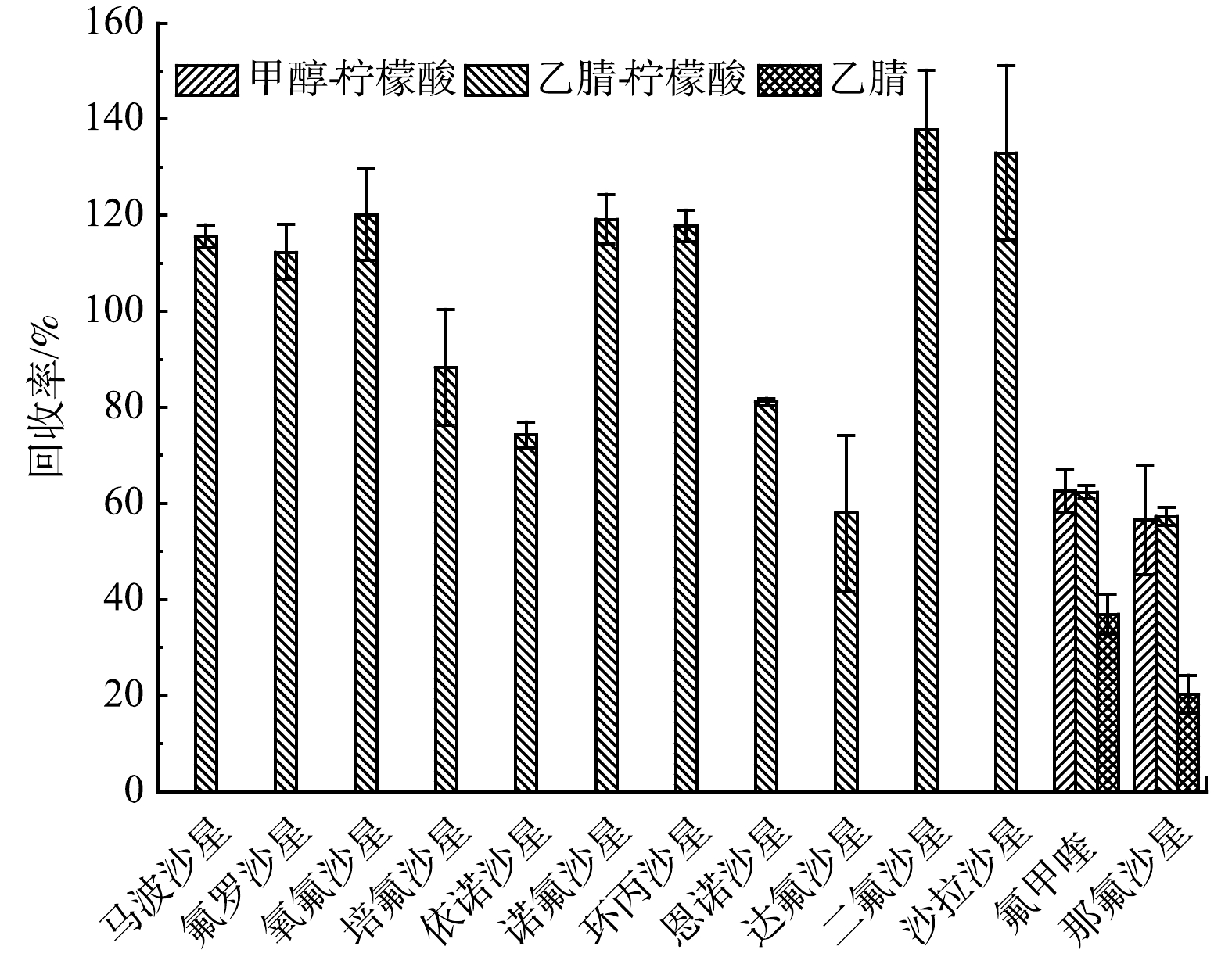
1)提取液的选择。提取液可以通过影响目标物/基质的离子化或质子化程度,从而影响回收效果。为研究不同提取液对FQs的回收效果,本研究对比了乙腈、甲醇-柠檬酸缓冲液混合溶液、乙腈-柠檬酸缓冲液混合溶液3种提取液对质量分数为50 μg·kg−1添加样品的提取效果。如图1所示,当提取液为乙腈时,只检出了氟甲喹和那氟沙星,且回收率仅为20.2%~36.9%;当提取液为甲醇-柠檬酸缓冲溶液混合溶液时,也仅检测出氟甲喹和那氟沙星,但其回收率有明显提升,为56.5%~62.6%;而当提取液为乙腈-柠檬酸缓冲液混合溶液时,检出了13种FQs,回收率为57.3%~126.3%。这可能是因为:乙腈的极性弱于甲醇,组织穿透力强于甲醇,能更有效沉淀大分子,释放更多结合态的FQs[35];加入的EDTA- Mcllvaine缓冲液能有效减少抗生素与金属离子的螯 合,使测定结果更为稳定[36]。因此,本研究最终选择乙腈-柠檬酸缓冲液作为提取液。
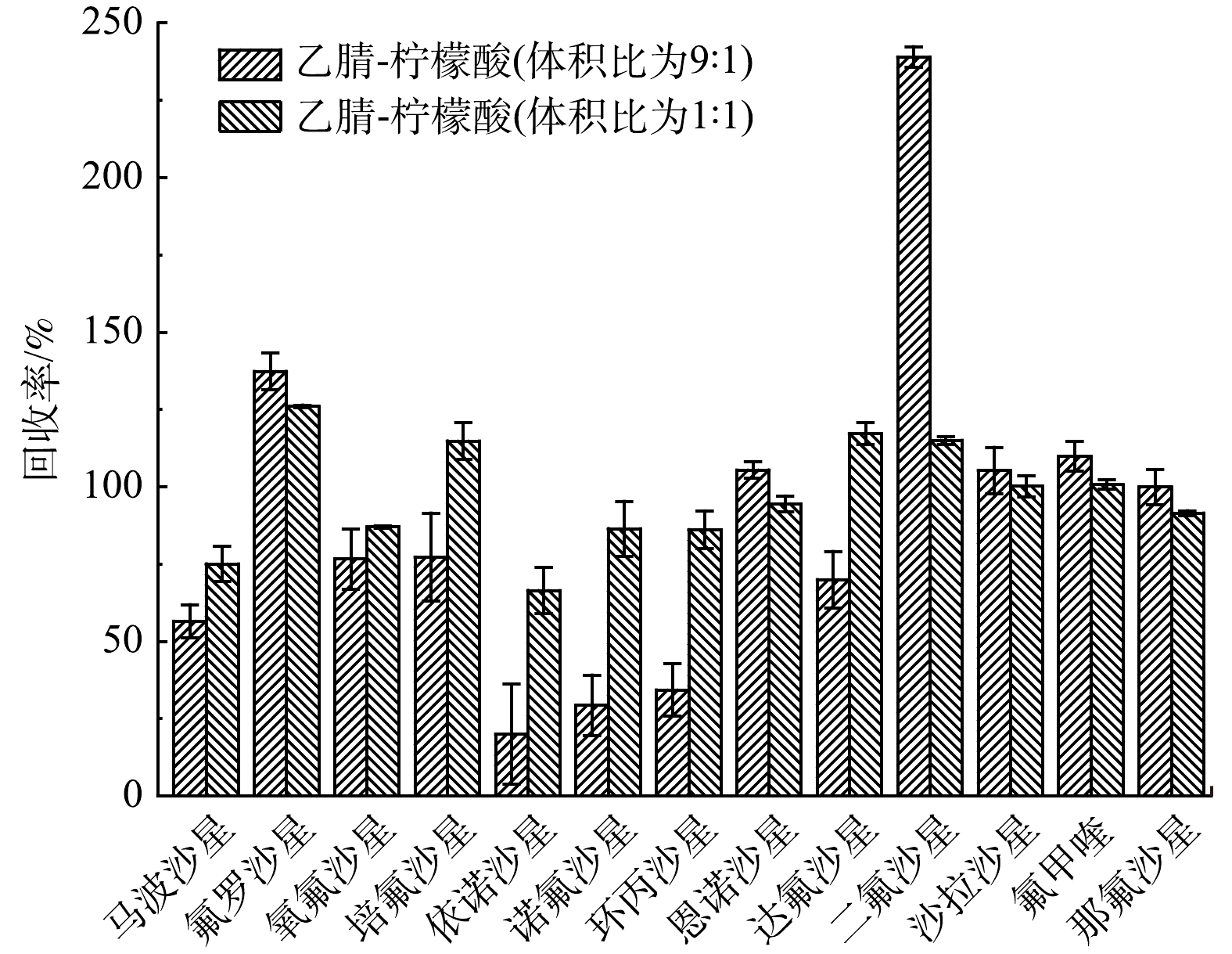
2)提取液比例的优化。不同比例的乙腈和柠檬酸缓冲液的极性和pH值有所不同,对回收效果的影响也不相同。为了研究不同比例的乙腈-柠檬酸缓冲液混合液对FQs的回收效果,本研究对比了乙腈-柠檬酸缓冲液混合溶液(体积比为9:1)、柠檬酸缓冲液和乙腈混合溶液(体积比为1:1)对质量分数为50 μg·kg−1添加样品的提取效果。如图2所示,当乙腈-柠檬酸缓冲液混合溶液体积比为9:1时,除二氟沙星外,12种FQs的回收率为19.9%~137.3%,相对标准偏差为2.7%~16.2%。二氟沙星的回收率偏高原因可能是:乙腈含量过高,振荡时提取液与沉积物不能完全混合,出现分层;此外乙腈含量高时,提取的有机杂质会更多,干扰分析结果,影响回收效果;当柠檬酸缓冲液和乙腈混合溶液体积比为1:1时,13种FQs的回收率为66.0%~126%,相对标准偏差为0.3%~8.8%,基本满足检测分析要求。因此,本研究最终选择体积为1:1的乙腈和柠檬酸缓冲液混合溶液作为提取液进行萃取。
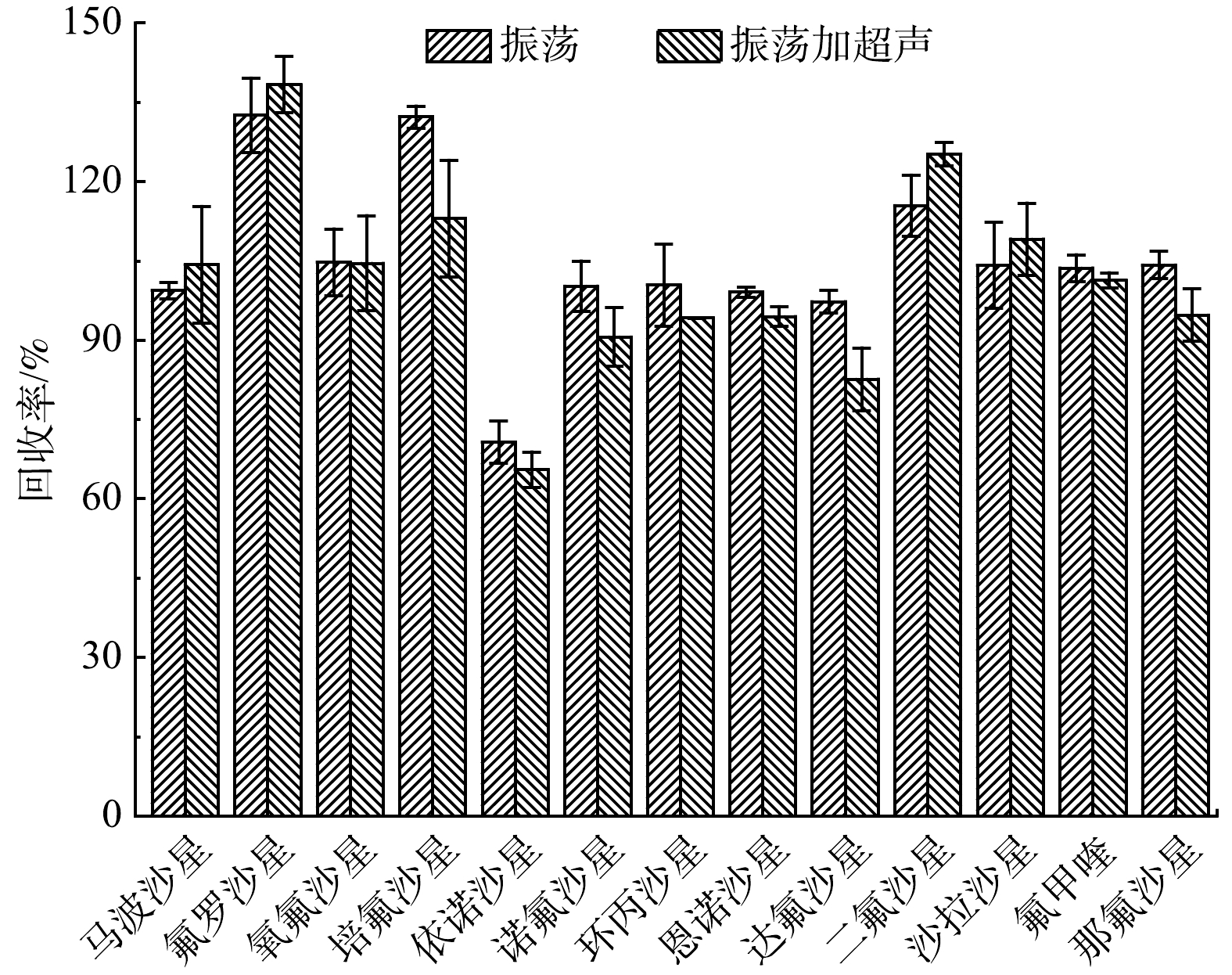
3)萃取方式的选择。为考察不同萃取方式对FQs的回收效果,本研究将直接进行恒温振荡提取与先进行恒温振荡再进行超声提取2种方式进行对比,质量分数为50 μg·kg−1添加样品的提取效果如图3所示。可以看出,当采取恒温振荡萃取时,13种FQs的回收率为70.7%~132.5%,相对标准偏差为0.9%~7.7%;当先进行恒温振荡再进行超声时,13种FQs的回收率为65.5%~138.4%,相对标准偏差为0.05%~11.0%。综上可知,恒温振荡和恒温振荡加超声萃取2种萃取方式对FQs的萃取效果相当,且基本满足检测分析要求。考虑到前处理时间和仪器成本,本研究最终选择采用恒温振荡的方式对样品进行提取。
4)恒温振荡时间的选择。一般来说,恒温振荡时间越长,提取液与样品混合越充分,回收率越高。为研究恒温振荡时间对FQs的回收效果的影响,本研究对比了恒温振荡时间10、20、30 min对质量分数为50 μg·kg−1添加样品的提取效果。如图4所示,当恒温振荡10 min时,13种FQs的回收率为74.4%~136.1%,相对标准偏差为2.1%~32.1%;当恒温振荡20 min时,13种FQs的回收率为65.7%~143.4%,相对标准偏差为0.1%~6.8%;当恒温振荡30 min时,13种FQs的回收率为62.9%~134.4%,相对标准偏差为0.9%~12.7%。综上可知。不同恒温振荡时间对13种FQs回收率的影响不大。当振荡时间为20 min时,相对标准偏差显著低于10 min和30 min时的相对标准偏差,因此,本研究最终选择恒温振荡时间为20 min。
5)恒温振荡温度的选择。为考察不同恒温振荡温度对FQs的回收效果,本研究对比了恒温温度15、25 、35 ℃对质量分数为50 μg·kg−1添加样品的提取效果。如图5所示,当恒温振荡温度为15 ℃时,13种FQs的回收率为72.0%~144.5%,相对标准偏差为0.3%~20.4%;当恒温振荡温度为25 ℃时,13种FQs的回收率为67.5%~137.1%,相对标准偏差为0.4%~6.6%;当恒温振荡温度为35 ℃时,13种FQs的回收率为70.6%~149.4%,相对标准偏差为0.9%~5.7%。结果表明,当恒温振荡温度为25 ℃时,FQs的回收效果最佳,因此,本研究最终选择恒温振荡温度为25 ℃。
固相萃取的其他条件 (如固相萃取柱、上样流速、洗脱溶液等) 可参考丁紫荣等[37]建立的养殖废水中17种氟喹诺酮类抗生素的检测方法。
-
1)色谱条件的选择和优化。FQs 多为两性物质,具有一定的水溶性。已有研究[38-39]表明,C18柱适于FQs残留的分析,因此,本研究对比了 Kinetex-C18®(100 mm×3.0 mm×2.6 μm)(A柱)、 XTEERRA-C18® MS C18 (100 mm×2.1 mm×3.5 μm)(B柱) 和CORTECS® C18(100 mm×4.6 mm×2.7 μm)(C柱)3 种不同粒径的C18柱的分离效果。结果表明,CORTECS® C18对 13 种FQs 的分离效果、峰形和响应强度显著好于其他两款柱子,故选CORTECS® C18作为分离色谱柱。考虑到FQs性质非常相似,出峰时间相对较为紧密,故选用洗脱效果较弱的甲醇,对其分离效果会更好,在流动相中加入适当的有机酸或缓冲盐,不仅可提高目标物的离子化效率,也可提高分析方法的灵敏度。因此,实验还对比了0.5% 甲酸-5 mmol·L−1 甲酸铵和甲醇作为流动相时的分离效果,发现峰型、灵敏度、信号强度均较为理想。因此,本研究最终选择0.5% 甲酸-5 mmol·L−1 甲酸铵和甲醇作为流动相。
2)离子源参数的选择和优化。气流量是色谱条件优化的一个重要参数,一般来说,气流量越大,耗气量越大,离子化越充分;而气流量过大,许多目标物被吹走,进入四极杆有效离子数越少,造成回收率偏低。为筛选出最佳的气流量,本研究比较了不同气流量的影响效果。结果表明,采用不同气流量时,13种FQs的峰形、灵敏度、信号强度均满足检测要求,考虑到用气成本,因此,本研究最终选择采用600 mL·min−1气流量进行样品检测。
3)质谱条件的选择和优化。配制质量浓度为1.0 mg·L−1的FQs、内标化合物和替代物的混合标准溶液,在正离子模式下,用直接注射进样方式扫描并优化母离子/子离子特征离子对,并优化其相应的锥孔电压、碰撞电压等其他参数,利用获取的全部特征离子及离子间的丰度比进行定性分析,以丰度最高的特征离子响应与浓度的关系进行定量分析,质谱优化参数结果如表1所示。
-
1)方法的检出限和定量关系。 将 13种 FQs 的 200 μg·L−1 标准溶液按梯度稀释,梯度质量浓度分别为0.5、1、2、5、10、20、50、 100 μg·L−1。用已优化好的色谱条件和质谱条件进行测定,内标法定量。以 13种 FQs 的质量浓度为横坐标,定量离子的峰面积为纵坐标,绘制标准曲线。结果表明,13 种 FQs 在 0.5~200 μg·L−1 内线性关系良好,R2>0.99。根据环境监测分析方法中的标准制修订技术导则,对检出限为 3~5 倍质量浓度的样品进行 7 次平行测定,计算测定结果的标准偏差(SD)。方法检出限(LOD)为 3.143 倍的 SD,定量限(LOQ)为 4 倍的 LOD。根据计算结果,LOD 为 0.003~0.03 μg·kg−1,LOQ 为0.012~0.12 μg·kg−1。
2)方法的精密度。用石英砂进行空白基质加标回收实验,加标质量分数分别设置为 1 μg·kg−1和 10 μg·kg−1,每个质量分数水平做 7 个重复样品,同时设置 7 个空白样品。按第 1.3 节中的步骤对样品进行处理,以考察方法的总体回收率、重现性是否达到检测分析要求。如表2 所示,当添加量为 1 μg·kg−1时,13 种 FQs 的平均回收率为73.5%~124.6%,RSD 为1.5%~9.7%;当添加量为 10 μg·kg−1 时,平均回收率为67.5%~118.5%,RSD 为1.0%~4.5%。此外,本研究还以广州某湾区沉积物为基质,设置了7个基质加标实验,加标质量分数为1.0 μg·kg−1和50 μg·kg−1。如表3所示,背景样品除氧氟沙星和诺氟沙星2种目标物检出质量浓度较高外,其他目标物的检出质量浓度均较低,影响较小。加标样品13种FQs的平均回收率分别为64.4%~142.8% 和 67.7%~140.2%,RSD分别为2.2%~17.9% 和 1.4%~5.1%。
-
为检验本研究建立的检测分析方法,按照《近岸海域环境监测技术规范 第四部分 近岸海域沉积物监测》 (HJ 442.3-2020) [40],采集广州近岸海域某湾区沉积物样品,按照建立的分析方法对15个采样点样品中的FQs的残留进行分析。测定结果表明,共检测到 6 种FQs,其中氧氟沙星检出质量分数为0.7 μg·kg−1,培氟沙星检出质量分数为1.6 μg·kg−1,诺氟沙星检出质量分数为0.6 μg·kg−1,环丙沙星检出质量分数为0.7 μg·kg−1,恩诺沙星检出质量分数为0.6 μg·kg−1 ,达氟沙星检出质量分数为0.6 μg·kg−1。
-
1)本研究建立了一种快速、准确测定海洋沉积物中13种FQs的固相萃取-高效液相色谱-三重四极杆串联质谱分析方法,实验结果表明13种FQs的线性关系良好,且拟合度均大于0.999 9。
2)固相萃取-高效液相色谱-三重四极杆串联质谱分析方法样品前处理步骤简单,选择性好,方法的准确度和精密度均可满足海洋沉积物中13种FQs残留分析和风险评估的需求。
3)在采集的广东某海湾海洋沉积物样品中,检测出6种不同含量的FQs,其中培氟沙星检出质量分数最高,为1.6 μg·kg−1,氧氟沙星、环丙沙星和恩诺沙星质量分数次之,为0.7 μg·kg−1。
用固相萃取-高效液相色谱-三重四极杆串联质谱法测定海洋沉积物中13种氟喹诺酮类抗生素
Determination of 13 fluoroquinolones antibiotics in marine sediments using LC-MS/MS coupled with solid phase extraction
-
摘要: 为进一步探索海洋沉积物中氟喹诺酮类抗生素的污染情况,基于固相萃取-高效液相色谱-三重四极杆串联质谱(SPE-LC-MS/MS)技术,建立了海洋沉积物中 13 种FQs的测定方法;采用高效液相色谱-三重四极杆串联质谱多反应监测离子模式(MRM)对FQs进行分离检测。结果表明:在优化实验条件下,13种FQs的质量浓度为0.50~100 μg·L−1,目标化合物峰面积与内标物质峰面积之比与质量浓度的线性关系良好(R2>0.99),方法检出限为0.003~0.03 μg·kg−1;在加标量为1 μg·kg−1和10 μg·kg−1时,空白加标的平均回收率为73.5%~124.6%和67.5%~118.5%,相对标准偏差(RSD)为1.0%~9.7%(n=7);以海洋沉积物为基质,13种目标物的加标回收率为67.7%~142.4%,RSD小于10.2%(n=6);使用该方法对广州某湾区海洋沉积物中 13 种 FQs 的残留量进行了实地检测,培氟沙星质量分数最高,为1.6 μg·kg−1,氧氟沙星、环丙沙星和恩诺沙星质量分数次之,为0.7 μg·kg−1。该方法实现了对海洋沉积物中 13种 FQs 的同时检测,具有快速、准确等优点,适用于海洋沉积物中13种FQs的测定。本研究成果可为海洋生态环境保护提供数据基础及技术支撑。
-
关键词:
- 固相萃取-高效液相色谱-三重四极杆串联质谱 /
- 海洋沉积物 /
- 氟喹诺酮类抗生素 /
- 方法优化
Abstract: In order to explore the pollution status of FQs in marine sediments, a method was developed for the determination of 13 target fluoroquinolones antibiotics (FQs) in marine sediments by liquid chromatography-triple quadruple tandem mass spectrometry coupled with solid phase extraction (SPE-LC-MS/MS). All FQs were isolated and quantified by LC-MS/MS under multi-reaction monitoring (MRM) mode. Results showed that under the optimal conditions, the mass concentrations of all 13 targets were 0.5~100 μg·L−1, and a good linear relation occurred between above concentration and the peak area ratio of target compound to internal control standard compound with correlation coefficients higher than 0.99, the detection limit (MDL) of this method was 0.003~0.03 μg·kg−1.The average recovery rates of blank spiking were in the ranges of 73.5%~124.6% and 67.5%~118.5% with the relative standard deviations (RSDs) from 1.0% to 9.7% (n=7) with two spiked levels of 1.0 and 10 μg·kg−1. The average recoveries of 13 FQs with spiking in the marine sediments in the Pearl River estuary samples were 67.7%~142.4% with RSDs < 10.2%(n=6). This method was used to detect 13 kinds of FQs residues in marine sediment of a bay area in Guangzhou, pefloxacin showed the highest mass fraction of 1.6 μg·kg−1, ofloxacin, ciprofloxacin and enrofloxacin were following with the mass fraction of 0.7 μg·kg−1. The method could rapidly and accurately detect 13 kinds of FQs in marine sediments at the same time, and was suitable for the determination of 13 FQs in marine sediments. The research results can provide data basis and technical support for marine ecological environment protection. -

-
表 1 目标化合物、替代物及内标物的多离子反应监测条件
Table 1. Multiple ion reaction monitoring conditions for target compound, surrogate and internal standard
化合物 质荷比(m/z) 锥孔电压/V 母离子碰撞
电压/V定量(定性)
离子碰撞电压/V定量内标 母离子 定量离子 定性离子 氟甲喹 262.1 202 244.1 56 27 45 13C3-氟甲喹 诺氟沙星 320.2 276.2 233.1 101 25 35 环丙沙星d8 依诺沙星 321.1 303.1 232.1 61 29 49 环丙沙星d8 环丙沙星 332.1 314.1 288.1 81 29 27 环丙沙星d8 培氟沙星 334.2 316 290.1 76 29 27 环丙沙星d8 达氟沙星 358.2 340.2 82.1 76 33 73 恩诺沙星-d5 恩诺沙星 360.2 316.1 245.1 76 27 37 恩诺沙星-d5 那氟沙星 361.2 343.2 283.1 85 35 50 13C3-氟甲喹 氧氟沙星 362.2 318.2 261.1 76 27 39 恩诺沙星-d5 马波沙星 363.1 72.1 320.1 80 46 23 环丙沙星d8 氟罗沙星 370.1 326.1 269.1 76 27 37 恩诺沙星-d5 沙拉沙星 386.1 342.1 299.1 106 27 39 恩诺沙星-d5 二氟沙星 400.2 356.2 299.1 81 29 39 恩诺沙星-d5 诺氟沙星-d5 325.2 281.2 238.1 86 25 35 环丙沙星d8 恩诺沙星-d5 365.2 321.2 347.2 81 29 31 — 环丙沙星-d8 340.2 322.1 296.1 91 31 27 — 13C3-氟甲喹 265.1 247.1 205.1 46 25 45 — 表 2 13 种 FQs 化合物的石英砂加标回收率(n=7)及相对标准偏差
Table 2. Recovery rate (n=7)and RSD of 13 fluoroquinolones antibiotics in quartzite
化合物 添加FQs质量分数/
(μg·kg−1)平均
回收率/%RSD/% 化合物 添加FQs质量分数/
(μg·kg−1)平均
回收率/%RSD/% 氟罗沙星 1.0 80.9 4.5 达氟沙星 1.0 91.3 6.3 氟罗沙星 10 84.9 1.6 达氟沙星 10 88.3 1.5 氧氟沙星 1.0 90.7 2.3 马波沙星 1.0 94.4 2.4 氧氟沙星 10 92.8 2.1 马波沙星 10 91.1 1.8 培氟沙星 1.0 88.6 2.5 二氟沙星 1.0 91.2 8.5 培氟沙星 10 79.3 1.0 二氟沙星 10 86.6 3.1 依诺沙星 1.0 73.5 8.6 沙拉沙星 1.0 85.3 5.9 依诺沙星 10 67.5 1.3 沙拉沙星 10 86.6 2.0 诺氟沙星 1.0 88.9 3.7 氟甲喹 1.0 79.6 5.3 诺氟沙星 10 83.4 2.1 氟甲喹 10 86.0 1.3 环丙沙星 1.0 88.7 6.2 那氟沙星 1.0 88.2 9.7 环丙沙星 10 87.07 4.5 那氟沙星 10 96.7 3.5 恩诺沙星 1.0 85.0 3.5 恩诺沙星 10 89.4 3.0 表 3 13 种 FQs 化合物的沉积物加标回收率(n = 6)及相对标准偏差
Table 3. Recovery rate(n = 6)and RSD of 13 fluoroquinolones antibiotics in deposit sediment
化合物 背景样品残留
质量分数/(μg·kg−1)添加质量分数/
(μg·kg−1)平均回收率/% RSD/% 氟罗沙星 0.19 1.0 142.4 2.9 氟罗沙星 0.19 50 140.2 4.4 氧氟沙星 20.23 1.0 139.6 2.9 氧氟沙星 20.23 50 113.7 5.1 培氟沙星 0.25 1.0 79.7 9.2 培氟沙星 0.25 50 116.9 2.8 依诺沙星 0 1.0 90.0 10.2 依诺沙星 0 50 67.7 4.3 诺氟沙星 11.50 1.0 101.3 7.5 诺氟沙星 11.50 50 91.6 4.1 环丙沙星 3.45 1.0 97.0 7.9 环丙沙星 3.45 50 97.7 4.0 恩诺沙星 3.01 1.0 97.2 5.0 恩诺沙星 3.01 50 95.8 1.8 达氟沙星 0.17 1.0 99.7 5.3 达氟沙星 0.17 50 94.6 5.1 马波沙星 0.07 1.0 84.8 8.2 马波沙星 0.07 50 107.4 4.4 二氟沙星 0 1.0 126.7 2.2 二氟沙星 0 50 136.1 1.5 沙拉沙星 0 1.0 139.7 2.8 沙拉沙星 0 50 114.2 3.3 氟甲喹 0.19 1.0 97.8 3.3 氟甲喹 0.19 50 100.8 1.4 那氟沙星 0.11 1.0 104.0 7.4 那氟沙星 0.11 50 88.8 2.3 -
[1] LESHER G Y, FROELICH E J, GRUETT M D, et al. 1,8-naphthyridine derivatives. A new class of Chemotherapeapeutic agents[J]. Medicinal Chemistry, 1962, 91(91): 1063-1065. [2] VAN DOORSLAER X, DEWULF J, VAN LANGENHOVE H, et al. Fluoroquinolone antibiotics: An emerging class of environment micropollutants[J]. Science of the total environment, 2014, 500-501: 250-269. doi: 10.1016/j.scitotenv.2014.08.075 [3] TUFA R A, PINACHO D G, PASCUAL N, et al. Development and validation of an enzyme linked immunosorbent assay for fluoroquinolones in animal feed[J]. Food Control, 2015, 57: 195-201. doi: 10.1016/j.foodcont.2015.04.015 [4] GAO H, ZHANG L X, LU Z H, et al. Complex migration of antibiotic resistance in natural aquatic environments[J]. Environment Pollution, 2018, 232: 1-9. doi: 10.1016/j.envpol.2017.08.078 [5] AUST M O, GODLINSKI F, TRAVIS G R, et al. Distribution of sulfamethazine, chlortetracycline and tylosin in manure and soil of Canadian feedlots after subtherapeutic use in cattle[J]. Environmental Pollution, 2008, 156(3): 1243-1251. doi: 10.1016/j.envpol.2008.03.011 [6] LIU X, STEELE J C, MENG X Z. Usage, residue, and human health risk of antibiotics in Chinese aquaculture: A review[J]. Environmental Pollution, 2017, 223: 161-169. doi: 10.1016/j.envpol.2017.01.003 [7] ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49: 6772-6782. [8] XU W H, ZHANG G, ZOU S C, et al. Determination of selected antibiotics in the Victoria Harbour and the Pearl River, South China using high-performance liquid chromatography-electrospray ionization tandem mass spectrometr[J]. Environmental Pollution, 2007, 145(3): 672-679. doi: 10.1016/j.envpol.2006.05.038 [9] 刘珂. 胶州湾典型海岸带沉积物中喹诺酮抗生素时空分布特征及风险评价[D]. 青岛: 青岛大学, 2018. [10] 王同飞, 张伟军, 李立青, 等. 白洋淀清淤示范区沉积物中抗生素和多环芳烃的分布特征与风险评估[J]. 环境科学, 2021, 42(11): 5303-5311. doi: 10.13227/j.hjkx.202103061 [11] 刘四光, 张乐蒙, 李赫男, 等. 闽江河口区沉积物中的抗生素分布特征及生态风险评价[J]. 应用海洋学学报, 2020, 39(2): 162-171. doi: 10.3969/J.ISSN.2095-4972.2020.02.002 [12] GONZALEZ-PLEITER M, GONZALO S, RODEA-PALOMARES I, et al. Toxicity of five antibiotics and their mixtures towards photosynthetic aquatic organisms: Implications for environmental risk assessment[J]. Water Research, 2013, 47(6): 2050-2064. doi: 10.1016/j.watres.2013.01.020 [13] PADHYE L P, YAO H, KUNG'U F T, et al. Year-long evaluation on the occurrence and fate of pharmaceuticals, personal care products, and endocrine disrupting chemicals in an urban drinking water treatment plant[J]. Water Research, 2014, 51: 266-276. doi: 10.1016/j.watres.2013.10.070 [14] 张运尚, 杜加茹, 王伟东, 等. 氟喹诺酮类药物残留限量及检测技术研究进展[J]. 中国畜牧杂志, 2021, 57(4): 39-44. doi: 10.19556/j.0258-7033.20200516-05 [15] 柴丽月, 柳海, 梁芹芹, 等. 宁波市水产品中氟喹诺酮类药物残留现状分析及对策[J]. 检验检疫刊, 2020, 30(1): 25-27. [16] 农业农村部渔业渔政管理局. 2021年全国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021. [17] AXLER R, TIKKANEN C, MCDANOLD M, et al. Water quality issues as sociated with aquaculture: A case study in mine pit lakes[J]. Water Environment Research, 1996, 68: 995-1011. doi: 10.2175/106143096X128027 [18] MATSUI Y, OZU T, INOUE T, et al. Occurrence of a veterinary antibiotic in streams in a small catchment area with livestock farms[J]. Desalination, 2008, 226(1/2/3): 215-221. [19] CAMPAGNOLOA E R, JOHNSON K R, KARPATIA A, et al. Antimicrobial residues in animal waste and water resources proximal to large-scale swine and poultry feeding operations[J]. Science of the Total Environment, 2002, 299(1/2/3): 89-95. [20] HERRERA-HERRERA A V, HERNNDEZ-BORGES J, BORGES-MIQUEL T M, et al. Dispersive liquid-liquid microextraction combined with ultra-high performance liquid chromatographyfor the simultaneous determination of 25 sulfonamide and quinolone antibiotics in water samples[J]. Pharmaceutical and Biomedical Analysis, 2013, 75: 130-137. doi: 10.1016/j.jpba.2012.11.026 [21] HERRERA-HERRERA A V, HERN NDEZ-BORGES J, BORGES-MIQUEL T M, et al. Dispersive liquid-liquid microextraction combined with nonaqueous capillary electrophoresis for the determination of fluoroquinolone antibiotics in waters[J]. Electrophoresis, 2010, 31(20): 3457-3465. [22] RODRIGUEZ E, NAVARRO-VILLOSLADA F, BENITO-PENA E, et al. Multiresidue determination of ultratrace levels of fluoroquinolone antimicrobials in drinking and aquaculture water samples by automated online molecularly imprinted solid phase extraction and liquid chromatography[J]. Analytical Chemistry, 2011, 83(6): 2046-2055. doi: 10.1021/ac102839n [23] GROS M, RODRGUEZ-MOZAZ, BARCEL D. Fast and comprehensive multi-residue analysis of a broad range of human and veterinary pharmaceuticals and some of their metabolites in surface and treated waters by ultra-high-performance liquid chromatography coupled to quadrupole-linear ion trap tandem mass spectrometry[J]. Journal of Chromatography A, 2012, 1248: 104-121. doi: 10.1016/j.chroma.2012.05.084 [24] ZHOU J L, MASKAOUI K, LUFADEJU A. Optimization of antibiotic analysis in water by solid-phase extraction and high performance liquid chromatography-mass spectrometry/mass spectrometry[J]. Analytica Chimica Acta, 2012, 731: 32-39. doi: 10.1016/j.aca.2012.04.021 [25] DORIVAL-GARC N, ZAFRA-G MEZ A, CANTARERO S, et al. Simultaneous determination of 13 quinolone antibiotic derivatives in wastewater samples using solid-phase extraction and ultra performance liquid chromatography-tandem mass spectrometry[J]. Microchemical Journal, 2013, 106: 323-333. doi: 10.1016/j.microc.2012.09.002 [26] PRIETO A, SCHRADER S, BAUERC, et al. Synthesis of a molecularly imprinted polymer and its application for microextraction by packed sorbent for the determination of fluoroquinolone related compounds in water[J]. Analytica Chimica Acta, 2011, 685(2): 146-152. doi: 10.1016/j.aca.2010.11.038 [27] HUANG X J, QIU N N, YUAN D X, et al. Preparation of a mixed stir bar for sorptive extraction based on monolithic material for the extraction of quinolones from wastewater[J]. Journal of Chromatography A, 2010, 1217(16): 2667-2673. doi: 10.1016/j.chroma.2009.09.072 [28] RUSU A, HANCU G, V LGYI G, et al. Separation and determination of quinolone antibacterials by capillary electrophoresis[J]. Journal of Chromatographic Science, 2014, 52(8): 919-925. doi: 10.1093/chromsci/bmt107 [29] 郝燕娟, 李汉敏, 叶卓霖, 等. 饲料中喹诺酮酸酯药物的测定液相色谱-串联质谱法[J]. 广东饲料, 2018, 27(11): 41-45. doi: 10.3969/j.issn.1005-8613.2018.11.011 [30] 周鑫, 张建雄, 李继丰, 等. 超高效液相色谱串联质谱法测定饲料中7种氟喹诺酮类药物[J]. 养殖与饲料, 2018(1): 4-6. doi: 10.3969/j.issn.1671-427X.2018.01.002 [31] 李妍, 闫蕊, 王孝研, 等. 动物源性食品中氟喹诺酮类抗生素残留检测方法的研究进展[J]. 食品安全质量检测学报, 2019, 10(10): 2918-2928. doi: 10.3969/j.issn.2095-0381.2019.10.015 [32] 张宏博, 王洋, 王燕, 等. 肉制品中喹诺酮残留检测[J]. 食品安全导刊, 2018(31): 54-59. doi: 10.3969/j.issn.1674-0270.2018.31.019 [33] 魏丹, 国明, 张菊. 加速溶剂萃取-磁固相萃取-高效液相色谱-串联质谱法测定水产品中10种氟喹诺酮类药物残留[J]. 色谱, 2020, 38(12): 1413-1422. [34] 钱卓真, 朱世超, 魏博娟, 等. 高效液相色谱-串联质谱法测定水产品中19种喹诺酮类药物残留量[J]. 中国渔业质量与标准, 2012(3): 68-76. [35] 李娟, 肖国生, 陈一资, 等. 可食用动物组织中喹诺酮类药物的多残留分析: 前处理方法[J]. 卫生研究, 2007, 36(5): 646-651. doi: 10.3969/j.issn.1000-8020.2007.05.043 [36] 乔庆东, 吴云钊, 庄景新, 等. 固相萃取-高效液相色谱-串联质谱法测定畜禽肉中3种抗生素残留量[J]. 中国卫生检验杂志, 2022, 32(5): 536-539. [37] 丁紫荣, 黎玉清, 王雄, 等. 固相萃取-液相色谱-三重四极杆串联质谱测定养殖废水中 17 种氟喹诺酮类抗生素[J]. 环境工程学报, 2022, 16(2): 674-683. doi: 10.12030/j.cjee.202109077 [38] 姜明宏, 王金鹏, 赵阳国. 固相萃取-高效液相色谱-串联质谱法同时测定海水中12种抗生素[J]. 中国海洋大学学报(自然科学版), 2021, 51(10): 107-114. doi: 10.16441/j.cnki.hdxb.20200281 [39] 薛鸣, 杨凡绪, 金铨, 等. 固相萃取-超高效液相色谱-串联质谱法测定水样中17种磺胺类抗生素[J]. 中国卫生检验杂志, 2020, 30(13): 1537-1541. [40] 中华人民共和国生态环境部. 近岸海域环境监测技术规范 第四部分 近岸海域沉积物监测: HJ 442.3-2020[S]. 北京: 中国环境科学出版社, 2020. -



 下载:
下载: