-
苦味酸(picric acid, PA),学名2, 4, 6-三硝基苯酚(2, 4, 6-trinitrophenol, TNP),因具有很强的酸性和强烈的苦味而得名, 俗称黄色炸药. 苦味酸稳定性不如2, 4, 6-三硝基甲苯(2, 4, 6-trinitrotoluene, TNT),其应用不及TNT广泛,但其爆炸效能强于TNT[1 − 2]. 作为一种重要的化工原料和有机合成中间体,苦味酸被广泛应用于医药、军事、染料、农药和皮革等工业,主要用作合成炸药、农药、染料、杀菌剂、收敛剂、火箭燃料和药物前体等[3 − 4]. 苦味酸具有很强的刺激性,可经过呼吸道、消化道,甚至皮肤被人体吸收,对呼吸系统、消化系统、皮肤系统和视觉系统产生较大危害[5 − 6]. 人体长期接触可引起发热、头痛、头晕、食欲减退、恶心、呕吐和腹泻等症状,甚至可导致末梢神经炎,肝脏损伤、出血性肾炎等,严重危害人类健康,现被认为是一种可能的致癌物[7 − 8]. 由于苦味酸不易被生物降解和良好的水溶性,导致苦味酸在环境中急剧增长,对环境特别是土壤和地下水造成严重的污染[9 − 10]. 因此,发展一种新方法对环境中苦味酸的分析检测具有十分重要的意义.
碳量子点(carbon nanodots, C-dots),简称碳点,是一种尺寸低于10 nm的新型碳基零维纳米材料,首次报道是在电弧放电制备碳纳米管的烟灰中意外发现[11]. 从那以后,科研工作者们努力尝试了各种合成高效碳量子点的方法. 目前,合成碳量子点的方法主要分为两类:自上而下和自下而上的合成方法[12 − 13]. 自上而下的合成方法,包括电弧放电[14]、激光烧蚀[15]和电化学氧化[16]法等,适合将碳基块状材料分解成纳米级碳. 自下而上的合成方法,包括微波辅助[17]、高温热解[18]和水热法[19]等,通常适合于小分子前驱体. 其中,水热法已被证明是一种简单、廉价且可靠的获得碳量子点的方法. 与半导体量子点相比,碳量子点被认为是一种具有生物相容性和无毒的荧光纳米材料[20 − 21]. 噻唑蓝(MTT)法测定细胞活性表明,碳量子点对细胞没有显著毒性,而CdSe半导体量子点导致细胞生存能力减少76%[22]. 除了具有相似的荧光性能外,碳量子点在水溶性、生物相容性、低毒性和化学惰性方面具有许多优越的性能[23]. 因此,设计制备一种高性能荧光碳量子点具有十分重要的意义.
苦味酸是我国《地表水环境质量标准》(GB
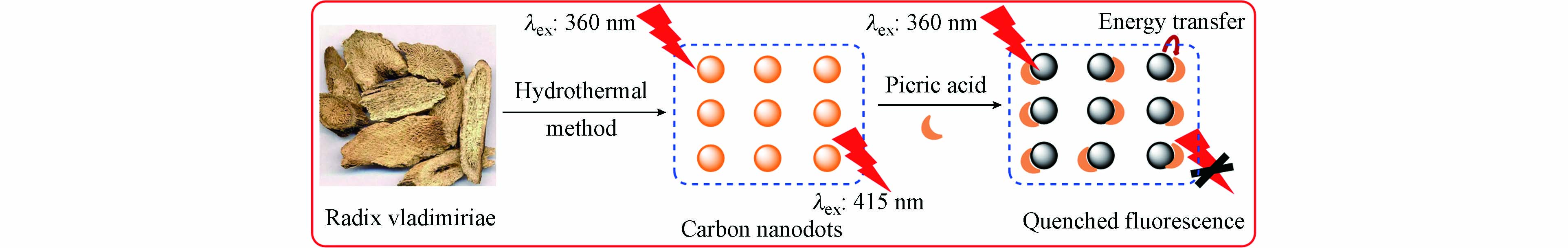
3838 —2002)中常规监测指标,为集中式生活饮用水源地特定检测项目,其标准限值为0.5 mg·L−1. 目前的国标方法采用衍生化-气相色谱法检测水体中的苦味酸,现已报道苦味酸的检测方法主要有拉曼光谱法[24]、X射线衍射法[25]、分光光度法[26]、液相色谱法[27]、气相色谱法[28]色谱-质谱法[29]和电化学法[30]等,但这些测定方法由于存在仪器设备昂贵、前期处理复杂、检测周期长、可移植性差和成本较高等问题,不利于现场快速检测. 近年来,基于荧光和比色法的碳量子点荧光探针因其特殊的光学性能而受到许多研究人员的关注,它为医学诊断、食品检测、环境监测和生化测定等领域提供了一种简单、快速和可见的分析方法[31 − 32]. 本研究以中药材川木香原药为前驱体,通过简便的水热反应一步合成荧光碳量子点,根据荧光共振能量转移(FRET),碳量子点的荧光可被苦味酸猝灭,而其它结构类似有机物无此现象,据此构建了苦味酸荧光探针,发展了一种高选择性和高灵敏度检测苦味酸的新方法,原理示意图如图1所示. -
日本岛津公司UV-
2550 紫外-可见分光光度计;英国爱丁堡FLS1000 瞬态荧光分光光度计;美国热电公司Thermo escalab 250Xi X射线光电子能谱仪(XPS);日本日立公司F-2700 荧光分光光度计;荷兰Philips-FEI公司TECNAI 10透射电子显微镜(TEM);TG20-WS台式高速离心机;KQ-50E超声波反应器;PHS-3C 酸度计;FA2104N分析天平;FW-135中草药粉碎机.中药材川木香(四川龙森中药材有限公司);NaF、NaBr、NaI、AgNO3、CuSO4、Pb(NO3)2、Hg(NO3)2、Cr2(SO4)3、NaH2PO4、Na2HPO4、苯酚(Phenol)、4-硝基苯酚(4-NP)、2-硝基苯酚(2-NP)、2, 6-二硝基苯酚(2, 6-DNP)、2, 4-二硝基苯酚(2, 4-DNP)、1, 3, 5-三硝基苯(TNB)、2, 4, 6-三硝基甲苯(TNT)、苦味酸(PA)等均购于上海阿拉丁生化科技股份有限公司;0.1 mol·L−1磷酸盐(NaH2PO4 - Na2HPO4)缓冲溶液;所有试剂均为分析纯,实验用水均为二次蒸馏水.
-
以中药材川木香为原料,采用水热一步法制备荧光碳量子点. 将0.5 g经干燥和粉碎的中药材川木香粉末和30 mL二次蒸馏水均匀混合,转移至50 mL聚四氟乙烯高压反应釜内胆中,密封好反应釜,180 ℃恒温加热3 h. 通过高速离心机在
10000 r·min−1转速下离心10 min去除大颗粒部分,收集到淡黄色荧光碳量子点溶液. 再将淡黄色荧光碳量子点溶液通过真空干燥24 h ,得到黄色的碳量子点. 最后. 将碳量子点分散在二次蒸馏水中得到0.4 g·L−1分散液,以便进一步使用. -
将1 mL 0.1 mol·L−1磷酸盐缓冲液(pH 6.6)、200 μL 0.4 g·L−1荧光碳量子点溶液和不同浓度一定用量的PA分别加入到5 mL塑料试管中,再用适当体积的二次蒸馏水补充至溶液总体积为4 mL. 将混合溶液完全涡旋混合均匀,并在室温下孵育2 min. 设置荧光分光光度计光电倍增管电压400 V,狭缝宽度5 nm,在室温和360 nm的激发波长下测定其荧光强度(取3次测量的平均值),通过与标准曲线对比,实现PA的含量检测分析.
-
取当地河水、炼油厂和制药厂排水口水样,并采用10 kD超滤膜进行超滤处理备用. 在1 mL实际水样中,分别加入200 μL 0.4 g·L−1荧光碳量子点溶液和适量二次蒸馏水至溶液总体积为4 mL. 将混合物涡旋混匀,室温下孵育2 min,在360 nm的激发波长下检测实际水样中的PA含量. 为了获得较好的回收率,分别在上述溶液中加入含PA浓度分别为5、20、50 μmol·L−1,然后进行加标回收实验.
-
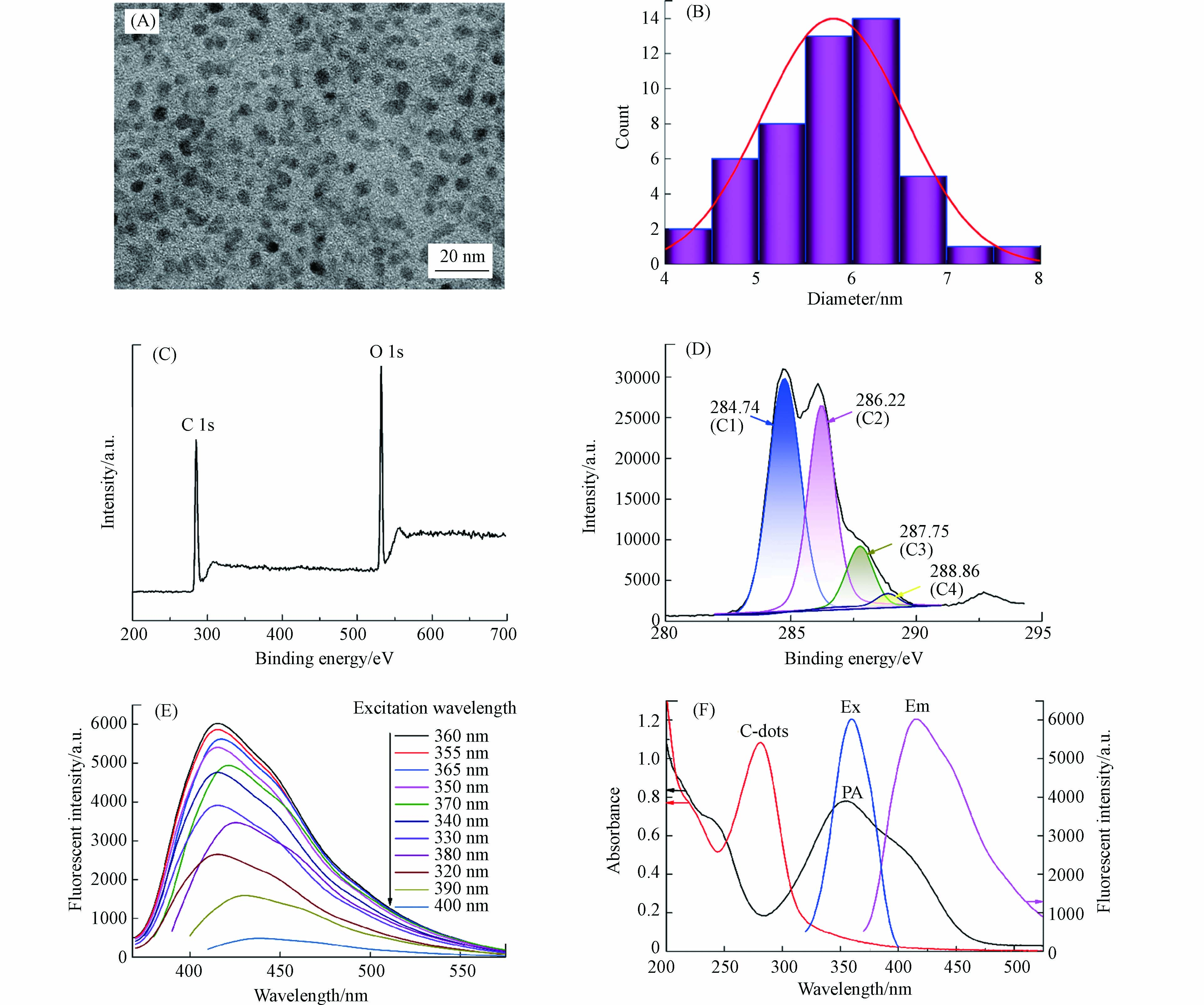
图2(A)透射电镜(TEM)图像可以看出,川木香制备的碳量子点呈球形或类球形,颗粒均匀,分散良好,无团聚现象. 从图2(B)的碳量子点粒径分布直方图可以看出,通过对50个碳量子点颗粒的统计,碳量子点粒径大小主要分布在4—8 nm,平均粒径为5.8 nm. 从图2(C)的碳量子点X射线光电子能谱(XPS)图像可以看出,特征峰出现在284.8 eV和532.5 eV处,说明碳量子点主要含有C元素和O元素. 从图2(D)的碳量子点XPS高分辨C1s谱可以看出,C1的吸收峰位于284.74 eV,占比为48.79%,C2的吸收峰位于286.22 eV,占比为38.91%,C3的吸收峰位于287.75 eV,占比为10.54%,C4的吸收峰位于288.86 eV,占比为1.76%,可见碳量子点的表面富含O的官能团. 图2(E)为碳量子点在320—400 nm激发波长下的发射光谱,最大激发波长为360 nm. 通过瞬态荧光分光光度计进行碳量子点荧光量子产率检测,绝对荧光量子产率为28.4%. 图2(F)可以看出,在碳量子点浓度20 mg·L−1和PA浓度100 μmol·L−1条件下检测,最大激发波长条件下碳量子点发射峰位于415 nm,碳量子点和PA的特征吸收峰分别出现在280 nm和355 nm处,碳量子点荧光发射光谱和PA吸收光谱存在部分重叠,符合荧光共振能量转移的条件要求[33].
-
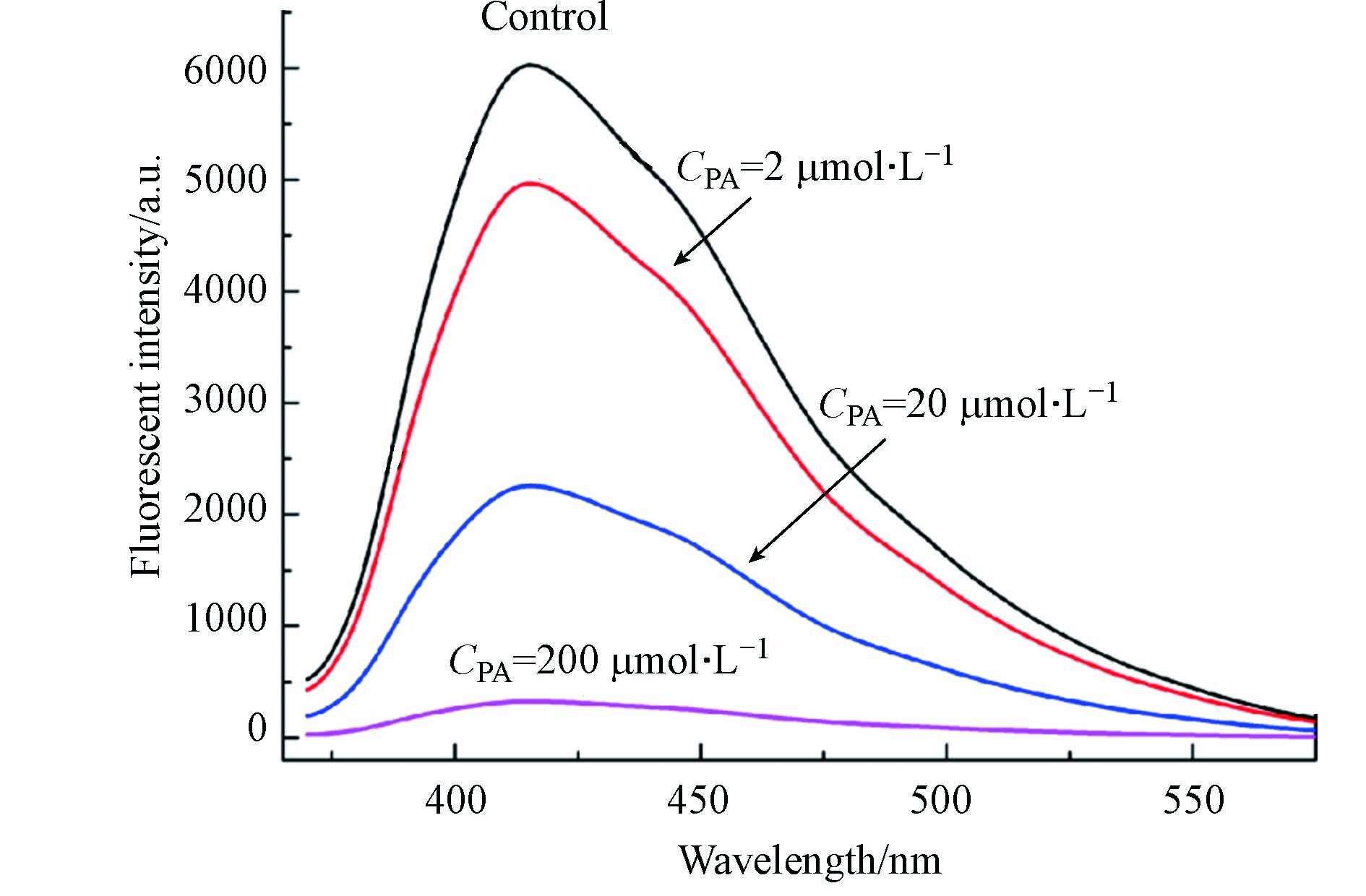
在浓度为20 mg·L−1荧光碳量子点溶液中加入不同浓度的PA,考察荧光碳量子点检测PA的可行性,如图3所示. 当加入PA时,碳量子点发射峰降低,荧光迅速被猝灭,加入PA浓度分别为2、20、200 μmol·L−1时,其荧光猝灭率分别为17.6%、62.6%和94.6%. 可见随着PA浓度的增大,荧光猝灭率逐渐增大,表明碳量子点向PA发生了能量转移,显示出碳量子点可用于检测PA的可行性特征.
-
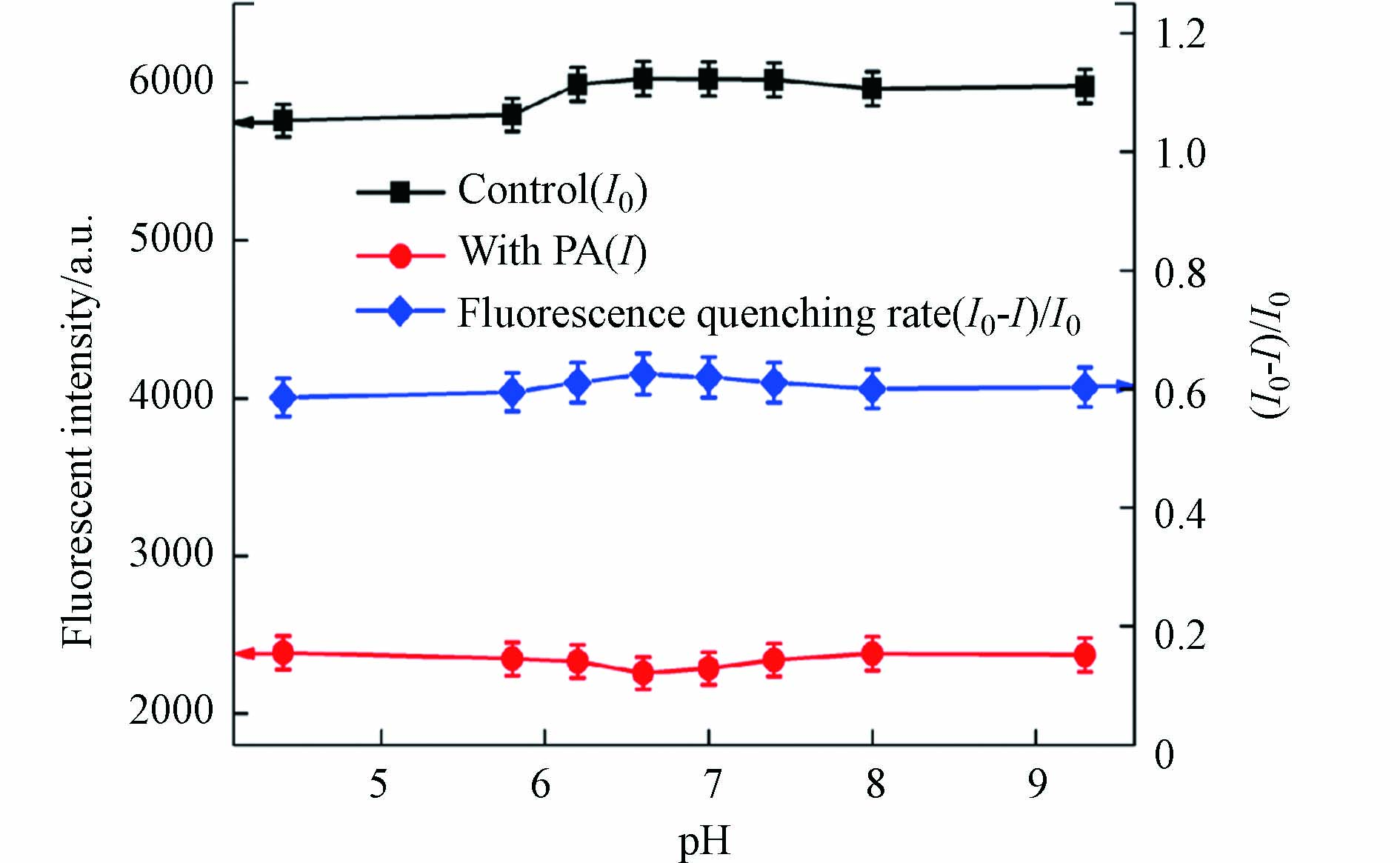
在PA浓度为20 μmol·L−1条件下,分别选取pH值为 4.4、5.8、6.2、6.6、7.0、7.4、8.0和9.3的磷酸盐缓冲溶液进行实验,实验结果如图4所示. I0和I分别表示加入PA前后碳量子点的荧光强度,(I0−I)/I0表示加入PA后的荧光猝灭率. 实验结果表明,在不同的pH值条件下,I0和I波动较小,说明碳量子点荧光性能稳定,此方法检测PA受PH值影响较小. (I0−I)/I0从pH 4.4到pH 6.6逐渐增大,随后呈现下降趋势,当pH为6.6时,(I0−I)/I0最大. 为了获得最大的荧光猝灭效率,选择pH 6.6进行后续的PA检测实验. 同时在选取的pH值4.4—9.3范围内,该体系(I0−I)/I0虽有一定的波动,但整体变化不大,因此在实际水样PA的检测中,可以省略加入磷酸盐调节pH值步骤,以实现本方法对PA的便捷、简单和快速检测.
-
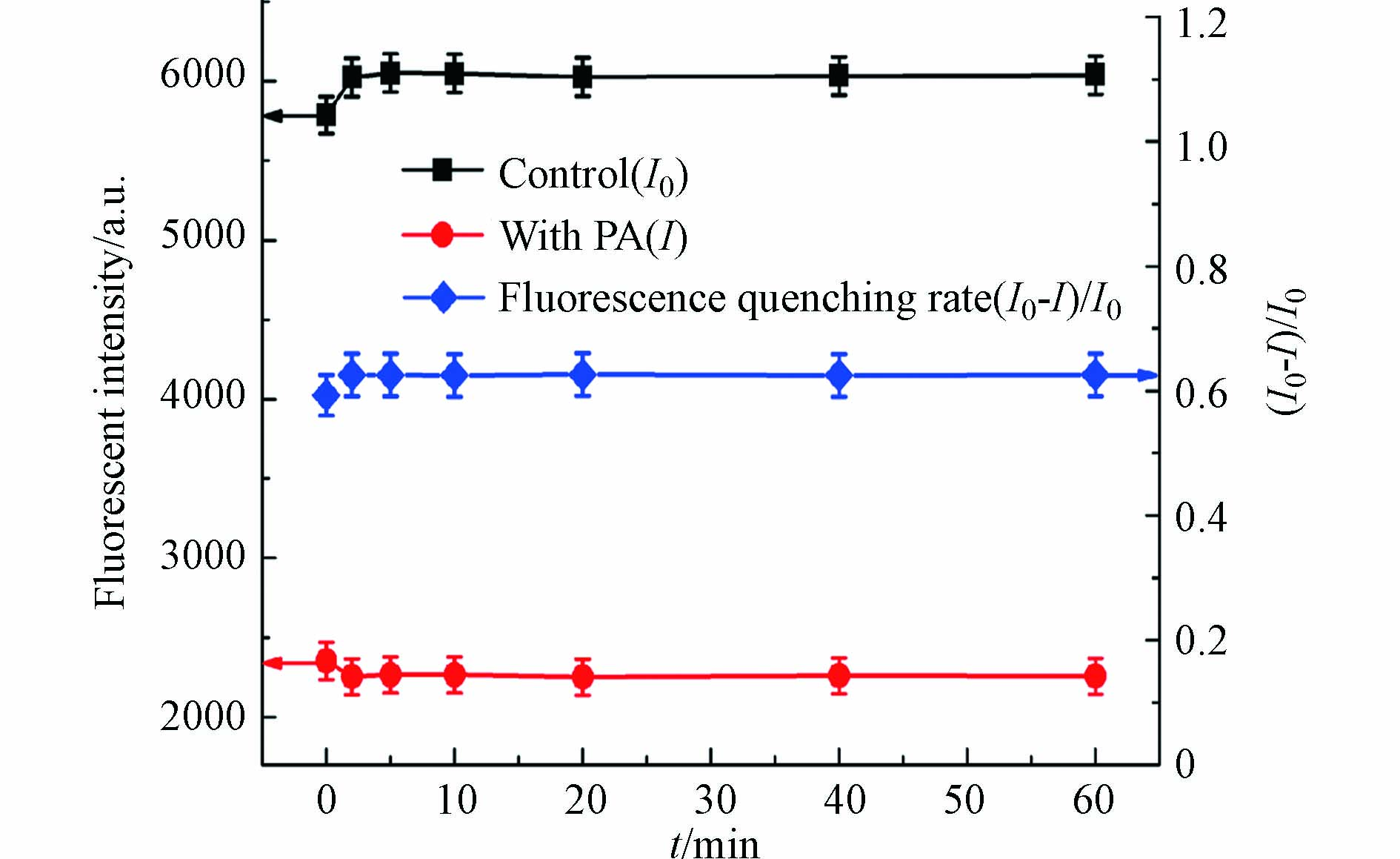
在PA浓度为20 μmol·L−1,pH值为 6.6的缓冲条件下,研究了60 min内孵育时间对碳量子点荧光强度的影响,实验结果如图5所示. 当加入PA后,碳量子点的荧光明显被猝灭. 0 min到60 min孵育时间内,孵育1 min检测时,加入TNP前后I0和I具有一定的波动,(I0−I)/I0也不稳定;2 min到60 min孵育时间内,I0和I保持相对稳定,(I0−I)/I0基本保持不变. 说明从荧光碳量子点到PA的FRET可以在2 min内完成. 因此,选择2 min孵育时间对PA进行定量检测,以获得最大的荧光信号和(I0−I)/I0的稳定性.
-
在最佳实验条件下,研究了不同浓度PA对碳量子点荧光强度的影响,实验结果如图6所示. 随着PA浓度从0.2 μmol·L−1增加到800 μmol·L−1,碳量子点的荧光强度逐渐被猝灭(图6A). 此外,通过对碳量子点415 nm处的荧光强度进行统计分析,发现I0/I与PA 浓度(c)从0.2—800 μmol·L−1呈良好的线性关系,线性方程为I0/I=0.0957c+
0.7788 ,相关系数(r)为0.9993 (图6B). 根据3倍空白标准偏差(测定次数n=11次),除以实测样品的斜率计算得到检测限(LOD)为63 nmol·L−1(3σ/k n=11). 此方法得到一种新型的荧光供体碳量子点和受体PA,有助于扩大荧碳量子点在废水和地表水中PA分析中的应用. -
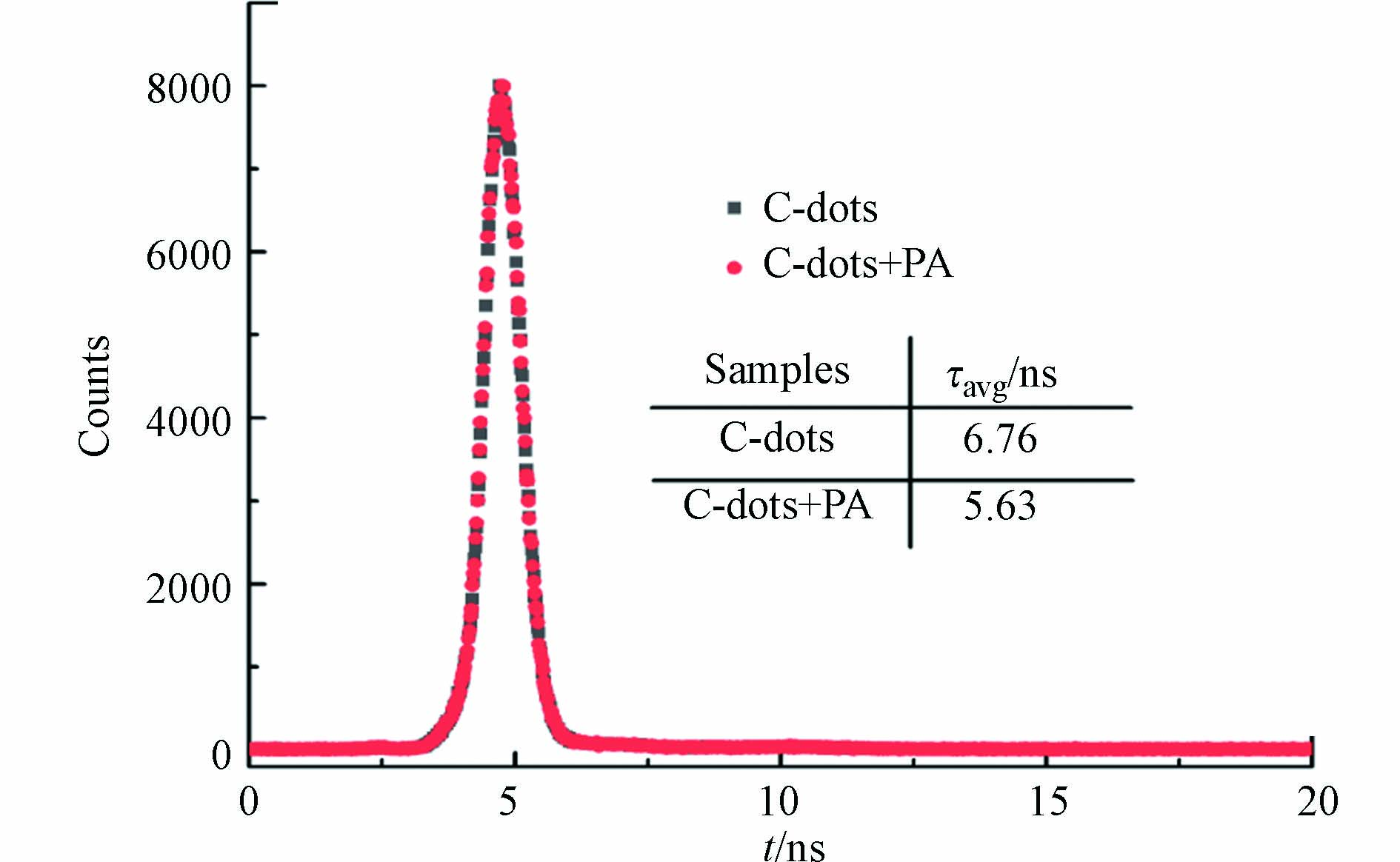
为了研究碳量子点与PA之间的荧光共振能量转移机理,在碳量子点最大发射波长415 nm处,通过瞬态荧光分光光度计进行了碳量子点体系荧光寿命测试. 测试结果如图7所示,碳量子点(20 mg·L−1)的平均荧光寿命为6.76 ns,加入20 μmol·L−1 PA后,体系的平均荧光寿命为5.63 ns. 由此可见,该碳量子点荧光体系在加入PA后荧光寿命缩短,表明碳量子点和PA之间是一个动态猝灭的过程,该体系的荧光猝灭机理为荧光共振能量转移下的动态猝灭机理.
-
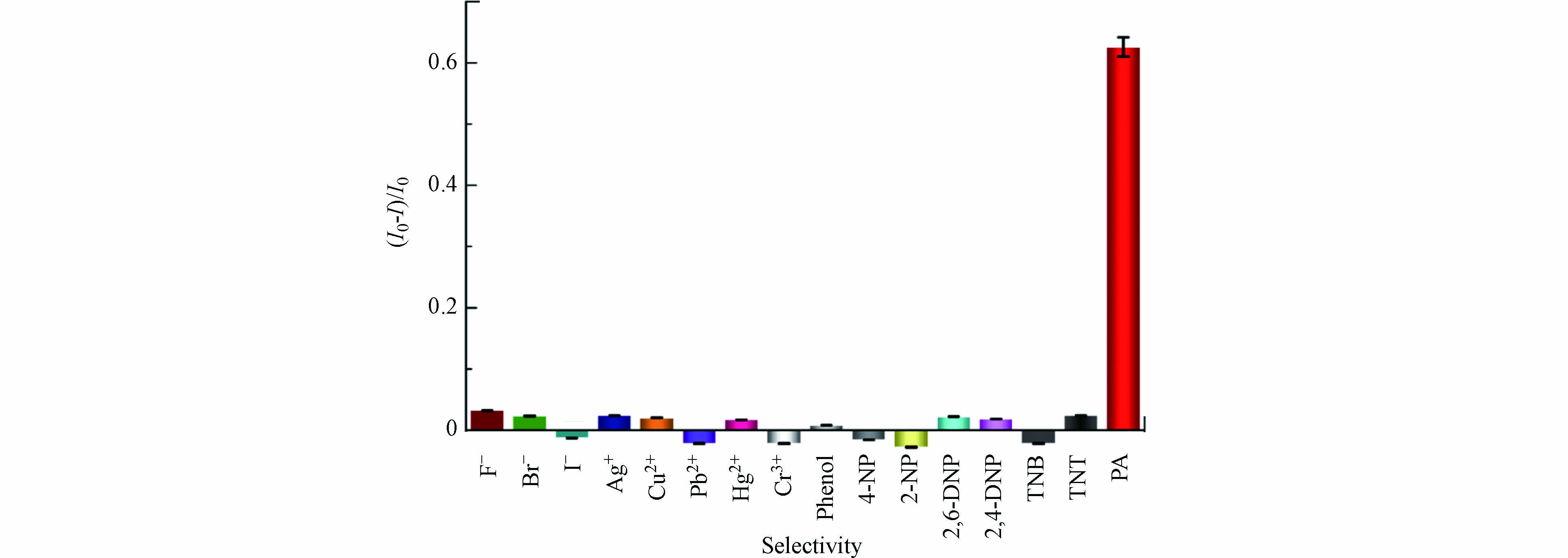
在最佳实验条件下,研究了其他硝基芳香族化合物及苯酚、部分金属阳离子和阴离子对碳量子点荧光强度的影响,实验结果如图8所示. 当原样品体系中浓度为20 μmol·L−1的PA被相同浓度的其他物质或离子取代时,体系的(I0−I)/I0除PA为62.6%以外,其他硝基芳香族化合物及苯酚、部分金属阳离子和阴离子最高为3.2%. 根据一些文献报道[34 − 35],±10%的变化被认为是一个可以忽略不计的误差范围. 因此,通过荧光碳量子点FRET检测PA具有良好的选择性. 同时也有文献[36]报道了利用碳量子点对Hg2+的检测,文献采用三聚氰胺和柠檬酸钠为原料,通过微波法制备得到荧光碳量子点,其中柠檬酸钠既是制备碳量子点的碳源,又是表面修饰剂,该碳量子点表面富含大量的羧基,Hg2+与碳量子点的羧基形成络合物,诱导碳量子点不断聚集,碳量子点荧光被猝灭,从而实现了Hg2+的检测. 而本文以中药材川木香为原料,采用水热一步法制备荧光碳量子点. 从图2(D)的碳量子点XPS高分辨C1s谱可以看出,C4的吸收峰位于288.86 eV,其占比为1.76%,说明该碳量子点表面羧基的含量极少,不能与Hg2+形成有效的络合,因此Hg2+不能对该碳量子点的荧光形成有效的猝灭.
-
为了探究其他硝基芳香族化合物及苯酚、部分金属阳离子和阴离子对检测PA的干扰,保持样品体系中PA浓度20 μmol·L−1不变,分别添加F−、Br−、I−、Ag+浓度为400 μmol·L−1,Cu2+、Pb2+、Cr3+、Phenol、2-NP浓度为
1000 μmol·L−1,4-NP、2,4-DNP、2,6-DNP、TNB、TNT浓度为2000 μmol·L−1进行检测,实验结果如表1所示. 通过对(I0−I)/I0进行5次平行测试,其平均值都接近PA对碳量子点的荧光猝灭率62.6%,计算得到相对标准偏差(RSD)为0.7%—2.6%,可见其他硝基芳香族化合物及苯酚、部分金属阳离子和阴离子共存物均不干扰荧光碳量子点对PA的检测. -
将处理后的河水、炼油厂和制药厂水样分别标为样品1—3,首先对其PA含量进行检测,然后分别添加5、20、50 μmol·L−1 PA到实际水样,进行PA回收率实验,实验结果见表2所示. 上述所有水样几乎检测不到PA,说明选择水样均达到《地表水环境质量标准》(GB3838—2002)规定的PA含量0.5 mg·L−1标准. 加入5、20、50 μmol·L−1 PA的回收率为98.8%—101.7%,相对标准偏差(RSD)为1.2%—2.7%. 可见,此方法在实际水样PA检测中具有很好地应用前景.
-
以中药材川木香为原料,采用水热一步法制备得到荧光碳量子点. 基于碳量子点荧光光谱与PA吸收光谱存在部分重叠,荧光碳量子点向PA发生的FRET,建立了荧光碳量子点作为供体对PA受体进行定量检测的新方法. 在PA浓度为0.2—800 μmol·L−1范围内,呈良好的线性关系,相关系数r为
0.9993 ,响应在2 min内完成,LOD为63 nmol·L−1,应用于实际水样中PA的检测分析,具有良好的回收率. 此方法灵敏度高、选择性好、响应速度快、线性范围宽、成本低,有望实现日常生活中常规PA的检测.
基于碳量子点共振能量转移荧光猝灭法检测苦味酸
Detection of picric acid by fluorescence resonance energy transfer quenching method on carbon nanodots
-
摘要: 苦味酸(PA)作为一种高爆物和环境污染物,近年来引起了广泛的关注. 本研究提出了一种新型荧光碳量子点(C-dots)探针,可用于快速、高选择性和高灵敏度的PA检测. 探针采用中药材川木香为碳源,通过水热法一步合成. 在荧光碳量子点溶液中加入PA,通过荧光共振能量转移机理,碳量子点的荧光被有效猝灭. 结果表明,碳量子点最大激发波长为360 nm,最大荧光发射波长为415 nm,荧光量子产率为28.4%. 方法检测PA响应时间2 min,线性范围0.2—800 μmol·L−1,检测限(LOD)63 nmol·L−1,实际水样中加标回收实验,回收率为98.8%—101.7%,相对标准偏差(RSD)为1.2%—2.7%.
-
关键词:
- 中药材川木香 /
- 荧光共振能量转移(FRET) /
- 碳量子点(C-dots) /
- 苦味酸(PA).
Abstract: Picric acid (PA), as a kind of high explosive and environmental pollutant, has attracted wide attention in recent years. This study presents a novel fluorescent carbon nanodots (C-dots) probe that can be used for rapid, high selectivity and high sensitivity PA detection. The probe is synthesized by hydrothermal method in one step with the carbon source of the traditional Chinese medicinal material Radix Vladimiriae. When PA is added to the fluorescent C-dots solution, the fluorescence of C-dots is effectively quenched by the fluorescence resonance energy transfer (FRET) mechanism. The experimental results show that the maximum excitation wavelength of C-dots is 360 nm, the maximum fluorescence emission wavelength is 415 nm, and the fluorescence quantum yield is 28.4%. This method detects the response time of PA is 2 min, the linear range is 0.2—800 μmol·L−1, the detection limit (LOD) is 63 nmol·L−1, the spike-and-recovery experiments in actual water samples, the recovery rate is 98.8%—101.7%, and the relative standard deviation (RSD) is 1.2%—2.7%. -

-
图 2 (A)碳量子点TEM图;(B)碳量子点粒径分布直方图;(C) 碳量子点XPS图;(D)碳量子点XPS高分辨C1s谱;(E)碳量子点发射光谱;(F)PA吸收光谱和碳量子点荧光光谱及吸收光谱
Figure 2. (A) TEM image of C-dots; (B)Histogram of the particle size distribution of C-dots; (C) XPS image of C-dots; (D)The XPS high-resolved C1s spectra of C-dots; (E) Emission spectra of C-dots; (F) Absorption spectra of C-dots and TNP and fluorescence spectra of C-dots
表 1 不同浓度干扰实验
Table 1. Interference experiments at different concentrations
干扰物
Interferent浓度/(μmol·L−1 )
Concentration猝灭率/%
(I0-I)/I0相对标准偏差/%
RSD干扰物
Interferent浓度/(μmol·L−1 )
Concentration猝灭率/%
(I0-I)/I0相对标准偏差/%
RSDF− 400 63.6 0.8 Phenol 1000 62.8 1.8 Br− 400 63.0 1.6 2-NP 1000 62.5 0.9 I− 400 62.7 2.4 4-NP 2000 62.9 2.2 Ag+ 400 61.1 1.4 2,4-DNP 2000 62.3 1.2 Cu2+ 1000 62.4 0.7 2,6-DNP 2000 62.3 2.6 Pb2+ 1000 62.5 2.5 TNB 2000 62.5 1.6 Cr3+ 1000 63.0 1.2 TNT 2000 62.7 2.0 表 2 实际水样PA检测及加标回收实验
Table 2. Detection of PA in the Real water samples and add standard recovery experiment
样品
Sample检出浓度/(μmol·L−1)
Found添加浓度/(μmol·L−1)
Added加标测定值/(μmol·L−1)
Total found相对标准偏差/%
RSD回收率/%
Recovery1 — 5 5.2, 4.9, 5.1, 4.9, 5.0 2.6 100.4 20 20.3, 20.5, 20.1, 19.8, 19.6 1.8 100.2 50 51.2, 51.5, 49.9, 50.4, 50.9 1.3 101.6 2 0.6 5 5.6, 5.5, 5.4, 5.8, 5.6 2.7 99.6 20 21.0, 21.3, 20.8, 20.3, 20.4 2.0 100.8 50 51.7, 50.1, 50.3, 51.1, 51.4 1.4 100.6 3 1.5 5 6.3, 6.2, 5.9, 6.2, 6.1 2.5 98.8 20 21.3, 21.4, 21.9, 22.3, 21.8 1.9 101.2 50 52.9, 51.5, 52.4, 53.0, 52.0 1.2 101.7 -
[1] PENG Y, ZHANG A J, DONG M, et al. A colorimetric and fluorescent chemosensor for the detection of an explosive-2,4,6-trinitrophenol (TNP)[J]. Chemical Communications, 2011, 47(15): 4505-4507. doi: 10.1039/c1cc10400d [2] ZHOU X H, LI L, LI H H, et al. A flexible Eu(Ⅲ)-based metal–organic framework: turn-off luminescent sensor for the detection of Fe(Ⅲ) and picric acid[J]. Dalton Transactions, 2013, 42(34): 12403-12409. doi: 10.1039/c3dt51081f [3] ZHAO J, FAN Z F. Aggregation-induced phosphorescence quenching method for the detection of picric acid based on melamine-passivated Mn-doped ZnS quantum dots[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2019, 223: 117323. doi: 10.1016/j.saa.2019.117323 [4] WANG X C, LI X J, LI X, et al. Determination of 2, 4, 6-trinitrophenol by in-situ assembly of SBA-15 with multi-hydroxyl carbon dots[J]. Analytica Chimica Acta, 2020, 1098: 170-180. doi: 10.1016/j.aca.2019.11.061 [5] CHAKRAVARTY S, GOGOI B, SARMA N S. Fluorescent probes for detection of picric acid explosive: A greener approach[J]. Journal of Luminescence, 2015, 165: 6-14. doi: 10.1016/j.jlumin.2015.04.006 [6] MALIK A H, HUSSAIN S, KALITA A, et al. Conjugated polymer nanoparticles for the amplified detection of nitro-explosive picric acid on multiple platforms[J]. ACS Applied Materials and Interfaces, 2015, 7(48): 26968-26976. doi: 10.1021/acsami.5b08068 [7] WYMAN J F, GUARD H E, WON W D, et al. Conversion of 2, 4, 6-trinitrophenol to a mutagen by Pseudomonas aeruginosa[J]. Applied and Environmental Microbiology, 1979, 37(2): 222-226. doi: 10.1128/aem.37.2.222-226.1979 [8] TRINH D T T, KHANITCHAIDECHA W, CHANNEI D, et al. Synthesis, characterization and environmental applications of bismuth vanadate[J]. Research on Chemical Intermediates, 2019, 45(10): 5217-5259. doi: 10.1007/s11164-019-03912-2 [9] LI J F, ZHANG L, LI P, et al. One step hydrothermal synthesis of carbon nanodots to realize the fluorescence detection of picric acid in real samples[J]. Sensors and Actuators B:Chemical, 2018, 258: 580-588. doi: 10.1016/j.snb.2017.11.096 [10] CHEN X F, SUN C M, LIU Y, et al. All-inorganic perovskite quantum dots CsPbX3 (Br/I) for highly sensitive and selective detection of explosive picric acid[J]. Chemical Engineering Journal, 2020, 379: 122360. doi: 10.1016/j.cej.2019.122360 [11] XU X Y, RAY R, GU Y L, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. Journal of the American Chemical Society, 2004, 126(40): 12736-12737. doi: 10.1021/ja040082h [12] XUE M Y, ZHAN Z H, ZOU M B, et al. Green synthesis of stable and biocompatible fluorescent carbon dots from peanut shells for multicolor living cell imaging[J]. New Journal of Chemistry, 2016, 40(2): 1698-1703. doi: 10.1039/C5NJ02181B [13] ZHENG Y C, WANG S, LI R F, et al. Highly selective detection of nitroaromatic explosive 2, 4, 6-trinitrophenol (TNP) using N-doped carbon dots[J]. Research on Chemical Intermediates, 2021, 47(6): 2421-2431. doi: 10.1007/s11164-021-04410-0 [14] ZHANG D, YE K, YAO Y C, et al. Controllable synthesis of carbon nanomaterials by direct current arc discharge from the inner wall of the chamber[J]. Carbon, 2019, 142: 278-284. doi: 10.1016/j.carbon.2018.10.062 [15] YU H W, LI X Y, ZENG X Y, et al. Preparation of carbon dots by non-focusing pulsed laser irradiation in toluene[J]. Chemical Communications, 2015, 52(4): 819-822. [16] HUANG H G, YANG S W, LI Q T, et al. Electrochemical cutting in weak aqueous electrolytes: the strategy for efficient and controllable preparation of graphene quantum dots[J]. Langmuir, 2018, 34(1): 250-258. doi: 10.1021/acs.langmuir.7b03425 [17] WANG Q, LIU X, ZHANG L C, et al. Microwave-assisted synthesis of carbon nanodots through an eggshell membrane and their fluorescent application[J]. Analyst, 2012, 137(22): 5392-5397. doi: 10.1039/c2an36059d [18] RAY S C, SAHA A, JANA N R, et al. Fluorescent carbon nanoparticles: synthesis, characterization, and bioimaging application[J]. Journal of Physical Chemistry C, 2009, 113(43): 18546-18551. doi: 10.1021/jp905912n [19] PAN D Y, ZHANG J C, LI Z, et al. Hydrothermal route for cutting graphene sheets into blue-luminescent graphene quantum dots[J]. Advanced Materials, 2010, 22(6): 734-738. doi: 10.1002/adma.200902825 [20] GUO J J, ZHOU M J, YANG C X. Fluorescent hydrogel waveguide for on-site detection of heavy metal ions[J]. Scientific Reports, 2017, 7(1): 1-8. doi: 10.1038/s41598-016-0028-x [21] CAMPOS B B, ABELLAN C, ZOUGAGH M, et al. Fluorescent chemosensor for pyridine based on N-doped carbon dots[J]. Journal of Colloid and Interface Science, 2015, 458: 209-216. doi: 10.1016/j.jcis.2015.07.053 [22] SAHU S, BEHERA B, MAITI T K, et al. Simple one-step synthesis of highly luminescent carbon dots from orange juice: application as excellent bio-imaging agents[J]. Chemical Communications, 2012, 48(70): 8835-8837. doi: 10.1039/c2cc33796g [23] LI J, MA S, XIAO X, et al. The one-step preparation of green-emissioned carbon dots through hydrothermal route and its application[J]. Journal of Nanomaterials, 2019, 2019: 1-10. [24] DASARY S S R, SINGH A K, SENAPATI D, et al. Gold nanoparticle based label-free SERS probe for ultrasensitive and selective detection of trinitrotoluene[J]. Journal of the American Chemical Society, 2009, 131(38): 13806-13812. doi: 10.1021/ja905134d [25] WELLS K, BRADLEY D A. A review of X-ray explosives detection techniques for checked baggage[J]. Applied Radiation and Isotopes, 2012, 70(8): 1729-1746. doi: 10.1016/j.apradiso.2012.01.011 [26] ZER A, ERA E, APAK R. Selective spectrophotometric determination of trinitrotoluene, trinitrophenol, dinitrophenol and mononitrophenol[J]. Analytica Chimica Acta, 2004, 505(1): 83-93. doi: 10.1016/S0003-2670(03)00674-3 [27] BABAEE S, BEIRAGHI A. Micellar extraction and high performance liquid chromatography-ultra violet determination of some explosives in water samples[J]. Analytica Chimica Acta, 2010, 662(1): 9-13. doi: 10.1016/j.aca.2009.12.032 [28] DUNBAR A D F, RICHARDSON T H, MCNAUGHTON A J, et al. Investigation of free base, Mg, Sn, and Zn substituted porphyrin LB films as gas sensors for organic analytes[J]. The Journal of Physical Chemistry B, 2006, 110(33): 16646-16651. doi: 10.1021/jp0626059 [29] BARRON L, GILCHRIST E. Ion chromatography-mass spectrometry: a review of recent technologies and applications in forensic and environmental explosives analysis[J]. Analytica Chimica Acta, 2014, 806: 27-54. doi: 10.1016/j.aca.2013.10.047 [30] CHEN P C, SUKCHAROENCHOKE S, RYU K, et al. 2, 4, 6-Trinitrotoluene (TNT) chemical sensing based on aligned single-walled carbon nanotubes and ZnO nanowires[J]. Advanced Materials, 2010, 22(17): 1900-1904. doi: 10.1002/adma.200904005 [31] JU B, WANG Y, ZHANG Y M, et al. Photostable and low-toxic yellow-green carbon dots for highly selective detection of explosive 2, 4, 6-trinitrophenol based on the dual electron transfer mechanism[J]. ACS applied materials and interfaces, 2018, 10(15): 13040-13047. doi: 10.1021/acsami.8b02330 [32] MEHTA V N, CHETTIAR S S, BHAMORE J R, et al. Green synthetic approach for synthesis of fluorescent carbon dots for lisinopril drug delivery system and their confirmations in the cells[J]. Journal of Fluorescence, 2017, 27(1): 111-124. doi: 10.1007/s10895-016-1939-4 [33] DENG X, HUANG X M, WU D. Förster resonance-energy-transfer detection of 2, 4, 6-trinitrophenol using copper nanoclusters[J]. Analytical and Bioanalytical Chemistry, 2015, 407(16): 4607-4613. doi: 10.1007/s00216-015-8657-7 [34] CHEN T T, HU Y H, CEN Y, et al. A dual-emission fluorescent nanocomplex of gold-cluster-decorated silica particles for live cell imaging of highly reactive oxygen species[J]. Journal of the American Chemical Society, 2013, 135(31): 11595-11602. doi: 10.1021/ja4035939 [35] ZHANG P, YANG X X, WANG Y, et al. Rapid synthesis of highly luminescent and stable Au20 nanoclusters for active tumor-targeted imaging in vitro and in vivo[J]. Nanoscale, 2014, 6(4): 2261-2269. doi: 10.1039/C3NR05269A [36] XIAO Z G, CHENG B X, WANG C X, et al. High stability and strong fluorescence of carbon nanodots as nanosensor for Hg2+ in environmental waters[J]. Bulletin of Environmental Contamination and Toxicology, 2020, 104(1): 57-63. doi: 10.1007/s00128-019-02753-4 -



 下载:
下载: