-
据报道,2050年全世界人口预计达到 (90~100) ×108人[1],人们生活水平的提高增加了对高蛋白食物的需求,从而导致对粮食和饲料蛋白需求量增加,最终加剧了对环境的不利影响,包括氮污染、CO2排放和土地利用压力等[2-5]。
氮以有机氮、氨氮(NH4+-N)、硝氮(NO3−-N)以及亚硝氮(NO2−-N)等多种形式存在,其中,氨氮做为主要的存在形式之一,是水体富营养化和环境污染的重要因素。现有的氨氮处理技术,如吹脱法、膜分离法、沉淀法等,存在成本较高、具有二次污染、资源化利用率低等问题[6],将氨氮转化为高附加值产品已逐渐引起人们的重视,而生物法处理氨氮废水的经济成本较低,处理效果好,不产生二次污染,且能同步去除废水中的其他可降解有机污染物。
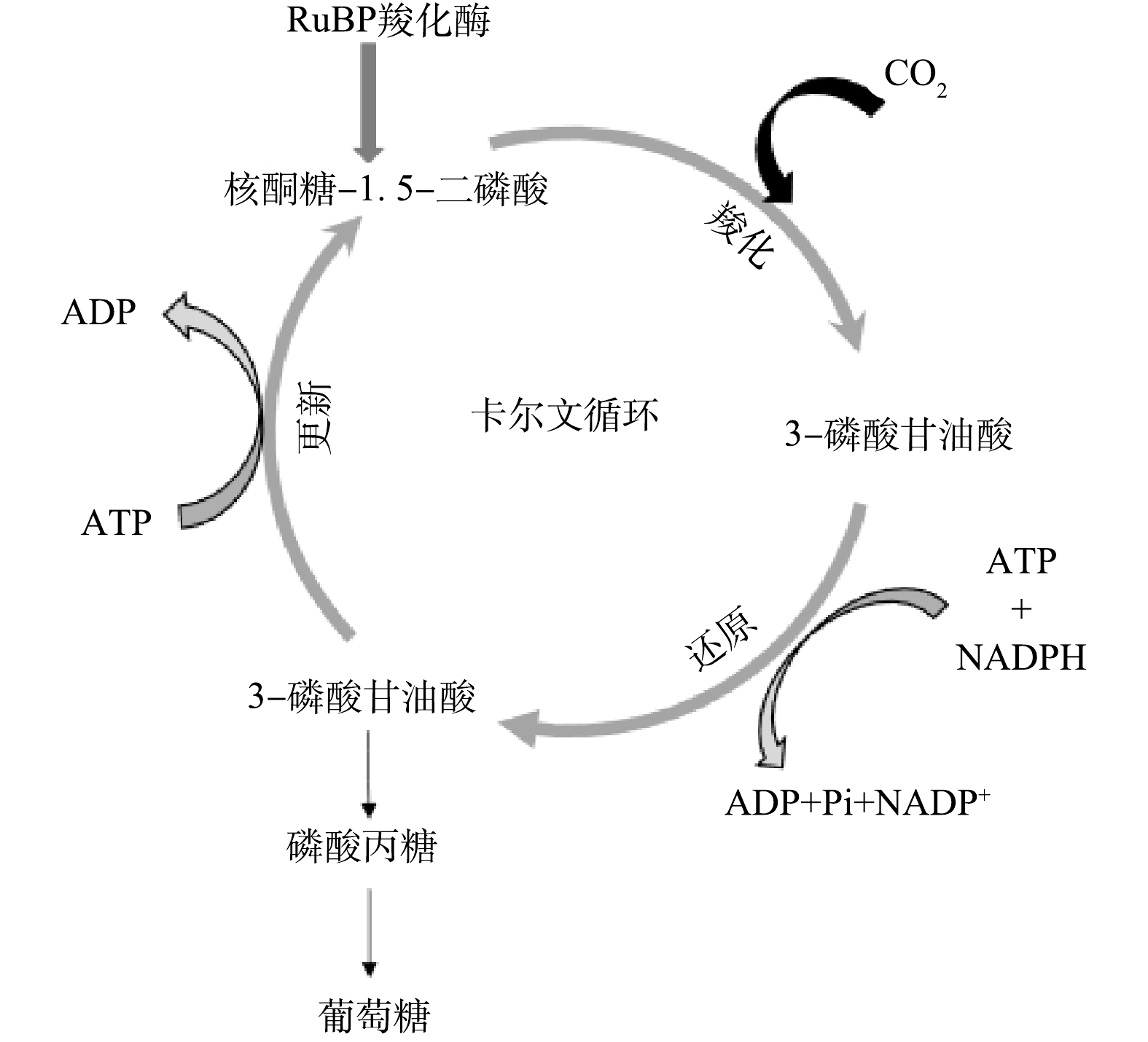
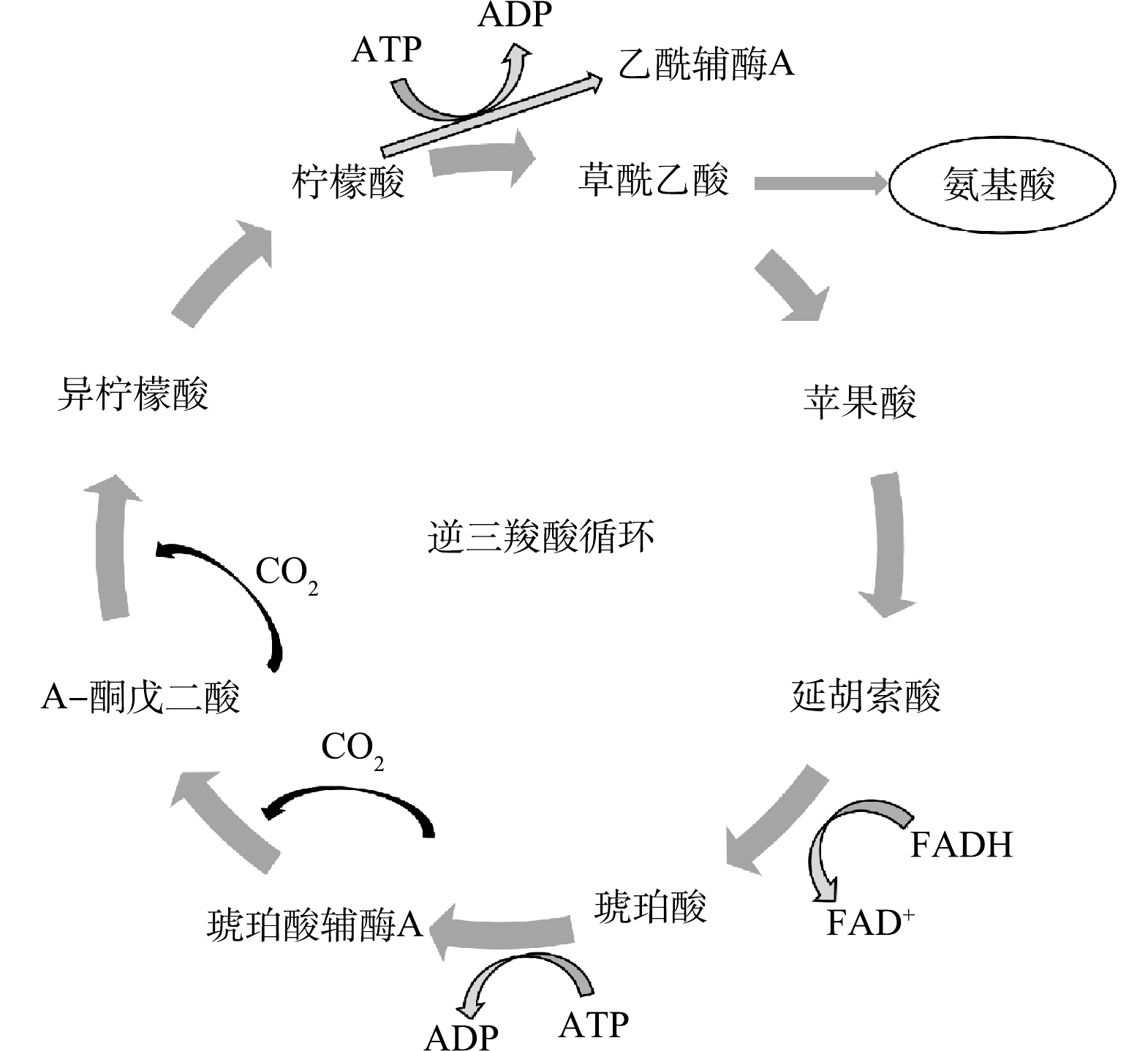
以CO2为典型代表的温室气体,其大量排放会导致全球变暖,同时加速疾病的传播,从而威胁人类的健康[7-8]。传统的CO2固定的方法有生物法[9]、物理法[10]、化学法[11]等。目前,大部分物理化学法固定CO2耗能较高,操作成本较高,寻求更加环保、低成本的方法是解决CO2问题的关键。为同步实现氨氮和CO2的固定,近年来有学者利用氢氧化细菌(hydrogen-oxidizing bacteria,HOB)合成微生物蛋白[12]。HOB以H2和O2作为电子供体和受体,通过卡尔文循环以及逆三羧酸循环(式(1))将CO2固定到细胞物质中,从而实现碳、氮元素的高值利用[13-15]。
研究表明, HOB合成的微生物蛋白,其蛋白质含量高于酵母和小麦谷物,且必需氨基酸组成类似于动物蛋白[16-17],利用HOB在固定CO2过程中产生的微生物蛋白可以作为牲畜饲料的添加剂,进一步优化碳、氮元素在人类生产生活中的循环过程[18]。
目前,在以H2为电子供体的微生物生长体系中,氢分压会影响产物的组成,在葡萄糖的降解过程中,氢分压较低(≤40.4Pa)会限制丙酸的产生过程 [19]。同时,氢分压也是体系反应速率的影响因素之一,在利用H2/CO2生物合成有机物的过程中,合成速率随着氢分压的升高而增大,但氢分压过高会导致中间产物的大量积累,致使反应速率降低[20]。此外,氢分压还会对酶的丰度、微生物活性等造成影响。因此,氢分压需要保持在一个合适的范围内,过高或过低均会对微生物的反应过程有负面影响。在HOB合成微生物蛋白的体系中,氢分压的作用亟待研究,对蛋白合成途径、关键酶浓度、氨基酸组成等方面的影响尚不明确。
HOB同步合成微生物蛋白体系在固碳方面可助力“双碳”目标的实现;在污水处理方面有望解决无机氮利用不充分和含氮有机物二次污染的问题;在蛋白质需求方面具有缓解粮食蛋白危机的潜力。本研究探究氢分压对HOB合成微生物蛋白过程的作用机制,包括对CO2固定效率、氨氮利用率以及产蛋白能力的影响,结合关键因子的相关性分析,确定氢分压对体系的影响规律,进一步分析氨基酸组成等蛋白特性,为HOB高效、高质合成微生物蛋白的应用放大奠定基础。
-
HOB培养基(1 L),包括2.3 gKH2PO4、2.9 gNa2HPO4·2H2O、0.2 g NH4Cl、0.5 gMgSO4·7H2O、0.5 g NaHCO3、0.01 g CaCl2·2H2O、0.05 g柠檬酸铁铵、1 mL微量元素溶液。培养基氨氮浓度为50 mg·L−1,调节pH至7.0±0.2,在121 ℃灭菌30 min。
-
HOB接种物为前期实验室驯化的混合菌群。调pH=7.0±0.2。以H2∶CO2∶O2=60∶15∶25的比例通气,置于30 ℃、150 r·min的摇床中活化,每隔12 h换气,调整pH至7.0±0.2,活化5d。反应器工作体积200 mL,顶空400 mL,接种比为10%。实验分为4组,分别为H40、H60、H80、H100组,氢分压分别为0.04、0.06、0.08、0.1MPa,每个实验组有3个平行反应器。4组反应器顶空中混合气体H2∶CO2∶O2∶N2的具体分压比分别为40∶15∶25∶60、60∶15∶25∶40、80∶15∶25∶20、100∶15∶25∶0。
-
实验用气压计(WAL Messund Regelsysteme GmbH,德国)测量各反应器内压强,用气相色谱仪(Agilent Technologies,7890B GC System,美国)分析H2和CO2气体组分。用紫外分光光度计(屹谱U-T5A,中国)测定光密度(optical density;OD),在波长620 nm处测量吸光度,即OD620,用于反应微生物生长情况。氨氮含量采用纳氏试剂分光光度法测量。采用ELISA试剂盒测定RuBP羧化酶(Ribulose-1,5-bisphosphate carboxylase)。
-
1)细胞干质量(cell dry weight,CDW)的测定。CDW采用离心法进行测量[21],根据式(2)进行计算。
式中:W为细胞干质量,g·L−1;m为生物量,g; V为菌液体积,L。
2)粗蛋白与氨基酸的测定。产物采用凯氏定氮仪(海能K9860,中国)测定产物中凯式氮含量,得到产品的凯氏含氮量后,用该含量乘6.25系数,即为粗蛋白含量。实验采用液质联用 (Shimadzu LC20AD-API 3200MD TRAP,日本)测定氨基酸的种类和含量。所测氨基酸包括了8种必需氨基酸和12种非必需氨基酸。
-
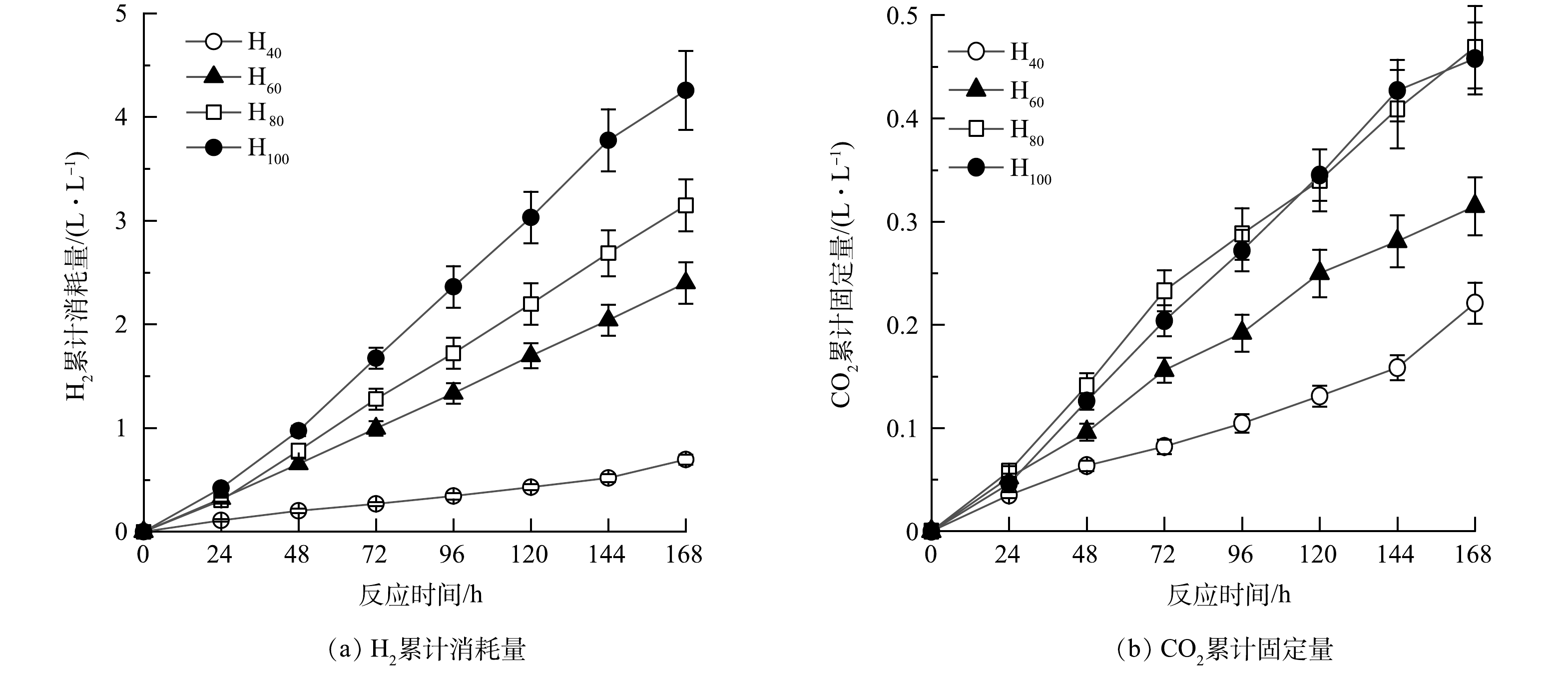
4组反应器的H2累计消耗量变化如图1(a)所示。消耗速率从小到大依次为H40、H60、H80、H100。由表1中可知,4组反应器的平均H2消耗速率依次(0.10±0.01)、(0.35±0.02)、(0.53±0.03)、(0.63±0.01) L·(L·d)−1。这是因为随着氢分压的不断升高,HOB产微生物蛋白正向反应速率越快, H2的消耗速率也越快。如图1(b)所示,H40实验组中CO2累计固定量最小, H80和H100组的CO2累计固定量最大,无显著差异。由表1可知,随着氢分压的增加,平均CO2固定速率依次为(0.03±0.01)、(0.04±0.01)、(0.06±0.01)、(0.06±0.01 )L·(L·d)−1,CO2固定与H2消耗的速率之比在0.1~0.3,基本接近理论比值(0.19,式(1))。
HOB主要通过卡尔文循环实现固碳(图2),RuBP羧化酶是该循环过程中的关键酶, 通过RuBP羧化酶实现CO2的固定,RuBP羧化酶浓度越高,固定CO2能力越强[22]。如表1所示,随着氢分压的增加,RuBP羧化酶的质量浓度依次为(35.84±1.20)、(36.08±1.40)、(41.27±1.20)、(33.95±1.00) ng·L−1,H80组中的RuBP羧化酶的质量浓度明显高于其余3组(高出12.20%~19.51%)。在H40中,虽然RuBP羧化酶的质量浓度为35.84±1.20 ng·L−1,但氢分压过低,H2和CO2通入量之比为2.67,低于理论值(5.22;式(1)),因而固碳效率最低(0.03 L·(L·d)−1),而在H80、H100中,由于H2充足,H2和CO2通入量之比可达5.33,且RuBP羧化酶的浓度较高(>33.95 ng·L−1),因而表现出最高的固碳效率(0.06 L·(L·d)−1)。综上所述,氢分压会影响HOB合成微生物蛋白过程中的固碳效率,但RuBP羧化酶的浓度对该过程影响并不显著。
-
OD620可用来表征菌落密度,反应细菌长势,OD620值越高,微生物的生长状况越好。如图3所示,H40组的OD620值先增加后降至0.10,处于较低水平;H60组HOB在48 h的OD620为0.14,进入对数生长期,在120 h达到生长稳定期,此时OD620为0.36,120 h以后OD620值稳定在0.36~0.35;H80组和H100组中末态的OD620值分别达到了0.50和0.49,这可能是H80组和H100组中H2充足,为细菌生长提供了充足的电子,导致细菌生长状况更好。HOB还通过逆三羧酸循环固定CO2(图4),细胞中含有大量的柠檬酸合成酶,产生乙酰辅酶A(Acetyl-CoA),乙酰辅酶会形成草酰乙酸,而草酰乙酸在循环中进一步被转化为脂质、糖和氨基酸,而氨基酸作为蛋白质的基本构成单位,氨基酸的含量越高,越有易于蛋白质的产生[23]。H40组由于缺少氢气,微生物处于饥饿状态,没有足够的电子供体进行逆三羧酸循环,因此,种菌落量减少。而H80、H100氢气含量高,获得了足够的能量,H60组在120 h到达生长稳定期时,H80组和H100组的OD620数值依旧增长。所以提高氢分压有利于微生物生长。
NH4+-N转化情况与菌株的生长情况密切相关,由表2可知,H40组的NH4+-N转化率仅为(21.21±1.20)%,菌株生长受到抑制,不能高效利用NH4+-N。H80组的NH4+-N转化率为(68.48±2.1)%,达到最大转化率,随着氢分压增加到1.0 bar时,H100组的NH4+-N转化率为(65.68±1.00)%,结合图2可以看出,在140 h,H80组的OD620值达到0.45,超过H100组,140 h后H80组的OD620值和NH4+-N消耗量均大于H100组。因此,说明NH4+-N的消耗与菌株的生长情况有强相关性,当氢气分压在0.08~0.1MPa时,有利于加强HOB氢化酶活性,能够高效利用氢气大量繁殖群体数量,表现为OD620值增加。
CDW是HOB所产的有机质干质量,反映了HOB的细胞增长情况。由表2可知,随着氢分压的增大,HOB细胞的CDW也在增大,H100组的CDW最高为(2.12±0.12) g·L−1,同时,粗蛋白含量也随之增大,H100组粗蛋白含量为1.59 g·L−1,结合菌株生长情况和NH4+-N转化能力,可知较高的菌落密度会提高NH4+-N转化能力,所以H80组和H100组的产蛋白能力较强。
-
进一步分析氢分压影响体系的相关因子,对HOB产蛋白过程中气体消耗速率、CDW值、粗蛋白含量、NH4+-N转化率随氢分压的变化进行拟合,如图5所示。如图5(a)、图5(c)、图5(d)所示的氢分压与H2累计消耗速率、CDW产量和粗蛋白产量的线性相关性较好,拟合方程的相关系数在0.88以上。分析HOB产蛋白的反应式(式(1))可知,增大氢分压,增大了正反应速率,使得H2的消耗速率增大,同时反应产物中CDW和粗蛋白的产量增大。
对氢分压和CO2固定速率以及氨氮转化率进行二次关系拟合(图5(b)和图5(e)),拟合的相关系数在0.93以上,说明拟合效果良好。由图5(b)可见,随着氢分压的提高,HOB对于CO2的固定速率逐渐提高,在H80组拥有最大的CO2的固定速率,但随着氢分压的进一步提高,CO2的固定速率呈现略微下降的趋势。这可能是HOB除了通过卡尔文循环固定CO2合成生物量外,还能够通过氧化H2提供能量和还原当量。在H2氧化过程中,存在主要反应过程为:1)H2被氢化酶氧化生成2个e−,将O2转化为H2O,同时产生ATP;2) H2被可溶性氢化酶氧化生成NADH,为HOB提供还原当量,ATP和NADH不仅用于CO2的固定,还用于维持细胞活动[24-25]。氢分压过高时(H100),有更多的H2通过第一个过程生成了H2O,由于O2量不足,导致HOB通过固定CO2合成生物量式(1)的能力下降。此外,CO2的固定速率还与RuBP羧化酶的浓度有关,RuBP羧化酶的浓度越高,CO2的固定速率越快。如表1所示,RuBP羧化酶的浓度随着氢分压的增加先升高后降低,在H80组中浓度最大((41.27±1.20) ng·L−1),因此,CO2的固定速率呈现先增加后降低的趋势。由图5(e)可见,随着氢分压的提高,NH4+-N转化率也同样呈现先增加后降低的规律,在H80达到最大,为(68.48±2.10)%。
图5(f)为HOB体系内各关键因子的相关性热图。除氢分压与氨氮转化率的R2值为0.75,其余R2值均大于0.8,说明了各相关因子之间存在良好的线性关系。综上,氢分压的改变并非单一影响HOB体系内某一种物质消耗,而是对体系内反应速率、生成速率等多层面有复杂的协同影响机制。
-
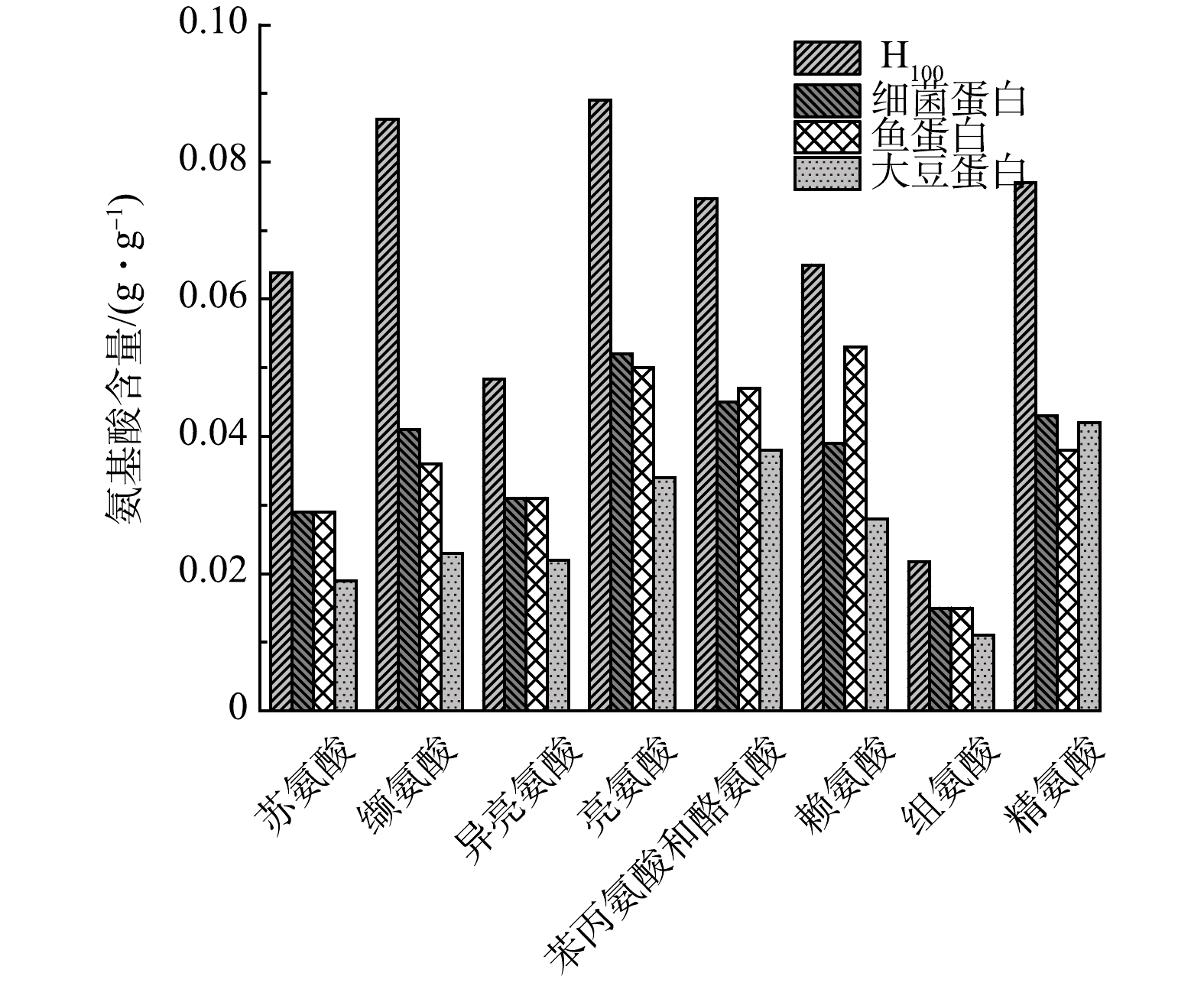
由表2可知,不同氢分压下HOB产的微生物蛋白含量均高于64.16%,与鱼蛋白的66%[26]相当,明显高于大豆蛋白的45%[26]以及谷物的15%[27]。图6(a)为必需氨基酸和非必需氨基酸对比图。随着氢分压的提高,氨基酸产量随氢分压的提高而增加,H40组、H60组、H80组、H100组的氨基酸产量分别为267.07、658.39、964.72、
1068.93 mg·L−1,但氨基酸中必需氨基酸和非必需氨基酸比例基本保持不变。图6(b)为不同氢分压下主要氨基酸含量对比图,在氢分压高于0.8 bar时(H80和H100),主要氨基酸的含量随着氢分压的提高而增加,其中包括人体所需要的必需氨基酸(缬氨酸、苏氨酸、异亮氨酸、苯丙氨酸、赖氨酸、亮氨酸),婴幼儿所需要的组氨酸和酪氨酸,呈味氨基酸(精氨酸),表明HOB生产的微生物蛋白具有成为食品营养添加剂和调味剂的潜力。图7为本研究H100组微生物蛋白中的主要氨基酸成分与细菌蛋白、鱼蛋白和大豆蛋白进行比较。H100微生物蛋白中各主要氨基酸含量均超过细菌蛋白、鱼蛋白和大豆蛋白中的氨基酸含量[16],说明其营养价值偏高,具有替代植物蛋白和动物蛋白来满足蛋白需求的潜力。
图8为不同氢分压下微生物蛋白中氨基酸相对含量。在不同氢分压下,各氨基酸的相对含量相似,说明氢分压不是改变氨基酸组成的关键因素。以H80为例,必需氨基酸中相对含量最高的分别为亮氨酸、缬氨酸、苏氨酸,其相对含量分别为8.3%、7.9%、6.2%,非必需氨基酸中相对含量最高的分别为谷氨酸、丙氨酸、天门冬氨酸,其相对含量分别为10.9%、10.7%、9.9%。其他重要氨基酸中,参与蛋白质合成的甲硫氨酸在不同氢分压中的相对含量在2.2%左右,婴幼儿所需要的组氨酸和酪氨酸在不同氢分压中相对含量分别在2.1%和3.0%左右。此外, 在H100微生物蛋白中还检测出 4种大豆蛋白中未含有的氨基酸,分别为天冬氨酸、丝氨酸、谷氨酸和脯氨酸。整体而言,H100微生物蛋白包含的主要氨基酸含量明显优于其他蛋白。
-
1) HOB体系的性能随氢分压的增大而加强,氢分压为0.8bar时,CO2固定速率和氨氮转化率最高,可达0.06 LCO2·(L·d)−1和68.48%。
2)当氢分压较高时(≥0.8 bar),HOB产微生物蛋白的能力得到显著增强,蛋白产量高于1.3 g·L−1,蛋白含量高于68%,且氨基酸产量高于950 mg·L−1。
3)通过关键因子的相关性分析,氢分压与HOB体系内各关键因子(除氨氮转化率)的相关性显著 (R2>0.8)。
不同氢分压对氨氮和CO2同步合成微生物蛋白的影响
Effects of different hydrogen partial pressure on microbial protein production via simultaneous conversion of CO2 and ammonia
-
摘要: 氢氧化细菌(HOB)可同步实现氨氮转化和CO2固定并产生微生物蛋白,具有广泛的应用价值。本研究探究不同氢分压对HOB体系内CO2固定、氨氮转化以及产蛋白过程的影响。结果表明,HOB体系的性能随氢分压的增大而加强。氢分压为0.8 bar时,细胞密度(OD620)和RuBP羧化酶浓度达到最大(OD620=0.50;酶浓度为(41.27±1.20) ng·L−1),同时CO2固定速率和氨氮转化率最高,分别为0.06L·(L·d)−1和68.48%。当氢分压较高时(≥0.8 bar), HOB产微生物蛋白的能力得到显著增强,蛋白产量高于1.3 g·L−1,蛋白含量高于68%,且氨基酸产量高于950 mg·L−1。通过关键因子的相关性分析,氢分压与HOB体系内CO2 固定速率、H2消耗速率、细胞干质量、粗蛋白含量的相关性显著(R2>0.8),与氨氮转化率之间存在显著的二次关系(R2=0.99)。因此,利用HOB合成微生物蛋白的过程中,可通过适当增加氢分压来优化系统运行,从而为后续高效、高质合成微生物蛋白的应用提供数据支持。Abstract: Hydrogen-oxidizing bacteria (HOB) can simultaneously convert ammonia and CO2 into microbial protein (MP), which has a great potential for application. This study investigated the effects of different hydrogen partial pressures on CO2 fixation, ammonia conversion and protein production in HOB system. The results showed that the HOB system was strengthened with the increment of hydrogen partial pressure. At the hydrogen partial pressure of 0.8 bar, the cell density (OD620) and the concentration of RuBP carboxylase reached the maximum vaules of OD620=0.50, concentration of enzyme was ((41.27±1.20) ng·L−1, respectively. Meanwhile, the CO2 fixation rate and ammonia conversion rate also reached the highest values of 0.06 L·(L·d)−1 and 68.48%, respectively. At the hydrogen partial pressure was equal to or higher than 0.8 bar, the capacity of HOB to produce MP was significantly enhanced, and the protein yield, protein content and amino acid yield were higher than 1.3 g·L−1, 68%, and 950 mg·L−1, respectively. The correlation analysis among the key factors indicated the significant linear correlations occurred between hydrogen partial pressure and CO2 fixation rate, H2 consumption rate, cell dry weight, or crude protein content in HOB system (R2>0.8), and a significant quadratic relationship occurred between hydrogen partial pressure and ammonia conversion rate (R2=0.99). Therefore, the system operation can be optimized through appropriately increasing the hydrogen partial pressure in the process of MP production via HOB. This study could provide data support and theoretical foundation for the high efficiency and quality of MP production in practical application.
-

-
表 1 不同氢分压下气体消耗量及RuBP羧化酶浓度
Table 1. Gas consumption and RuBP carboxylase concentration at different hydrogen partial pressures
反应器 H2累计耗气量/
(L·L−1)平均H2消耗速率/
(L·(L·d)−1)CO2累计固定量/
(L·L−1)平均CO2固定速率/
(L·(L·d)−1)CO2固定量/
H2消耗量RuBP羧化酶浓度/
(ng·L−1)H40 0.70±0.06 0.10±0.01 0.22±0.01 0.03±0.01 0.31 35.84±1.20 H60 2.44±0.10 0.35±0.02 0.31±0.02 0.04±0.01 0.13 36.08±1.40 H80 3.71±0.10 0.53±0.03 0.47±0.02 0.06±0.01 0.13 41.27±1.20 H100 4.43±0.10 0.63±0.01 0.46±0.01 0.06±0.01 0.10 33.95±1.00 表 2 不同氢分压下HOB的蛋白产量和氨氮利用情况
Table 2. Microbial protein production and ammonia utilization by HOB at different hydrogen partial pressures
反应器 CDW/
(g·L−1)氨氮转化率/
%粗蛋白产量/
(g·L−1)粗蛋白含量/
(%CDW)H40 0.65±0.05 21.21±1.20 0.49 76.8±1.20 H60 1.38±0.10 55.45±1.00 0.88 64.16±1.60 H80 2.02±0.08 68.48±2.10 1.37 68.17±1.10 H100 2.12±0.12 65.68±1.00 1.59 75.64±1.20 -
[1] COURT V, MCISAAC F. A representation of the world population dynamics for integrated assessment models[J]. Environmental Modeling & Assessment, 2020, 25(5): 611-632. [2] POPP A, CALVIN K, FUJIMORI S, et al. Land-use futures in the shared socio-economic pathways[J]. Global Environmental Change-Human and Policy Dimensions, 2017, 42: 331-345. doi: 10.1016/j.gloenvcha.2016.10.002 [3] ALEXANDER P, BROWN C, ARNETH A, et al. Losses, inefficiencies and waste in the global food system[J]. Agricultural Systems, 2017, 153: 190-200. doi: 10.1016/j.agsy.2017.01.014 [4] BOUWMAN A F, BEUSEN A H W, BILLEN G. Human alteration of the global nitrogen and phosphorus soil balances for the period 1970-2050[J]. Global Biogeochemical Cycles, 2009, 23(4). [5] EZEH A C, BONGAARTS J, MBERU B. Global population trends and policy options[J]. Lancet, 2012, 380(9837): 142-148. doi: 10.1016/S0140-6736(12)60696-5 [6] ERISMEN J W, SUTTON M A, GALLOWAY J, et al. How a century of ammonia synthesis changed the world[J]. Nature Geoscience, 2008, 1(10): 636-639. doi: 10.1038/ngeo325 [7] XIANG S Y, LIU Y H, ZHANG G M, et al. New progress of ammonia recovery during ammonia nitrogen removal from various wastewaters[J]. World Journal of Microbiology & Biotechnology, 2020, 36(144). [8] BENAKOVA A, JOHANIDESOVA I, KELBICH P, et al. The increase of process stability in removing ammonia nitrogen from wastewater[J]. Water Science And Technology, 2018, 77(9/10): 2213-2219. [9] ZHANG S P, LIU Z R. Advances in the biological fixation of carbon dioxide by microalgae[J]. Journal of Chemical Technology and Biotechnology, 2021, 96(6): 1475-1495. doi: 10.1002/jctb.6714 [10] SENBOKU H. Electrochemical Fixation of Carbon Dioxide: Synthesis of Carboxylic Acids[J]. Chemical Record, 2021, 21(9): 2354-2374. doi: 10.1002/tcr.202100081 [11] FAN X Y, ZHANG X M, ZHAO G H, et al. Aerobic hydrogen-oxidizing bacteria in soil: from cells to ecosystems[J]. Reviews in Environmental Science and Bio-Technology, 2022, 21(4): 877-904. doi: 10.1007/s11157-022-09633-0 [12] HU X N, VANDAMME P, BOON N. Co-cultivation enhanced microbial protein production based on autotrophic nitrogen-fixing hydrogen-oxidizing bacteria[J]. Chemical Engineering Journal, 2022, 429: 132535. doi: 10.1016/j.cej.2021.132535 [13] ZHANG W, NIU Y, LI Y X, et al. Enrichment of hydrogen-oxidizing bacteria with nitrate recovery as biofertilizers in the mixed culture[J]. Bioresource Technology, 2020, 313: 123645. doi: 10.1016/j.biortech.2020.123645 [14] 陶虎春, 谢勇, 张丽娟, 等. 一株氢氧化细菌的生长条件及其对不同氮源利用的研究[J]. 北京大学学报(自然科学版), 2021, 57(4): 756-764. [15] 王瑾, 王喆之, 董忠民. 土壤氢氧化细菌促进作物生长机理研究进展[J]. 应用与环境生物学报, 2012, 18(5): 853-861. [16] MATASSA S, VERSTRAETE W, PIKAAR I, et al. Autotrophic nitrogen assimilation and carbon capture for microbial protein production by a novel enrichment of hydrogen-oxidizing bacteria[J]. Water Research, 2016, 101: 137-146. doi: 10.1016/j.watres.2016.05.077 [17] VOLOVA T G, BARASHKOV V A. Characteristics of Proteins Synthesized by Hydrogen-Oxidizing Microorganisms[J]. Applied Biochemistry and Microbiology, 2010, 46(6): 574-579. doi: 10.1134/S0003683810060037 [18] 刘延峰, 邓梦婷, 陈坚. 微生物替代蛋白生物制造: 进展与展望[J]. 中国食品学报, 2022, 22(6): 1-5. [19] HARPER S R, POHLAND FG. Recent developments in hydrogen management during anaerobic biological wastewater treatment. Biotechnol Bioeng 1986;28(4): 585-602. [20] LI K, GONG H, LIU Y, et al. Hydrogenotrophic methanogenic granular sludge formation for highly efficient transforming hydrogen to CH4[J]. Journal of Environmental Management, 2022, 303: 113999. doi: 10.1016/j.jenvman.2021.113999 [21] 李孝越, 王悦, 贾佩, 李雅洁, 陈佳琪, 金丽军, 王雯, 杨紫怡. 微生物燃料电池回收氨氮合成微生物蛋白研究[J]. 中国环境科学, 2023, 43(3): 1152-1159. [22] ONODA Y, HIKOSAKA K, HIROSE T. Seasonal change in the balance between capacities of RuBP carboxylation and RuBP regeneration affects CO2 response of photosynthesis in Polygonum cuspidatum[J]. Journal of Experiment Botany, 2005, 56(412): 755-63. doi: 10.1093/jxb/eri052 [23] KIM B W, CHANG H N, KIM I K, et al. Growth kinetics of the photosynthetic bacterium Chlorobium thiosulfatophilum in a fed-batch reactor[J]. Biotechnology and Bioengineering, 1992, 40(5): 583-592. doi: 10.1002/bit.260400505 [24] LIN L, HUAANG H, ZHANG X, et al. Hydrogen-oxidizing bacteria and their applications in resource recovery and pollutant removal[J]. Science of the Total Environment, 2022, 835: 155559. doi: 10.1016/j.scitotenv.2022.155559 [25] BURGDORF T, LENZ O, BUHRKE T, et al. [NiFe]-Hydrogenases of ralstonia eutropha H16: Modular Enzymes for oxygen-tolerant biological hydrogen oxidation[J]. Journal of Molecular Microbiology and Biotechnology, 2006, 10(2/3/4): 181-196. [26] HU X N, KERCKHOFF M, GHESQUIEER J, et al. Microbial rotein out of thin Air: Fixation of nitrogen gas by an autotrophic hydrogen-oxidizing bacterial enrichment[J]. Environmental Science & Technology, 2020, 54(6): 3609-3617. -



 下载:
下载: