-
内分泌干扰物(endocrine disrupting chemicals,EDCs)也称为环境激素(environmental hormone),是一类外源性干扰内分泌系统的化学物质,可分为多卤联苯类、邻苯二甲酸酯类、酚类、重金属类、有机锡类等,通过干扰激素的合成、分泌、运输、代谢和结合,从而影响生物平衡、发育、生殖过程[1]。EDCs通过食物、水源等各种途径进入生物体内,部分EDCs脂溶性较强,可通过食物链富集,且EDCs化学性质稳定,可在机体内长期蓄积难以排出体外[2],因此,即使低浓度的摄入都可能会对生物体产生危害[3-4]。EDCs的毒作用机制大体上可分为直接与受体结合、与激素以外的生物大分子结合、影响内分泌系统与其他系统的协调作用、作用于细胞信号传导通路、与天然激素竞争、抑制微管聚合、增加体内自由基含量和引起细胞凋亡等方面[5]。对生物个体宏观方面的影响主要表现为性激素分泌量及活性下降、雄性物种雌性化、精子数量减少、生殖器官异常、各种癌症发病率(尤其是女性乳腺癌)增加,以致生殖能力下降,后代的健康和成活率降低等[6-10],严重威胁人类和野生动物的物种繁衍和长期生存。
城镇污水处理厂出水被认为是流域EDCs的主要来源,主要因为常规的污水处理设备难以将生活污水中的此类物质完全清除[11]。养殖行业是另一个重要污染来源,为控制家禽家畜的发情周期、治疗生殖障碍、诱导流产等[12-13],会对动物使用大量的类固醇类药物,导致动物排泄物中含有大量的EDCs,并随污水排放或雨水冲刷进入流域。此外,伴随着农业的发展,水源水中检测出多种农药类EDCs[14]。国内外已开展了不少针对EDCs在流域中的污染工作研究。早在1980年,McLachlan等[15]最先开展环境中的EDCs浓度水平研究,而国内邵兵等[16]在2002年首次对重庆流域中的壬基酚污染情况进行报道。杨毅等发现农药、化肥等农资的不规范使用是柏木河中EDCs污染的主要原因[17]。刘畅伶等发现珠江口人为活动活跃河段的EDCs浓度水平较高[18]。
北江是珠江第二大水系,是流域内百万多人口的重要饮用水源地之一。随着工农业的发展,环境中EDCs污染物的累积量同益增加,环境风险也在逐步累积。近年来,已有不少研究开展对北江流域内EDCs的污染研究,化合物集中在多环芳烃(polycyclic aromatic hydrocarbons,PAHs)[19]、重金属[20]、邻苯二甲酸酯(phthalic acid esters,PAEs)[21]、有机氯农药(Organochlorine pesticides,OCPs)[22]等,方向多为污染水平和生态风险,鲜少有对雌激素类、其他农药的研究。目前暂无结合当地多种产业结构,详细分析不同产业下游水体的EDCs水平及影响因素的研究。从源头上减排是当前对EDCs排放进行有效控制的主要方法,因此对EDCs的主要来源行业详细分析,有望提高流域EDCs防治政策可行性。因此,本研究针对北江中下游使用EDCs的行业类型、产品种类、规模、分布区域等情况,调查北江中下游EDCs浓度分布,分析其主要来源及生态风险,旨在加强污染源与污染物浓度之间的联系,防范EDCs对流域环境带来的潜在风险。
-
(1)仪器与材料:AB SCIEX API4000+ MS/MS三重四极杆质谱仪,购于美国应用生物系统公司;Agilent GC/MS(7890B-5977A),Agilent 1260液相色谱仪,HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm),HP-FFAP毛细管柱(30 m×0.25 mm×0.25 μm),ZORBAX Eclipse Plus C18色谱柱(2.1 mm×100 mm,1.8 μm),购于美国安捷伦科技有限公司;氮吹浓缩仪(N-EVAP系列),购于美国Organomation公司;水浴锅,购于上海智诚分析仪器制造;Milli-Q 超纯水系统,购于德国默克公司;R-215旋转蒸发仪,购于瑞士Buchi公司;2.5 L棕色玻璃瓶,购于广州市酷泰贸易有限公司。
(2)试剂与材料:乙酸乙酯、乙腈、甲醇、丙酮、二氯甲烷和正己烷,均为色谱纯,购于Merck公司;硫酸、盐酸、SnCl2、双酚A、17-β-雌二醇、炔雌醇、雌酮、己烯雌酚、辛基酚、壬基酚、代森锰锌、氯氰菊酯和氰戊菊酯标准溶液均购于上海安谱实验科技股份有限公司;内标标准溶液双酚A-d4、雌四醇-d4、雌酮-d4和蒽醌-d8购于上海安谱实验科技股份有限公司;HLB小柱(6 cc,500 mg),购于Waters公司;玻璃纤维滤膜(142 mm、70 mm、0.45 μm,Whatman GF/F),购于UK公司;固相萃取膜片(C18 ENVI DISK,45 mm),购于美国色谱科公司。
-
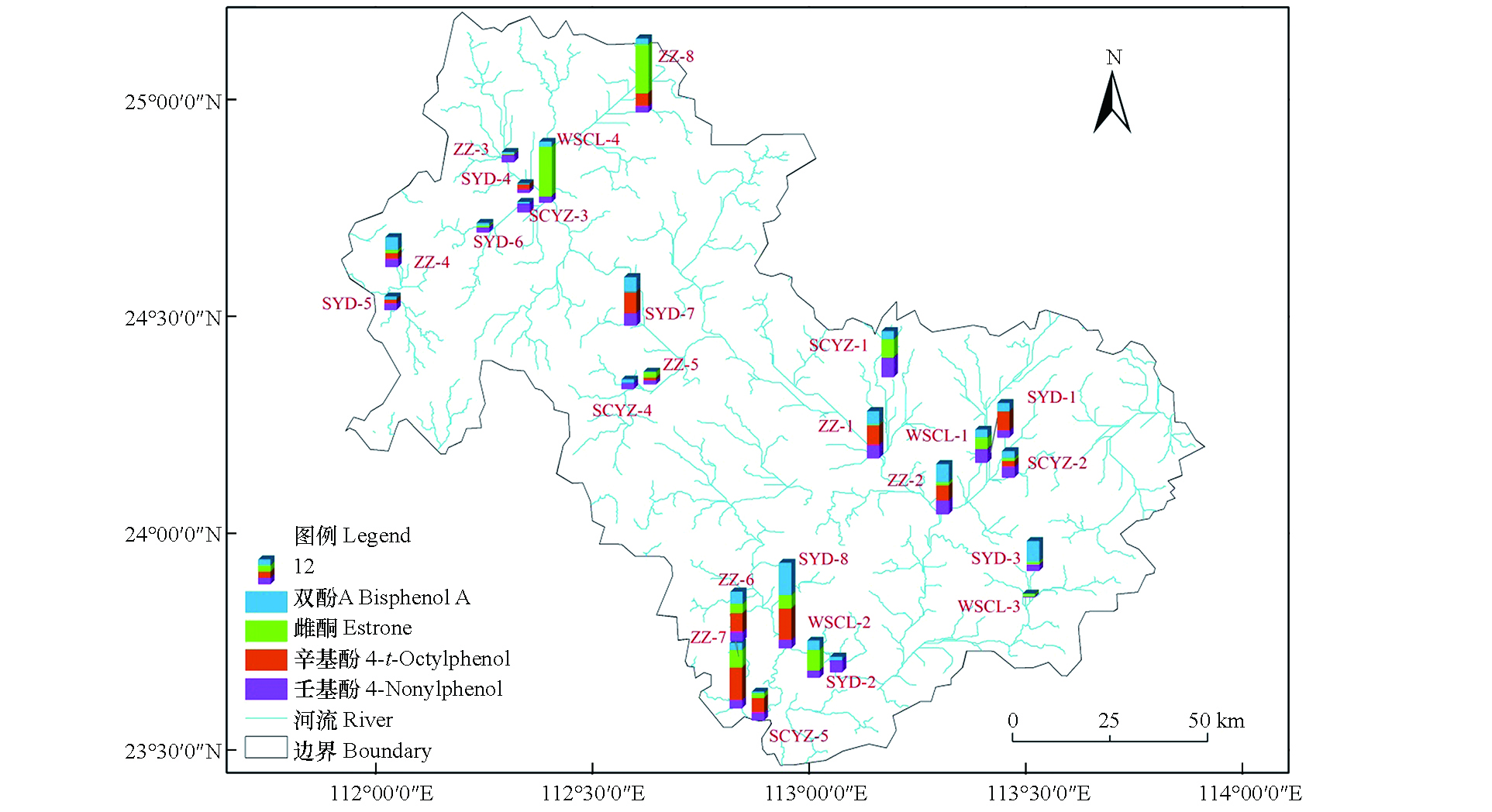
本文选择北江中下游作为研究区域,区域内有县级以上在用饮用水源地11个,本研究在该区域8个区县各选取一个县级以上饮用水源地(SYD1-8)进行监测,监测位点尽量与现有水源地监控断面一致;4个不同类型污水处理厂(WSCL1-4)的出水口进行监测;8个主要种植区县(ZZ1-8)和5个主要水产养殖区县(SCYZ1-5)下游设置监测位点,采样位点如图1所示,各采样位点详细信息见表1。2017年9月在各监测点位进行了样品采集,每个监测点以2.5 L棕色玻璃瓶采集水样3瓶,水样采集时取同一截面水平面0.5 cm以下,左中右3个点的混合样。采集后的水样立即加入50 mL色谱纯甲醇和400 μL硫酸(4 mol),置于4 ℃冰盒中运回实验室,并于48 h内进行前处理。
-
本研究以1997年世界野生动物基金会(WWF)公布的68种EDCs为研究范围,去除国家明令禁止使用的EDCs类化学品(如苯菌灵、除草醚等),去除无商业用途与使用价值(如苯并(a)芘、二噁英、八氯苯乙烯等)的化学品及常规监测指标(如重金属等)。同时结合EDCs类化学品的当地的生产使用情况,选择广泛应用于增塑剂的双酚A[23];用作表面活性剂的辛基酚与壬基酚[24];低浓度下即能影响人体内分泌系统的雌酮、17-β-雌二醇、人工合成雌激素炔雌醇和已烯雌酚[25-26];北江中下游种植业用量最大的杀菌灭虫剂代森锰锌与高氰戊菊酯;北江中下游水产养殖业中用量最大的灭虫剂氯氰菊酯,具体检测指标及详细信息见表2。
-
前处理:1 L水样依次使用142 mm、70 mm GF/F滤膜过滤,滤膜在采样前后准确称量并记录。滤液再通过0.45 μm GF/F玻璃滤膜进行过滤,在过滤液中加入内标,以5—10 mL·min−1的速度通过HLB小柱,真空抽干HLB柱(1 h),用甲醇和二氯甲烷依次洗脱,混合洗脱液氮吹至近干,甲醇定容至1 mL,通过0.45 μm滤膜过滤后放棕色进样瓶,−20 ℃保存待测。
仪器分析:Agilent 1260系列液相色谱用于目标化合物的分离,使用ZORBAX Eclipse Plus C18色谱柱,柱温30 ℃,进样体积10 μL,流动相为乙腈(A)和5 mmol·L−1乙酸铵水溶液(B),流速为400 μL·min−1。梯度洗脱程序如下:A相比例在0—0.5 min为10%,0.5—2 min上升至40%,2—4 min上升至70%,4—11 min上升至87%,11—11.5 min下降至10%,11.5—14 min保持10%。AB SCIEX API4000+ MS/MS系列四极杆质谱用于目标化合物的检测,质谱条件为,电喷雾电离源(ESI),负离子源电离模式,MRM扫描,离子喷雾电压−5500 V,载气温度600 ℃。
-
(1)代森锰锌
前处理:用自来水将板式过滤器冲洗干净,用约1 L的纯水抽滤,丙酮搽拭过滤盘后待用。连接板式过滤器,将样品充分混匀,经过装有142 mm GF/F玻璃纤维滤膜的板式过滤器进行过滤,过水速率约为每秒1—2滴,过滤后把玻璃纤维滤膜和滤出液分别收集。玻璃纤维滤膜晾干放入干燥器中,滤出液进入样品制备阶段。取10 g的SnCl2,用5 mol盐酸水溶液定容到500 mL,配制成SnCl2-HCL混合溶液。取30 mL滤出液加入到40 mL SnCl2-HCL混合溶液中,充分摇匀后置于80 ℃水浴2 h,待样品充分反应后装入进样小瓶待测。
仪器分析:Agilent GC(7890B)用于目标化合物的分析,进样口温度250 ℃,柱温50 ℃保持4 min,分流比15:1,进样体积50 μL,顶空进样;色谱柱为HP-FFAP毛细管柱(30 m×0.25 mm×0.25 μm)。
(2)氯氰菊酯和氰戊菊酯
前处理:以0.45 μm GF/F玻璃纤维滤膜进行过滤,过滤后的水样采用六通道固相萃取膜片进行目标物富集,每2 L水样富集在一张固相萃取膜片上,水样过滤后,真空抽干1 h,然后每张固相萃取膜片分别以15 mL乙酸乙酯和15 mL二氯甲烷洗脱,合并所有洗脱液,旋转蒸发浓缩至近干,以二氯甲烷定容至5 mL,过0.45 μm有机相滤膜后,于棕色小瓶中–20 ℃保存,取1 mL样品,加入内标,浓缩至200 μL,待测。
仪器分析:Agilent GC/MS(7890B-5977A) 用于目标化合物的分析,使用电子轰击电离源(EI),选择离子检测(SIM)。载气为氦气,流速1.0 ℃·min−1,不分流进样,进样体积1 μL,进样口温度300 ℃,离子源温度250 ℃;四极杆温度150 ℃。色谱柱为HP-5 MS毛细管柱(30 m×0.25 mm×0.25 μm),升温程序:从55 ℃(保持2 min)以20 ℃·min−1升温至160 ℃(保持5 min),再以2 ℃·min−1升温至200 ℃,以4 ℃·min−1升温至240 ℃(保持3 min),最后以5 ℃·min−1升温至290 ℃(保持5 min)。
-
分别制备空白组、空白加标组,每组设置3个平行,按照1.4节检测方法对样品进行前处理,上机检测。每次测定样品前均重新配制工作液作标准曲线,前后两次相差均不超过10%。各检测指标的检出限与加标回收率如表3所示。
-
利用Excel 2010进行数据梳理,IBM SPSS22.0进行统计分析。
-
采用风险商(RQ)值法评估所监测点位抗生素的生态风险,评价流程如下:
(1)推导预测无效应质量浓度(PNEC)值,即生态风险阈值。PNEC值表示在现有科学认知水平下,确认化合物不会对水生生物造成不利影响的最大效应浓度值。根据欧盟风险评价指南(European Commission)推荐的评价因子法(assessment factor, AF),结果如表4所示。
(2)监测水体中抗生素的RQ值可根据化合物的实际监测质量浓度(MEC)和生态风险阈值进行计算,以评价抗生素类污染物的生态风险水平。计算公式如下:
其中,RQtotal为目标化合物在某监测水体的加和生态风险商值(无量纲),RQi为化合物i的RQ值(无量纲)。根据RQ的大小,可以将生态风险划分成4个等级:无风险或最低风险(RQ<0.01),低风险(0.01≤RQ<0.1),中等风险(0.1≤RQ<1)和高风险(RQ≥1)。
-
对各监测点位的水样进行检测分析,10种目标EDCs有6种低于检出限,仅双酚A、壬基酚、辛基酚和雌酮有检出,各污染物浓度范围、检出情况详见表5,各类型监测点位污染物浓度水平及组成详见图2。北江中下游水体中的主要EDCs种类为双酚A、辛基酚,在25个监测点位中均有检出,平均浓度分别为360 ng·L−1和382 ng·L−1。其中,壬基酚浓度水平远高于太湖[29]、巢湖[30]、长江南京段[31](平均浓度分别为29.6 ng·L−1、38.6—86.1 ng·L−1和199 ng·L−1);双酚A浓度水平远高于太湖[29]、巢湖[30]、长江南京段[31](平均浓度分别为17.5 ng·L−1、7.3—224.9 ng·L−1和119 ng·L−1)的浓度水平,但与黄河[32]、辽河[33]和珠江[34](平均浓度分别为534 ng·L−1、536.9 ng·L−1、117—685 ng·L−1)的浓度相接近,在全国范围内处于相对较高水平。壬基酚与双酚A的高浓度水平与其大量的生产和使用密不可分,据报道2011年壬基酚在中国的产量达30000 t,双酚A为26000 t[35]。
双酚A在各类型水样的浓度依次为水源地(浓度范围为42—1385 ng·L−1,平均浓度465 ng·L−1)>种植区(浓度范围为43—794 ng·L−1,平均浓度401 ng·L−1)>污水处理厂(浓度范围为33—416 ng·L−1,平均浓度259 ng·L−1)>水产养殖区(浓度范围88—360 ng·L−1,平均浓度206 ng·L−1)。壬基酚在各类型水样的浓度依次为水产养殖业(浓度范围为250—892 ng·L−1,平均浓度471 ng·L−1)>种植业(浓度范围为194—637 ng·L−1,平均浓度397 ng·L−1)>水源地(浓度范围为149—574 ng·L−1,平均浓度343 ng·L−1)>污水处理厂(浓度范围为54—614 ng·L−1,平均浓度317 ng·L−1)。壬基酚可以用作农药乳化剂,农药乳化剂的大量使用可能是导致种植业下游有较高的检出浓度的原因之一。辛基酚在各类型水样的浓度依次为种植区(浓度范围为n.d.—7.17 ng·L−1,平均浓度3.03 ng·L−1)>水源地(浓度范围为n.d.—6.96 ng·L−1,平均浓度2.41 ng·L−1)>水产养殖业(浓度范围为n.d.—3.33 ng·L−1,平均浓度1.20 ng·L−1)>污水处理厂(未检出)。雌酮在各类型水样的浓度依次为污水处理厂(浓度范围为n.d.—3.90 ng·L−1,平均浓度1.65 ng·L−1)>种植区(浓度范围为n.d.—3.79 ng·L−1,平均浓度1.06 ng·L−1)>水产养殖业(浓度范围为n.d.—1.43 ng·L−1,平均浓度0.73 ng·L−1)>水源地 (未检出)。
-
不同水源地EDCs的浓度差异明显,其中位于流域西北部河流上游的SYD-4水样中双酚A和壬基酚浓度较其他水源地最低,EDCs总浓度为193 ng·L−1。东南部的河流下游SYD-8水源地水样中EDCs类化学品总浓度最高,EDCs总浓度达1770 ng·L−1,有典型的沿河流流向富集加强的趋势。水源地的类型对EDCs总浓度也有明显影响,河流型的水源地由于承受上游的污染物压力,EDCs总浓度平均值为835 ng·L−1,高于湖泊型水源地约50 ng·L−1。调查县区常住人口、第一至第三产业生产总值对双酚A、壬基酚、辛基酚的流域浓度的影响发现,壬基酚与第二产业生产总值的相关性较好,皮尔森相关系数为0.51,辛基酚则第一产值生产总值有明显相关性(r=0.65),说明两者可能分别来源于第二与第一产业。而双酚A的浓度与四个指标均无显著相关性,说明双酚A的使用与来源广泛。
不同农产品种植区监测位点水样中EDCs浓度也有较大差别,其中非农业大县的ZZ-5位点种植区监测位点水样中EDCs总浓度最低(237 ng·L−1),甚至低于农业大县的ZZ-2位点EDCs总浓度(1434 ng·L−1)的1/5。区域种植业EDCs化学品的总种植面积和第一产业生产总值有显著正相关性,皮尔森系数分别达到0.86与0.83,说明宏观统计数据一定程度上能反映附近水体中EDCs浓度水平,也说明了种植业生产过程使用的EDCs容易通过土地渗入进入流域。种植种类对流域EDCs浓度有一定影响,水果种植下游平均总浓度为858 ng·L−1,高于水稻蔬菜种植下游平均总浓度为707 ng·L−1。可能与水果种植的单位面积EDCs类农药使用量有关,据2017年渝北区[36]、2016年福建省尤溪县[37]农药抽查统计结果,水果的单位面积农药使用量为水稻蔬菜的2—3倍。
水产养殖业呈现明显的EDCs东高西低随河流富集特征,位于东部的SCYZ-1位点检出的双酚A、雌酮和壬基酚均为5个位点中的最高值,总浓度为1254 ng·L−1。而分散于研究区域西部、中部与南部的SCYZ-3到SCYZ-5EDCs总浓度水平均只在400 ng·L−1水平。此外,与种植业类似,水产养殖业EDCs浓度与周边生产情况关系显著。EDCs总浓度与区域渔业总捕捞量、总养殖面积显著相关,皮尔森相关系数分别为0.51与0.70。说明水产养殖产业是局部EDCs重要来源,也说明水产养殖业使用的EDCs较容易进入附近水体。养殖的种类也会对EDCs浓度水平产生影响,四大家鱼(青鱼、草鱼、鲢鱼、鳙鱼)的养殖区域平均EDCs总浓度水平为841 ng·L−1,远远高于养殖虾、鳖、鳗鱼等的区域(433 ng·L−1)。
调查的4个污水处理厂均为城镇生活污水处理厂出水口,EDCs的浓度可能受接收水质影响较大,而受地域与河流流向富集影响较小。4个位点中位于东北部的WSCL-1污水处理厂EDCs浓度水平最高达到974 ng·L−1,位于东部的WSCL-3的浓度水平最低总浓度仅为87.1 ng·L−1,只有WSCL-1的约9%。研究结果与推测相一致,EDCs总浓度与污水处理厂的设计污水处理量与人口紧密相关,皮尔森相关系数分别为0.738与0.819。通过污水处理厂及其最近水源地位点EDCs浓度比较可见(WSCL-1对应SYD-1如此类推),除了WSCL-3,其余的污水处理厂EDCs浓度要较最近水源地位点高56—209 ng·L−1。说明尽管污水处理厂能一定程度上降低EDCs的浓度,但难以完全去除,大量高浓度的生活废水经处理后EDCs浓度仍会高于一般的流域水体浓度,使污水处理厂也成为流域EDCs的主要贡献来源。
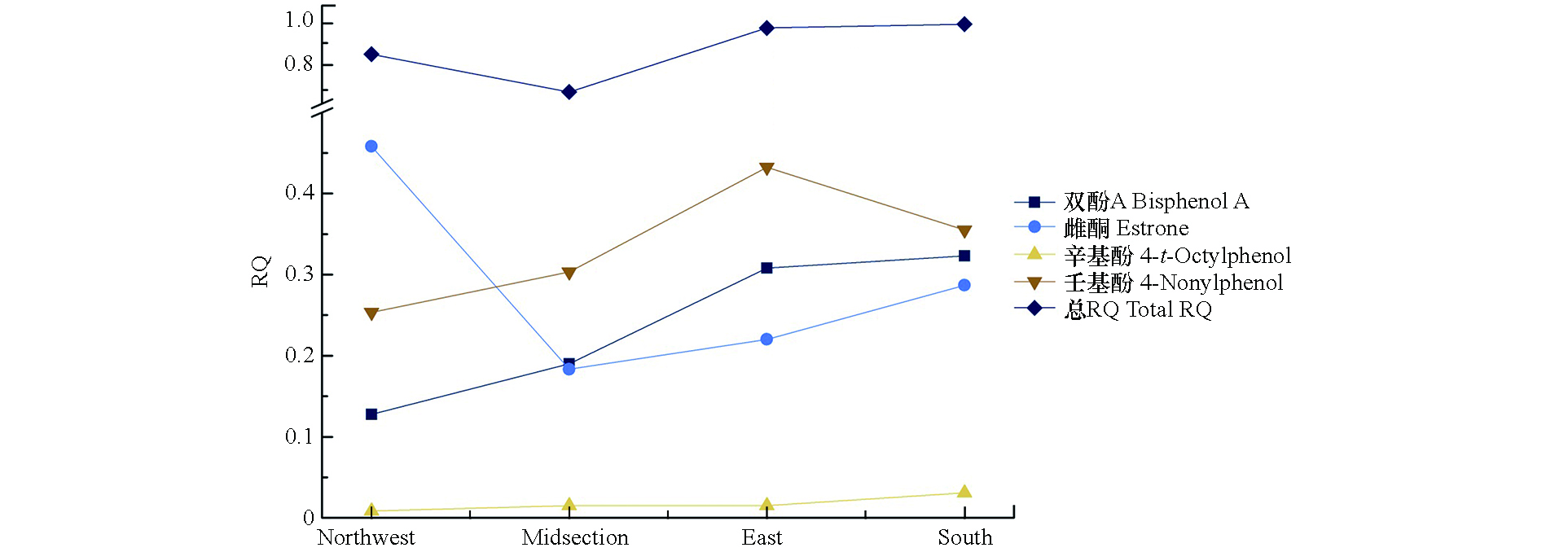
EDCs占自身总量比例的地域分布如图3所示,流域的EDCs总体呈西北低(478 ng·L−1),东(949 ng·L−1)南(887 ng·L−1)部高的空间分布特征。说明随着河流流进,沿途的化工、种植、水产与生活等污水中的EDCs排放速率高于自然降解/吸附速率,导致EDCs沿河流流向不断积累,下游将较上游表现出更高的生态风险。其中,双酚A、壬基酚、辛基酚的空间分布情况同总EDCs,雌酮的分布则与其他3种的分布特征不同,呈西北部高(1.37 ng·L−1)、东(0.66 ng·L−1)南(0.86 ng·L−1)部低的特征,来源自上游的可能性较高。
-
生态风险评价结果如表6所示。双酚A与壬基酚的RQ值范围较为类似,双酚A为0.022—0.924(
$ \overline {{\rm{RQ}}}=0.240 $ $ \overline {{\rm{RQ}}}=0.341 $ $ \overline {{\rm{RQ}}}=0.017 $ $ \overline {{\rm{RQ}}}=0.308 $ -
(1)10种目标EDCs有6种低于检出限,仅双酚A、壬基酚、辛基酚和雌酮有检出,其中双酚A、壬基酚为北江中下游中主要EDCs,平均浓度分别为360 ng·L−1和382 ng·L−1,在全国范围内属较高浓度水平。
(2)水源地中辛基酚与壬基酚分别与第一第二产业总值有明显相关性;种植业、水产养殖业下游EDCs主要受区域种植、养殖面积影响,同时随种植、养殖的产品种类发生变化;设计处理量与服务人口与污水处理厂出水EDCs浓度成正比,污水处理厂无法完全去除EDCs成为流域污染的一个重要来源。
(3)北江中下游EDCs总生态风险处于中等偏高水平。双酚A、辛基酚与壬基酚流域风险随水流流向呈西北低,东南高走向。雌酮的分布特征相反,说明上游为主要来源。
Spatial distribution, ecological risk and industry-dependence of endocrine disrupting chemicals in the Beijiang River, South China
- Received Date: 10/08/2020
- Available Online: 27/12/2021
-
Key words:
- Beijiang River /
- endocrine disrupting chemicals /
- spatial distribution /
- ecological risk /
- industry-dependence
Abstract: Ten endocrine disrupting chemicals (EDCs) in water of the Beijiang River, South China were analyzed using LC-MS/MS and GC-MS to understand the spatial distribution and ecological risk. The samples were collected from water sources, typical planting industries, typical aquaculture industries, and wastewater treatment plants. The results showed that only bisphenol A, 4-nonylphenol, 4-tert-octylphenol and estrone were detected in the Beijiang River. Bisphenol A and 4-nonylphenol were the main EDCs, and the average concentrations were 360 ng·L−1 and 382 ng·L−1, respectively. Analysis of spatial distribution and influencing factors showed that macro factors determined the overall level of EDCs. 4-tert-octylphenol and 4-nonylphenol in water sources were significantly correlated with the total values of the first and second industries, respectively. Regional concentrations were affected by industry types, product categories and upstream/downstream locations. The concentrations of EDCs of downstream planting and aquaculture were mainly subject to planting and aquatic breeding areas, followed by the planting and aquatic breeding products. There was a strong positive correlation between the designed capacities and the service population and the concentrations of EDCs in effluent from wastewater treatment plants. The ecological risk of bisphenol A, 4-nonylphenol and 4-tert-octylphenol gradually increased with the runoff directions of the basin, indicating that the analysis of the ecological risk change rates of the river section is helpful to determine the sources of EDC pollution.






 DownLoad:
DownLoad:
